烟草细胞质雄性不育系K326MADS-box和SUPERMAN基因的特征
崔芳芳 孟林峰 刘苗苗 张建强 王建革,* 刘齐元,*
烟草细胞质雄性不育系K326和基因的特征
崔芳芳1孟林峰1刘苗苗2张建强2王建革2,*刘齐元1,*
1江西农业大学农学院 / 作物生理生态与遗传育种教育部重点实验室, 江西南昌 330045;2江西农业大学林学院, 江西南昌 330045
细胞质雄性不育是杂种生产的重要工具, 也是研究细胞核与细胞质互作的良好系统, 但其机制仍不清楚。本研究以细胞质雄性不育系K326为材料, 研究了烟草细胞质不育系雄蕊异常与花发育基因表达的关系。细胞质雄性不育系K326源于普通烟草天然不育株, 用烤烟品种K326连续回交培育而成, 不仅具有心皮化雄蕊现象, 同时也有花瓣化雄蕊现象, 异常雄蕊基部融合为一体。本研究首先用生信手段对控制普通烟草花发育的基因和边界基因进行了全基因组鉴定, 分析了它们染色体定位和共线性, 预测了B类基因和基因的顺式作用元件, 并研究了它们在不育系和保持系不同时期花蕾中的表达特征。结果表明, 烟草共鉴定出160个基因和5个基因。这些基因中有7个B类基因(4个基因, 3个基因), 79个基因定位于22条染色体上, 3个基因定位于3条染色体上。共线性分析表明, 串联和片段DNA重复、倍加作用是基因家族扩张的驱动力。观察发现, 细胞质雄性不育系K326异常雄蕊在小蕾期就已出现, 暗示细胞质雄性不育K326中雄蕊异常是早期分生组织发育缺陷的结果。qPCR检测表明, 细胞质雄性不育系及保持系中可以检测到7个B类基因和1个基因表达。基因表达水平在保持系各个时期均高于不育系;基因、表达水平在保持系各个时期均低于不育系; 其他基因呈现小蕾期和大蕾期下调, 中蕾期上调。基因只在保持系小蕾和中蕾期可以检测到, 而不育系各个时期中均无法检测到; 顺式作用元件分析表明,具有生长素响应元件AuxRR。因此, 生长素可能在烟草细胞质逆行调控细胞核起重要作用。
烟草; 细胞质雄性不育;;; 生长素
在植物长期进化过程中, 基因的正确表达有赖于核质协调, 核质失调会导致植物生长发育异常, 细胞质雄性不育是核质互作失调典型例子之一[1]。细胞质雄性不育是指无法产生功能花粉或产生的花粉败育但雌蕊正常的现象。从表型上看, 细胞质雄性不育表现一系列变异: 花粉败育、花药退化、雄蕊心皮化、雄蕊花瓣化[2]。这种现象表现为母系遗传, 在开花植物中广泛存在, 是一些作物杂种优势利用的重要工具[1-2]。
细胞质雄性不育的机制已进行过大量研究。在玉米[3-4]、水稻[5]、番茄[6]、萝卜[7]、油菜[2]、辣椒[8]、小麦[9]、烟草[10]等许多物种研究表明, 细胞质不育与线粒体DNA重排、产生新开放阅读框(open reading frame, ORF)或嵌合开放阅读框有关。但需要注意的是, 并非所有细胞质雄性不育机制的研究都支持这个结论, 因为有些与CMS相关的ORF是假定的, 那些ORF变异与细胞质雄性不育表型不能关联在一起[11-12]。烟草细胞质雄性不育中检测到了线粒体DNA重排, 但未检测到新或嵌合ORF产生[10]。这反映了细胞质雄性不育机制的复杂性。
细胞质雄性不育中雄蕊退化、雄蕊花瓣化、雄蕊心皮化现象与核基因引起的同源异型现象非常相似。在转育到不同细胞核背景下时, 这些现象仍然表现稳定[1,9]。它们具有相同的细胞质, 但细胞核不同, 由于它们细胞核中花发育基因是完整的, 清楚地表明它们的花发育基因表达受到了影响。上述现象清楚地表明细胞核不仅可以对细胞质进行调控, 细胞质也可以逆向调控细胞核[13]。
细胞质基因如何逆向调控细胞核基因, 目前还不是特别清楚, 但也取得了一些进展。雄蕊异常细胞质雄性不育系的花雄蕊异常出现在器官原基形成的早期[2,14], 这表明花分生组织发育出现了缺陷。因此, 核质互作不仅影响到花器官发生, 而且负责第2轮和第3轮器官分化的基因表达调控也受到影响。许多雄蕊异常细胞质雄性不育系出现了雄蕊与雌蕊边界消失[2], 说明边界基因的表达也受到了影响。在许多雄蕊心皮化和雄蕊花瓣化细胞质雄性不育系中,不仅检测到了线粒体DNA重排, 同时也检测到了B类或C类基因表达下调[13]。此外, 雄蕊心皮化细胞质雄性不育系常发生第3轮雄蕊与第4轮雌蕊边界消失, 边界基因表达下调[13]。细胞质雄性不育系烟草Nta(rep)具有异常雄蕊, 过表达拟南芥基因植株花器官第3轮和第4轮之间的边界得以恢复, 雄蕊形态得到显著改善, 并能产生少量但有功能的花粉[15]。由此看来, 边界基因应在B基因下游起作用。
突变体研究表明, 雄蕊发育异常并非源自雌雄蕊相互转化, 而是第4轮干细胞过度增殖[16]。基因编码一个C2H2型锌指蛋白, 以细胞自主方式阻止基因在第4轮中表达, 促进花第4轮干细胞终止[16], 它通过控制生长素合成来调控花第3轮和第4轮的边界[17]。许多过表达基因植株变小, 可能与生长素缺陷有关[18]。
烟草细胞质雄性不育中, 雄蕊退化、雄蕊心皮化和雄蕊花瓣化现象均有发现, 但都来源于异细胞质和胞质融合。我们课题组从普通烟草()晒烟品种“铁骨烟”中发现天然不育株, 用烤烟品种K326连续回交, 培育出了细胞质雄蕊异常雄性不育系K326。从表型上看, 烟草细胞质雄性不育系K326与异细胞质及胞质融合造成的细胞质雄性不育烟草异常雄蕊发育相同, 它们是否具有同样机制是值得研究的一个问题。通过对普通烟草花发育基因全基因组鉴定和特征分析, 利用qPCR技术检测了不同花发育时期细胞质雄性不育系K326中B类和基因的表达。研究结果将为揭示烟草细胞质雄性不育机制提供参考。
1 材料与方法
1.1 试验材料
烟草细胞质雄性不育系K326及保持系种植于江西农业大学科技园试验田内。盛花期分别取小蕾(<3 mm)、中蕾(3~5 mm)和大蕾(>5 mm)期细胞质雄性不育系K326和保持系花蕾, 一部分用FAA (50%酒精∶冰醋酸∶甲醛=18∶1∶1)固定, 另一部分立刻投入液氮中后于-80℃冰箱中保存, 用于RNA提取, 3次生物学重复。FAA固定的花蕾24 h后于75%酒精中4℃保存, Optec SZ780体视显微镜观察。
1.2 MADS-box和SUPERMAN基因鉴定
从茄科基因组网站(https://solgenomics.net/)下载普通烟草()、渐狭叶烟草()、番茄()基因组数据, 从PFAM网站(http://pfam.xfam.org/)下载基因种子文件PF00319和PF01486。利用种子文件对所有蛋白数据进行扫描, E-value值为1e-10, 候选基因利用NCBI-CDD (https://www.ncbi.nlm.nih.gov/cdd)[19]进行鉴定, 最终确认的基因用TAIR (https:// www.arabidopsis.org/)进行注释、分类。利用拟南芥SUP蛋白对下载蛋白数据进行blast比对,-value为1e-10, 利用NCBI-CDD (https://www.ncbi.nlm.nih. gov/cdd)[19]鉴定, 用TAIR (https://www.arabidopsis. org/)进行注释、分类, 获得烟草基因。
1.3 烟草MADS-box基因和SUPERMAN基因染色体定位和共线性
染色体定位、共线性分析是研究基因家族扩张的重要手段。根据烟草基因组注释文件, 利用MG2C (http://mg2c.iask.in/mg2c_v2.1/)[20]对烟草和基因进行了染色体定位分析, 利用TBtools[21]对烟草基因进行了物种内共线性分析。烟草属中只有普通烟草()和渐狭叶烟草()进行了染色体定位, 因此进行物种间共进化分析时, 以番茄()为外类群, 对普通烟草及渐狭叶烟草进行了物种间共线性分析。
1.4 烟草B类和SUPERMAN基因顺式作用元件分析
根据基因注释文件, 利用TBtools[21]提取了烟草B类和基因上游2 kb序列, 并利用PlantCARE (http://bioinformatics.psb.ugent.be/webtools/ plantcare/html/)[22]分析了相应基因启动子上游顺式作用元件。
1.5 细胞质雄性不育系K326及保持系不同花蕾期B类及SUPERMAN基因表达的qPCR检测
细胞质雄性不育雄蕊异常与B类及基因表达有关[2,13], 因此以细胞质雄性不育系K326及其保持系不同发育时期花蕾为材料, 利用qPCR技术检测了相应基因的表达。RNA提取试剂盒TaKaRa MiniBEST Plant RNA Extraction Kit (No. 9769)、反转录试剂盒PrimeScriptRT Master Mix (Perfect Real Time) (No. RR036A)、qPCR试剂盒TaKaRa TB Green Premix Ex(Tli RNaseH Plus) (No.RR420A)、均购自TAKARA公司。RNA提取、反转录参照试剂盒说明进行。反转录得到的cDNA产物稀释5倍后作为qPCR模板, 用Oligo 7.0设计qPCR引物(表1), qPCR参照试剂盒说明进行, 3次重复。以作为内参, 根据Ct值采用2–DDCt法进行基因相对定量结果计算, 按照扩增效率为100%计算表达量差异。

表1 qPCR所用引物
2 结果与分析
2.1 不同时期细胞质雄性不育系K326及其保持系花雄蕊形态差异
为了便于烟草细胞质雄性不育系K326和保持系进行比较, 将它们不同发育时期花蕾形态差异进行了初步归纳(图1)。小蕾期, 雌雄蕊发育仍在进行之中(图1-A, D), 不育系雄蕊小蕾期就呈现异常, 许多雄蕊与雌蕊基部融合为一体, 顶端分化不明显, 也有少数雄蕊离生(图1-D)。此期保持系K326雄蕊完全离生, 雄蕊顶端也在分化之中(图1-A)。在中蕾期, 雄蕊明显分化。许多不育系雄蕊顶端柱头化, 呈心皮化; 也有雄蕊变为叶片状, 呈花瓣化(图1-E)。与此同时, 保持系雄蕊顶端花药形态形成(图1-B)。大蕾期雄蕊分化已经完成, 体积更大(图1-C, F)。最终, 不育系不能形成正常的雄蕊, 无法产生有功能花粉。形态观察表明, 不育系雄蕊异常在花蕾发育早期就已出现。
2.2 普通烟草B类和SUPERMAN基因家族鉴定
基因中B类基因参与决定花瓣和雄蕊形成,基因是花第3轮和第4轮边界基因, 花瓣化或雌蕊化细胞质雄性不育中发现这些基因表达异常[2,13]。烟草中共鉴定出160个基因(附表1), 这些基因中有4个基因(、、、), 3个基因(、、), 共7个B类基因。烟草中共鉴定出5个基因、、、、(表2)。
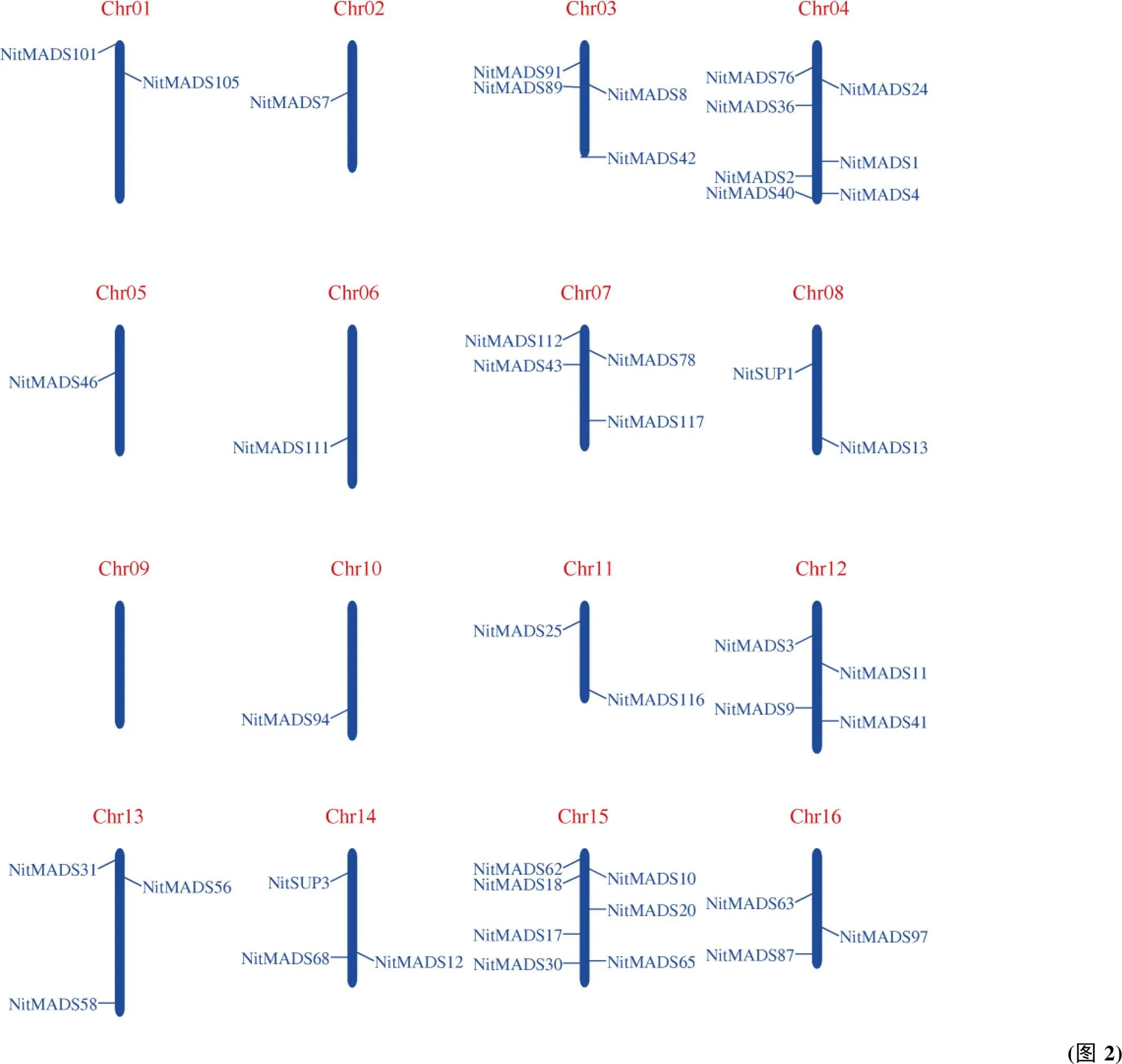
2.3 烟草MADS-box基因和SUPERMAN基因染色体定位
根据烟草染色体定位信息, 烟草160个基因中79个在染色体上具有明确的定位(图2)。这些基因分布于22条染色体上, 但不均匀, 在4号、15号、17号、19号染色体上分布较多, 在9号、18号染色体上无分布, 在2号、5号、6号、8号、10号染色体上仅有1个。此外, 19号染色体上存在基因簇。7个B类基因中4个定位在染色体上, 其中基因定位在1号染色体上,定位在22号染色体上,定位在23号染色体上,基因定位在17号染色体上。5个基因中只有3个定位在染色体上, 其中定位在8号染色体上,定位在19号染色体上,定位在14号染色体上。基因簇分布说明该区段基因发生了串联重复。

图1 细胞质雄性不育系K326及保持系不同花蕾期雄蕊形态
A: 保持系小蕾期; B: 保持系中蕾期; C: 保持系大蕾期; D: 不育系小蕾期; E: 不育系中蕾期; F: 不育系大蕾期。
A: maintainer line buds at small bud stage; B: maintainer line buds at mid-size bud stage; C: maintainer line buds at big bud stage; D: CMS linebuds at small bud stage; E:CMS line budsat mid-size bud stage; F: CMS line budsat big bud stage.
2.4 共线性分析
在进化过程中, 串联和片段DNA重复驱动基因家族扩张, 进而推动基因组进化。共线性分析表明, 所有烟草基因之间具有较高的共线性, 表明基因所在片段在进化过程中发生了较多的重复(图3), 说明片段重复可能是烟草基因家族扩张的驱动力。
烟草属中只有普通烟草()、渐狭叶烟草()进行了基因组测序。普通烟草是四倍体, 渐狭叶烟草是二倍体, 为了深入认识基因的进化关系, 以茄科研究得较为深入的番茄()作为外类群, 进行了比较分析了它们基因间的共线性关系(图4)。它们的物种间共线分析表明, 普通烟草与渐狭叶烟草间有8个基因存在共线。渐狭叶烟草3号染色体上的1个基因, 在普通烟草染色体上有2个共线基因。普通烟草和番茄间有45个基因存在共线。烟草4号、13号、15号、23号染色体有5个基因分别在番茄上有3个共线基因, 12号、17号、19号、22号染色体上有6个基因在番茄上分别有2个共线基因。番茄1号、2号、4号、6号、11号的7个基因分别在普通烟草染色体上有3个共线基因, 此外, 番茄3号、5号、12号染色体上还有3个基因分别在普通烟草染色体上有2个共线基因, 这说明烟草基因组在进化过程中发生了大量易位、重复。大多数番茄基因在烟草上有2个以上共线基因, 反映了烟草基因组在进化过程中也发生了倍加作用。共线分析表明, 烟草3个基因和渐狭叶烟草间只有1个共线基因, 与番茄有8个基因共线(图5)。烟草上1个基因与番茄有2个共线基因, 2个基因在番茄上有3条共线基因, 番茄上的只有7个基因与烟草中有2个以上共线, 这进一步说明烟草基因组在进化过程中发生过易位、重复和倍加。
2.5 烟草B类基因和SUPERMAN基因顺式作用元件
为了解烟草B类基因和基因不同成员在细胞质雄性系K326和保持系中的差异表达调控,分析了它们的顺式作用元件。顺式作用元件一般分光响应、胁迫响应、激素响应元件, 在花发育过程中, 激素起着重要作用, 因此在分析上述基因顺式作用元件时, 重点分析了激素响应元件。基因顺式作用元件22个, 激素响应元件有5个: AuxRE、CGTCA-motif、ERE、TGA-element、TGACG-motif;基因、、共同顺式作用元件13个, 激素响应元件有3个: ABRE、ERE、TGACG-motif。基因、共同顺式作用元件16个, 与激素响应元件有4个: ABRE、CGTCA-motif、TGACG-motif、TCA (表3);基因与其他3个基因不同的是有生长素响应元件AuxRR, 缺少脱落酸响应元件ABRE; 与2个基因相比, 有生长素响应元件AuxRR和乙烯响应元件ERE, 缺少脱落酸响应元件ABRE。、与其他B类基因相比, 缺少乙烯响应元件ERE。B类基因中只有表具有生长素响应元件AuxRR, 说明它可能受生长素调控。
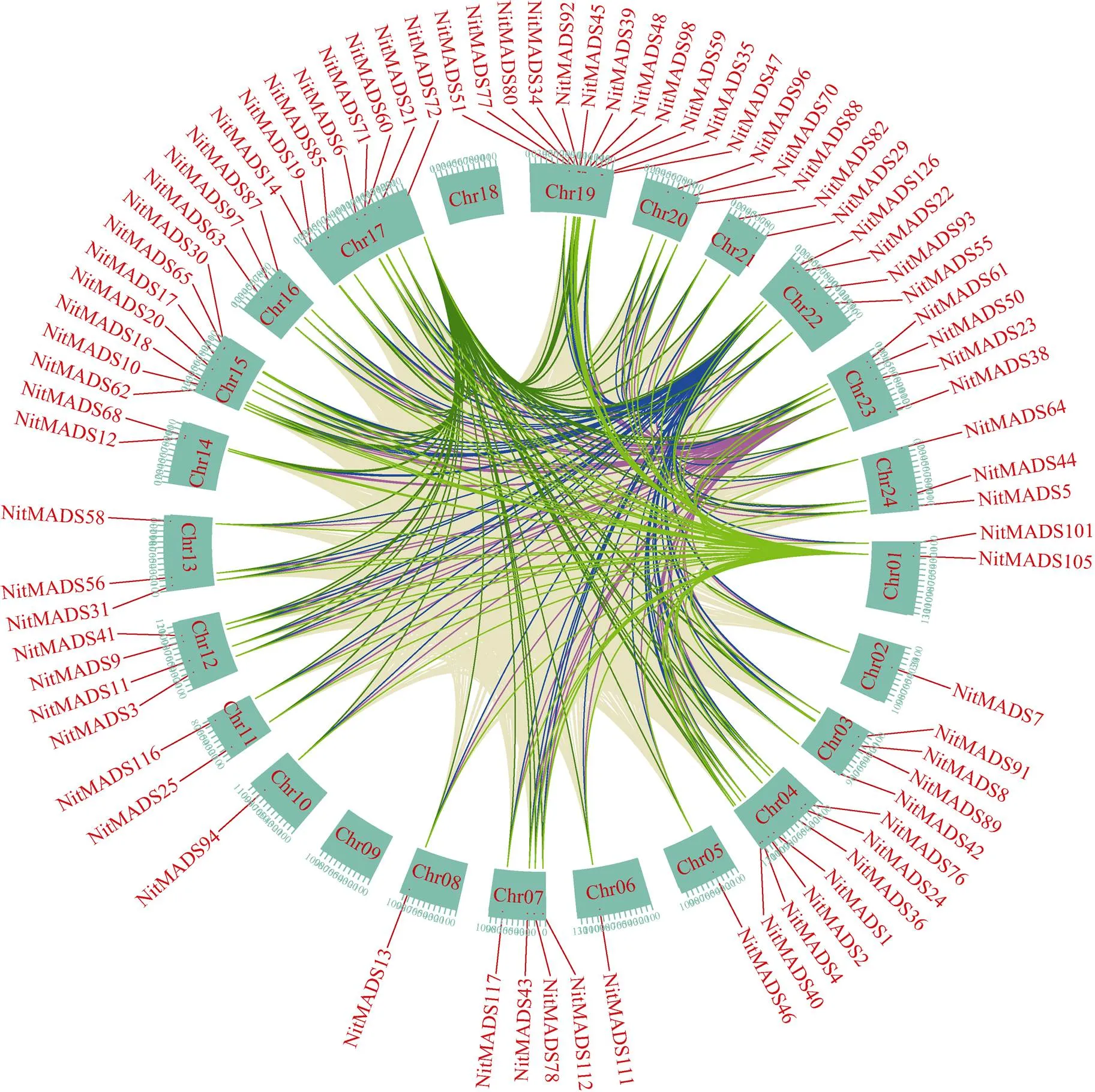
图3 烟草MADS-box基因共线性分析
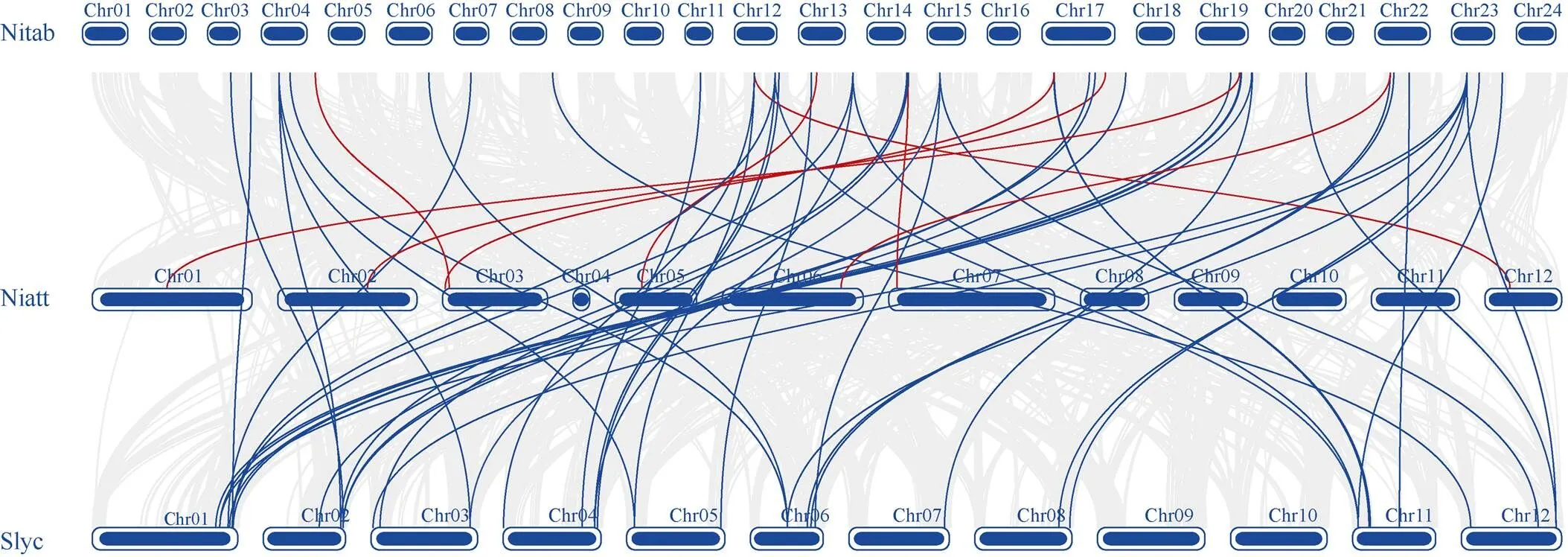
图4 普通烟草、渐狭叶烟草和番茄物种间MADS-box共线性分析
Nitab: 普通烟草; Niatt: 渐狭叶烟草; Slyc: 番茄。红色连线表示普通烟草和渐狭叶烟草基因间的共线性; 蓝色连线表示普通烟草和番茄基因间的共线性。
Nitab:; Niatt:; Nsly:. The red line indicates collinearity betweengenes ofand. The blue line indicates collinearity betweengenes ofand.
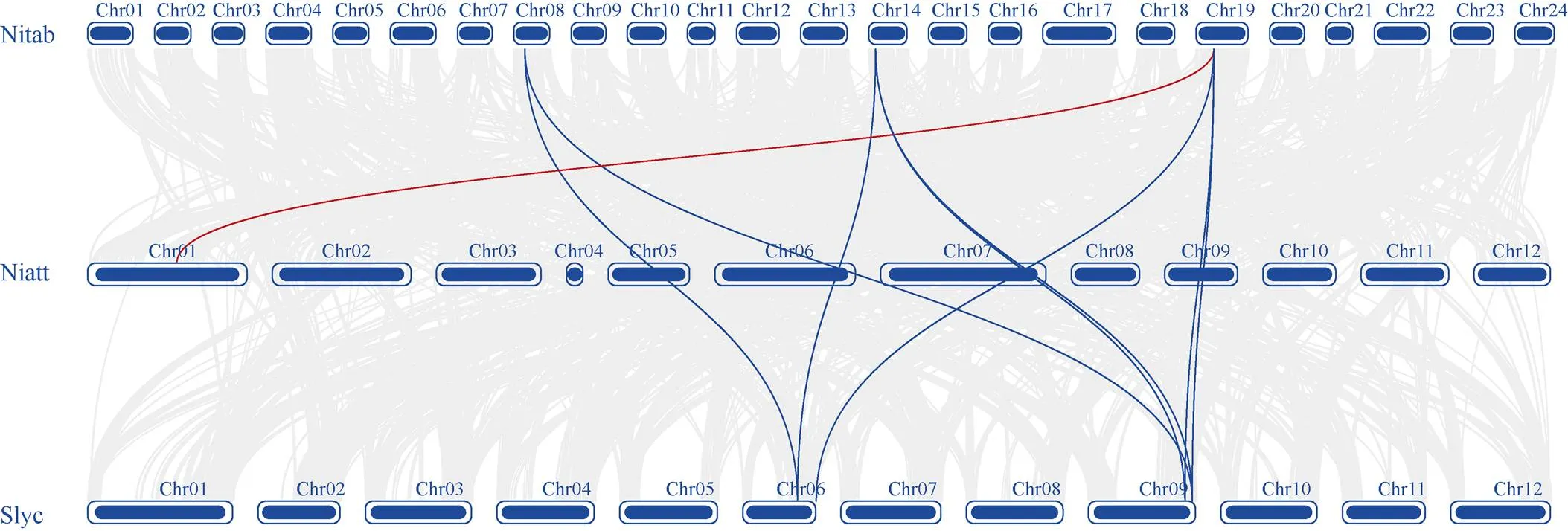
图5 普通烟草、渐狭叶烟草和番茄物种间SUPERMAN基因共线
Nitab: 普通烟草; Niatt: 渐狭叶烟草; Slyc: 番茄。红色连线表示普通烟草和渐狭叶烟草基因间的共线性; 蓝色连线表示普通烟草和番茄基因间的共线性。
Nitab:; Niatt:; Nsly:.The red line indicates collinearity betweengenes ofand. The blue line indicates collinearity betweengenes ofand.

表3 烟草MADS-box基因的顺式作用元件
ABRE: abscisic acid response element; AuxRR-core: auxin response element; CGTCA-motif: methyl jasmonate response element; ERE: ethylene response element; TCA-element: salicylic acid response element; TGACG-motif: methyl jasmonate response element.
基因与激素相关顺式作用元件共有7个(表4), 但共同的作用元件只有1个, 为脱落酸响应元件ABRE, 这说明基因可能受脱落酸调控。
2.6 烟草B类基因和SUPERMAN基因表达分析
为了解细胞质同源异型雄性不育中B类基因表达, 在小蕾、中蕾、大蕾期通过qPCR技术对细胞质雄性不育系K326及其保持系花蕾检测了全基因组扫描到的7个B类基因表达(图6)。这表明, 在花器官发生后, 花器官分化过程中仍需要B类基因表达。B类基因成员表达在不育系和保持系花蕾不同发育时期表达存在不同, 这可能与它们在花发育过程中有不同功能有关。从小蕾、中蕾、大蕾期3个时期来看, 7个B类基因表达趋势分为3类: 小蕾、中蕾、大蕾期保持系中表达高于不育系(); 小蕾、大蕾期保持系中表达高于不育系, 中蕾期则相反(、、、); 小蕾、中蕾、大蕾期保持系中表达低于不育系(、)。虽然B类基因成员在不育系和保持系中检测到表达有差异, 但只有AP3基因,基因在不育系和保持系中表达差异达到显著水平, 暗示这2个基因在花器官发生后分化过程中重要作用相对比较重要。
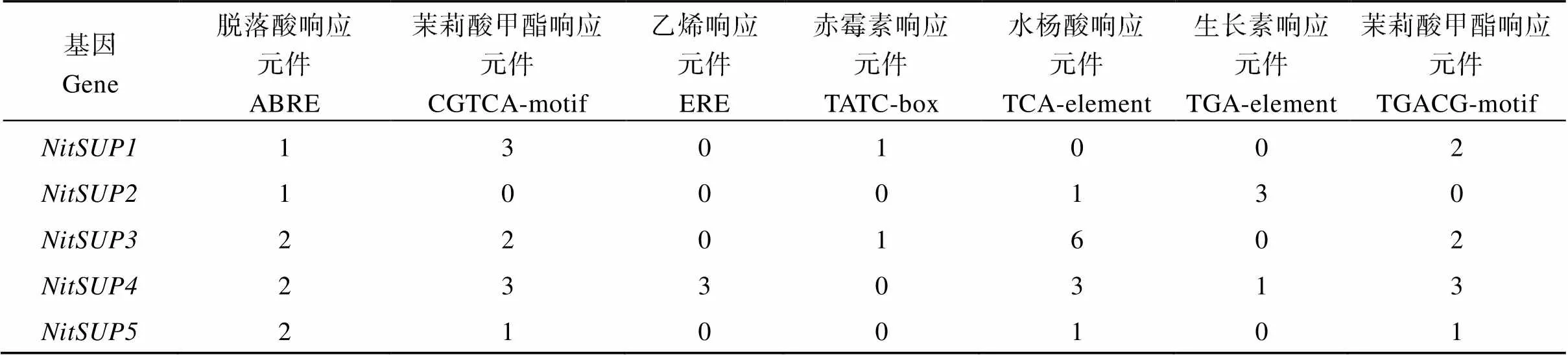
表4 烟草SUPERMAN基因的顺式作用元件
ABRE: abscisic acid response element; CGTCA-motif: methyl jasmonate response element; ERE: ethylene response element; TATC-box: gibberellin response element; TCA-element: salicylic acid response element; TGA-element: auxin response element; TGACG-motif: methyl jasmonate response element.

图6 烟草不同花发育时期B类基因和SUPERMAN表达
K326: 保持系K326; msK326: 不育系K326。误差线表示= 3的标准误。所有数据均为平均值±SD (= 3)。**在= 0.01水平差异显著, *在= 0.05水平差异显著。
K326: maintainer K326; msK326: CMS K326. Error bar represents the SD (= 3). All data are means ± SDs (= 3). **:< 0.01; *:< 0.05.
对全基因组扫描到的6个基因进行了qPCR检测, 只检测到一个基因表达(), 小蕾、中蕾期在保持系K326中可以检测到, 而所有时期中不育系中无表达。这可能是在花分化早期基因有着比较重要的作用, 不育系雄蕊异常与花发育早期基因表达异常有关。大蕾期花分化已完成, 就不再需要。细胞质雄性不育系花器官第3轮雄蕊和第4轮雌蕊之间边界消失与基因花分化期异常表达有关。
3 讨论
在植物发育过程中, 细胞活动的精确调控对于正常器官形成至关重要, 植物器官畸形与其细胞活动失调有关[23]。在细胞质雄性不育中, 无论雄蕊退化、雄蕊心皮化还是雄蕊花瓣化等雄蕊异常, 其在花器官中的轮次位置并未改变。雄蕊异常与花器官决定基因有关, 上述情况表明, 花器官决定基因可以改变花器官特性, 但对花器官发生并不能产生影响。细胞质雄性不育中雄蕊异常是分化过程中相应花器官决定基因表达受到了干扰的结果[14]。
细胞质雄性不育中雄蕊异常发生在花蕾形成早期, 表明其花器官发生受到了扰动。突变体研究表明, 雄蕊异常并非是雌雄蕊相互转化, 而是第4轮干细胞的过度增殖[16]。这表明在细胞质雄性不育花器官发生过程中雄蕊原基干细胞活动没有正确启始, 花器官分化过程中雌蕊原基干细胞活动没有正确结束。
鉴于生长素在花分生组织形成中起着中心作用[24],基因也是通过调控生长素的合成来控制第3轮和第4轮边界[17], 因此, 生长素可能在雄蕊异常细胞质雄性不育中扮演重要作用。至于生长素如何受细胞质调控仍需进一步研究。
我们的研究表明, 烟草细胞质雄性不育系K326,雄蕊不仅有心皮化现象, 而且同时有雄蕊花瓣化现象, 雄蕊基部也融合成了一体, qPCR检测表明, B类基因在保持系和不育系表现出差异表达, 研究结果与前人一致。
基因只在保持系K326小蕾期和中蕾期能检测到, 而在不育系K326所有时期都无法检测到, 可能该基因在雄蕊原基发生及雄蕊分化中起重要作用, 而不单单是个边界基因。鉴于该基因是通过调控生长素的合成来发挥作用, 支持生长素在细胞质逆行调控细胞核中起作用的猜测。基因, 其启动子上游顺式作用元件中, 含有生长素响应元件AuxRR, 在不育系各个发育时期表达下调也与不育系早期花分生组织中可能出现了生长素异常一致。不育系K326不仅有雄蕊心皮化现象而且同时有雄蕊花瓣化现象, 这与参与花第1轮和第2轮决定基因是基因的正调控因子研究是相符的[25]。此外, AG不仅是是花器官决定基因, 同时也是花干细胞终止的重要基因[25]。这从另一方面也说明了细胞质雄性不育中生长素可能的作用。大蕾期基因在保持系花蕾中检测不到, 可能与雄蕊分化结束, 其作用已经完成有关。
基因、在不育系中表达上调, 达到显著水平, 可能与它们在雄蕊分化中的作用有关, 也说明它们受核质互作影响较大。
4 结论
细胞质雄性不育中雄蕊异常发生在花器官发育早期, B类基因和基因表达也出现异常, 表明核质互作不仅影响到了花器官发生, 而且也影响到了花第2轮和第3轮器官决定基因表达调控。鉴于生长素在花发育中的作用, 它可能在细胞质逆行调控细胞核中起重要作用。
附表 请见网络版: 1) 本刊网站http://zwxb. chinacrops.org/; 2) 中国知网http://www.cnki.net/; 3) 万方数据http://c.wanfangdata.com.cn/Periodical- zuowxb.aspx。
[1] Crosatti C, Quansah L, Maré C, Giusti L, Roncaglia E, Atienza S G, Cattivelli L, Fait A. Cytoplasmic genome substitution in wheat affects the nuclear-cytoplasmic cross-talk leading to transcript and metabolite alterations., 2013, 10: 868.
[2] Kang L, Li P, Wang A, Ge X, Li Z. A novel cytoplasmic male sterility in(inap CMS) with carpelloid stamens via protoplast fusion with Chinese Woad., 2017, 8: 529.
[3] Yang H, Xue Y, Li B, Lin Y, Li H, Guo Z, Li W, Fu Z, Ding D, Tang J. The chimeric geneconfers cytoplasmic male sterility in maize by impairing the assembly of the mitochondrial ATP synthase complex., 2022, 15: 872–886.
[4] Xiao S, Zang J, Pei Y, Liu J, Liu J, Song W, Shi Z, Su A, Zhao J, Chen H. Activation of mitochondrialgene expression by a nuclear-encoded DREB transcription factor causes cytoplasmic male sterility in maize., 2020, 13: 1270–1283.
[5] Takatsuka A, Kazama T, Arimura S I, Toriyama K. TALEN- mediated depletion of the mitochondrial geneproves that it is a Tadukan-type cytoplasmic male sterility-causative gene in rice., 2022, 110: 994–1004.
[6] Kuwabara K, Arimura S I, Shirasawa K, Ariizumi T.triggers cytoplasmic male sterility in tomato., 2022, 189: 465–468.
[7] Yamagishi H, Jikuya M, Okushiro K, Hashimoto A, Fukunaga A, Takenaka M, Terachi T. A single nucleotide substitution in the coding region of Ogura male sterile gene,, determines effectives of a fertility restorer gene,, in radish., 2021, 296: 705–717.
[8] Wen J F, Zhao K, Lyu J H, Huo J L, Wang Z R, Wan H J, Zhu H S, Zhang Z Q, Shao G F, Wang J, Zhang S, Yang T Y, Zhang J R, Zou X X, Deng M H.is associated with cytoplasmic male sterility in pepper.,2021, 44: e20210030.
[9] Zhu Y, Saraike T, Yamamoto Y, Hagita H, Takumi S, Murai K., a novel mitochondrial gene, is associated with the homeotic transformation of stamens into pistil-like structures (pistillody) in alloplasmic wheat., 2008, 49: 1723–1733.
[10] Wang R, Cai X, Hu S, Li Y, Fan Y, Tan S, Liu Q, Zhou W. Comparative analysis of the mitochondrial genomes of: hints toward the key factors closely related to the cytoplasmic male sterility mechanism., 2020, 11: 257.
[11] Chase C D. Cytoplasmic male sterility: a window to the world of plant mitochondrial-nuclear interactions., 2007, 23: 81–90.
[12] Chen L, Liu Y G. Male sterility and fertility restoration in crops., 2014, 65: 579–606.
[13] Zubko M K. Mitochondrial tuning fork in nuclear homeotic functions., 2004, 9: 61–64.
[14] Teixeira R T, Farbos I, Glimelius K. Expression levels of meristem identity and homeotic genes are modified by nuclear- mitochondrial interactions in alloplasmic male-sterile lines of., 2005, 42: 731–742.
[15] Bereterbide A, Hernould M, Farbos I, Glimelius K, Mouras A. Restoration of stamen development and production of functional pollen in an alloplasmic CMS tobacco line by ectopic expression of thegene., 2002, 29: 607–615.
[16] Prunet N, Yang W, Das P, Meyerowitz E M, Jack T P.prevents class B gene expression and promotes stem cell termination in the fourth whorl offlowers., 2017, 114: 7166–7171.
[17] Xu Y, Prunet N, Gan E S, Wang Y, Stewart D, Wellmer F, Huang J, Yamaguchi N, Tatsumi Y, Kojima M, Kiba T, Sakakibara H, Jack T P, Meyerowitz E M.regulates floral whorl boundaries through control of auxin biosynthesis., 2018, 37: e97499.
[18] Nandi A K, Kushalappa K, Prasad K, Vijayraghavan U. A conserved function for Arabidopsis SUPERMAN in regulating floral-whorl cell proliferation in rice, a monocotyledonous plant., 2000, 10: 215–218.
[19] Lu S, Wang J, Chitsaz F, Derbyshire M K, Geer R C, Gonzales N R, Gwadz M, Hurwitz D I, Marchler G H, Song J S, Thanki N, Yamashita R A, Yang M, Zhang D, Zheng C, Lanczycki C J, Marchler-Bauer A. CDD/SPARCLE: the conserved domain database in 2020., 2020, 48: D265–D268.
[20] Chao J T, Li Z Y, Sun Y H, Aluko O O, Wu X R, Wang Q, Liu G S. MG2C: a user-friendly online tool for drawing genetic maps., 2021, 1: 16.
[21] Chen C, Chen H, Zhang Y, Thomas H R, Frank M H, He Y, Xia R. TBtools: an integrative toolkit developed for interactive analyses of big biological data., 2020, 13: 1194–1202.
[22] Lescot M, Dehais P, Thijs G, Marchal K, Moreau Y, Van de Peer Y, Rouze P, Rombauts S. PlantCARE, a database of plant- acting regulatory elements and a portal to tools for in silico analysis of promoter sequences., 2002, 30: 325–327.
[23] Meyerowitz E M. Genetic control of cell division patterns in developing plants., 1997, 88: 299–308.
[24] Zhang K, Zhang H, Pan Y, Niu Y, Guo L, Ma Y, Tian S, Wei J, Wang C, Yang X, Fu Y, Qu P, Liu L, Zhang Y, Sun H, Bai Z, Dong J, Li C, Liu X. Cell- and noncell-autonomouscontrols meristem proliferation and phyllotactic patterns., 2022, 190: 2335–2349.
[25] Uemura A, Yamaguchi N, Xu Y, Wee W, Ichihashi Y, Suzuki T, Shibata A, Shirasu K. Regulation of floral meristem activity through the interaction of,, andin., 2018, 31: 89–105.
Characteristics ofandgenes in tobacco cytoplasmic male sterile line K326
CUI Fang-Fang1, MENG Lin-Feng1, LIU Miao-Miao2, ZHANG Jian-Qiang2, WANG Jian-Ge2,*, and LIU Qi-Yuan1,*
1Key Laboratory of Crop Physiology, Ecology and Genetic Breeding, Ministry of Education / College of Agronomy, Jiangxi Agricultural University, Nanchang 330045, Jiangxi, China;2College of Forestry, Jiangxi Agricultural University, Nanchang 330045, Jiangxi, China
Cytoplasmic male sterility (CMS) is an important tool for hybrid production and a good system for studying the interaction between nucleus and cytoplasm, but its mechanism is still unclear. The relationship between stamen abnormality and the relative expression levels of flower development genes in tobacco CMS line K326 was studied. The CMS line K326 was derived from a natural variation inand was bred by continuous backcross of flue-cured tobacco variety K326. It has not only stamens with carpelloid, but also stamens with petaloid, and the base of abnormal stamens is fused into a whole. In this study, we identifiedgenes andgenes of whole genome, which controlled the flower development inand analyzed their chromosomal localization and collinearity. The-acting elements ofgenes andgenes were predicted, and their expression characteristics in flower buds at different stages in both CMS line and its maintainer line were studied. The results showed that 160genes and 5genes were identified in the genome of tobacco, including 4genes, 33 genes, and 7genes. There were 79genes scattered on 22 chromosomes, and 3genes distributed on 3 chromosomes. Collinearity analysis showed that tandem and fragment DNA duplication and multiplication were the driving forces of the expansion ofgene family in tobacco. The abnormal stamens of CMS line K326 appeared at small bud stage, suggesting that the abnormal stamens in CMS line K326 were the result of early meristem development defects. The qRT-PCR showed that 7genes and 1gene were expressed both in CMS line K326 and its maintainers. The relative expression level ofgenein the maintainer line was higher than that in CMS line at all stages. The relative expression levels of3 genesandin maintainer lines were lower than those in CMS lines. Other genes were down-regulated at small bud stage and large bud stage, and up-regulated at middle bud stage. Thegene could only be detected at small bud and middle bud stage of the maintainer line, but not at bud stages of CMS line. Analysis of cis-acting elements showed thathad an auxin response element AuxRR. The study indicates that auxin might play an important role in cytoplasmic retrograde regulation of nucleus in tobacco.
tobacco; cytoplasmic male sterility;;; auxin
2023-05-24;
2023-05-31.
10.3724/SP.J.1006.2023.24268
通信作者(Corresponding author): 王建革, E-mail: wjgsd@126.com; 刘齐元, E-mail: qiyuanl@126.com
E-mail: 804994421@qq.com
2022-12-03;
本研究由国家自然科学基金项目(3196150292)资助。
This study was supported by the National Natural Science Foundation of China (3196150292).
URL: https://kns.cnki.net/kcms2/detail/11.1809.S.20230530.1545.006.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

