低温机械灌注对大鼠肾脏炎症因子表达水平的影响
罗德 刘江 周鹏程 王飘 李栩嘉 林号民 苏松
肾移植被视为终末期肾病的最佳治疗选择。然而,器官保存过程中的缺血-再灌注损伤(ischemiareperfusion injury,IRI)严重影响移植物功能,是移植成功的主要障碍[1]。因此,减轻器官保存中的IRI 并改善器官功能成为当前移植领域亟须解决的问题。静态冷保存(static cold storage,SCS)是一种通过降低保存温度和减缓细胞代谢来实现器官保存的技术[2-3]。然而,大量研究证实,在SCS 过程中,能量耗竭、氧化应激和免疫炎症激活等因素可能导致细胞结构和功能的受损,从而引发冷缺血损伤[4-6]。这种损伤在边缘供者中尤为显著,并且随着保存时间的延长,损伤程度会进一步加重。低温机械灌注(hypothermic machine perfusion,HMP)通过持续供应氧气和能量物质,并及时清除代谢废物,能够减轻IRI 并改善器官保存质量和效果,提高移植成功率并降低移植后并发症的风险[7-8]。在IRI 中,炎症反应激活起着关键的作用,适度的炎症反应有助于组织修复和再生,但过度激活则会加剧组织损伤[9-10]。因此,控制炎症反应激活对于减轻IRI 和保护器官功能至关重要。然而,目前关于肾脏HMP 过程中炎症反应激活的研究报道非常有限。因此,本研究通过构建大鼠肾脏离体SCS 和HMP 模型,比较这两种器官保存方式对肾脏炎症因子水平的影响,为进一步研究器官保存提供参考。
1 材料与方法
1.1 实验动物及主要试剂和仪器
雄性Fisher 大鼠30 只,体质量260~300 g,饲养于西南医科大学动物实验中心。组氨酸-色氨酸-酮戊二酸盐液(histidine-tryptophan-ketoglutarate solution,HTK 液)购于德国Custodiol 公司,威斯康星大学保存液(University of Wisconsin solution,UW 液)购于美国Bridge to Life 公司,QuantiTect 逆转录试剂盒购于德国Qiagen 公司,TaqMan fast universal PCR master mix 购于美国赛默飞公司,CXC 趋化因子配体(CXC chemokine ligand,CXCL)1、CXCL2、干扰素(interferon,IFN)-β1、IFN-α4、CC 趋化因子配体(CC chemokine ligand,CCL)2、CCL20、白细胞介素(interleukin,IL)-17α、IL-17C、肿瘤坏死因子(tumor necrosis factor,TNF)-α、β-actin 引物购于美国赛默飞公司,StepOne 逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)系统购于美国赛默飞公司,机械灌注系统购于德国Hugo Sachs Elektronik 公司。本实验通过西南医科大学附属医院伦理委员会审批(批号:20211119-067)。
1.2 实验分组及处理方式
将30 只大鼠随机分为对照组(Control 组)、SCS 组和HMP 组,每组10 只,术前自由饮水。4.5% 异氟醚深度麻醉后,打开胸腹腔并剪破心脏,经腹主动脉使用4 ℃ HTK 液冲洗肾脏,直至肾脏颜色变为均匀黄白色,剪破心脏到开始冲洗肾脏的时间大约为5 min。Control 组冲洗结束后获取肾脏置于10%多聚甲醛中固定,用于后续的病理组织学检查;SCS 组冲洗结束后获取肾脏置于4 ℃ HTK 液中保存12 h;HMP 组冲洗结束后获取肾脏置于4 ℃ HTK 液中保存12 h,再使用4 ℃ UW 液以80 mmHg(1 mmHg=0.133 kPa)的恒定压力进行2 h 低温机械灌注,采用95% O2、5% CO2通过纤维膜氧合器对灌注液进行氧合。
1.3 研究内容及方法
1.3.1 灌注参数 机械灌注系统能实时记录流速及肾内阻力,灌注结束后收集灌注过程中的流速和阻力数据,并用大鼠肾脏质量进行标准化后进行后续分析。灌注过程中每15 min 收集静脉流出液,并使用酸碱度测定计测量其pH 值。
1.3.2 逆转录聚合酶链反应实验 取20 mg 肾脏组织于组织裂解器中使其变成组织匀浆,使用RNAeasy Mini 试剂盒提取总RNA,分光光度计测定浓度,使用QuantiTect 逆转录试剂盒进行逆转录获得cDNA。随后使用RT-PCR 系统检测CXCL1、CXCL2、IFNβ1、IFN-α4、CCL2、CCL20、IL-17α、IL-17C、TNF-α 的CT 值。每个标本设3 个复孔,用β-actin 将每个基因平均CT 值进行标化,并使用相对定量方法计算信使RNA(messenger RNA,mRNA)的相对表达水平。
1.3.3 肾脏组织病理学检查 多聚甲醛固定肾脏,经过不同浓度的乙醇脱水、透明、浸蜡、包埋、切片、脱蜡、水化、苏木素-伊红(hematoxylin-eosin,HE)染色后封片制成病理切片,进行病理组织学观察并对肾小管损伤进行评分。肾小管损伤采用改良的评分方法:在每张病理切片中,高倍镜下随机选取10 个非重叠区域分别对肾小管扩张、空泡形成、刷状缘缺失、上皮坏死和上皮脱落五种组织形态学变化进行半定量评估。评分标准:结构正常0 分;轻度改变为1 分(< 25%);中度改变为2 分(25%~50%);严重改变为3 分(> 50%)。计算10 个区域的平均分作为每张病理切片的肾小管损伤评分。
1.4 统计学方法
采用SPSS 26.0 软件进行统计学分析。对于符合正态分布的计量资料以均数±标准差表示,两组独立样本间比较采用非配对t检验,同一组样本灌注前后比较采用配对t检验,P< 0.05 为差异有统计学意义。
2 结 果
2.1 机械灌注过程中各参数变化
流速在HMP 过程中相对稳定,灌注结束时流速并未降低[(2.7±0.4) mL/(min·g)比(2.9±0.4) mL/(min·g),P=0.5,图1A]。肾内阻力在HMP 过程中均相对稳定,灌注结束时与灌注开始时比肾内阻力没有明显变化[(2 2.2±1.6)mmHg/(min·g)比(20.1±2.1) mmHg/(min·g),P=0.3,图1B]。肾静脉灌注流出液pH 值在HMP 最初阶段下降,随后保持相对稳定,灌注结束时的pH 值低于灌注开始时(7.28±0.01 比7.35±0.01,P=0.002,图1C)。
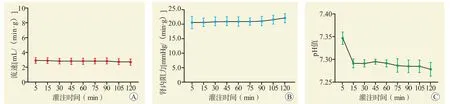
图1 HMP 过程中各参数变化Figure 1 Changes of parameters during HMP
2.2 各组肾脏炎症因子mRNA 表达水平比较
与Control 组比较,SCS 组和HMP 组CXCL1、CXCL2、CCL2、CCL20、IL-17α、IL-17C、TNFα 的mRNA 相对表达量升高;与SCS 组比较,HMP 组CXCL1、CXCL2、CCL2、CCL20、IL-17α和 TNF-α 的mRNA 相对表达量升高(均为P< 0.05,图2)。
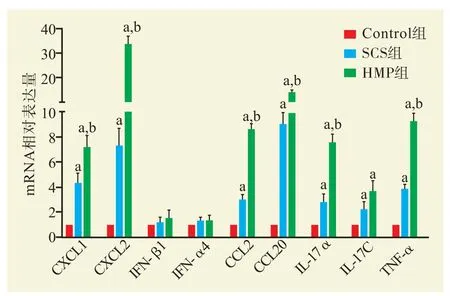
图2 各组肾脏炎症因子mRNA 表达水平Figure 2 mRNA expression levels of inflammatory factors of kidneys in each group
2.3 各组肾脏组织病理学结果的比较
肾脏组织切片HE 染色结果显示,Control 组肾小管刷状缘完整,管腔无细胞碎片,细胞形态正常;SCS 组存在大量的细胞质广泛空泡化、刷状缘缺失、上皮坏死、上皮脱落、管腔阻塞,肾小管损伤严重;HMP 组仅有少量刷状缘丢失和上皮脱落,肾小管损伤轻微(图3)。
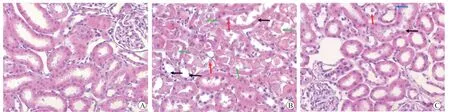
图3 各组肾脏组织病理学改变(HE,×400)Figure 3 Histopathological changes of the kidney tissues in each group
Control 组肾小管损伤评分为(0.34±0.11)分,低于SCS 组的(6.20±0.59)分和HMP 组的(4.10±0.76)分,而HMP 组肾小管损伤评分低于SCS 组(均为P< 0.05)。
3 讨 论
肾移植仍然是终末期肾病的最佳治疗选择,能够改善患者生活质量和延长寿命[11-12]。供者短缺是目前器官移植面临的巨大挑战[13-15]。边缘供者被迫用以补充供者池以改善供者短缺的窘境,这类供者对保存过程中的IRI 更加敏感,术后移植物无功能发生率更高[16-17]。随着Collins 液、UW 液、HTK 液等器官保存液相继开发和改进,SCS 成为了目前常用的器官保存方式,被多数器官移植中心广泛使用[18-19]。SCS 主要通过降低温度来抑制细胞代谢,然而长时间SCS 可能会导致细胞活力丧失甚至坏死[20-21]。冷保存时间越长,器官遭受的损伤越严重,特别是对于边缘供器官,这大大降低了SCS 的效果[22-24]。近年来,研究人员开始更加关注HMP,它不仅可以保存器官,改善器官功能,还可用于评估器官功能[25-28]。本研究结果表明,HMP 虽然激活了肾脏的炎症反应,但减轻了肾脏冷保存损伤。靶向调控HMP 过程中的炎症反应为进一步改善器官功能提供了新的思路。
肾脏机械灌注过程中的血流动力学变化是一个重要的功能参数,可用于评估灌注效果和肾脏损伤程度[6]。由于体外灌注过程中灌注压力恒定,因此流速与肾内阻力成反比。本研究发现,灌注过程中肾内阻力相对稳定,无明显变化。Blum 等[29]对猪肾脏进行8 h 的HMP,也发现灌注过程中肾内阻力保持基本稳定。IRI 过程中存在多种炎症因子的释放和激活,如细胞因子TNF-α、IFN-β1、IFN-α4、IL-17α、IL-17C,趋化因子CXCL1、CXCL2、CCL2、CCL20[30]。这些炎症因子在IRI 中发挥着重要的作用,调控这些炎症因子有助于减轻IRI,改善器官保存和移植效果。对机械灌注过程中炎症因子的研究,有助于深入理解机械灌注对器官的影响,并为开发相关的治疗策略提供基础。目前,对于机械灌注过程中移植物炎症细胞因子的变化,大部分研究集中在常温机械灌注(normothermic machine perfusion,NMP)[31],对于HMP 过程中炎症因子的变化研究非常有限。一项包括293 例肝移植受者的随机临床多中心试验数据显示,相比于SCS,NMP 能显著减轻肝小叶炎症,减轻IRI[32]。Beetz 等[33]研究发现,相比于SCS,6 h的NMP 明显提高了猪肝IL-1α、IL-1β、IL-2、IL-6和IL-18 的表达水平。然而,Fontes 等[34]研究表明,与SCS 相比,机械灌注明显降低猪肝IFN-α、IFN-γ、TNF-α、IL-1β、IL-4 和IL-12 的水平。Jager 等[35]分别对猪和人的肾脏进行4 h 和 6 h 的NMP,每小时采集灌注液样本以评估促炎因子变化水平,发现IL-6、IL-8 和TNF 在NMP 期间显著增加。Yang 等[36]使用夹闭兔子肾脏25 min 模拟热缺血损伤,SCS 组松开夹子再灌注29 h 后在4 ℃高渗柠檬酸腺嘌呤溶液-Ⅱ溶液(hypertonic citrate adenine solution-Ⅱ,HCA-Ⅱ溶液)中进行6 h 的SCS,NMP 组松开夹子恢复血流1 h,然后再进行HMP 保存6 h,结果发现与SCS 组相比,HMP 组核因子(nuclear factor,NF)-κB 和TNF-α 的表达明显降低。然而本研究发现与S C S 组相比,H M P 组肾脏多种促炎因子mRNA 表达水平显著升高,且HMP 能减轻冷保存损伤,研究结果的差异可能与两个实验方案中热缺血时间、保存液种类以及保存时间不同有关。
赵德芳等[37]比较了SCS 和HMP 对犬肝脏炎症因子水平的影响,发现移植后HMP 组肝脏IL-1β、TNF-α、IL-8、巨噬细胞炎症蛋白(macrophage inflammatory protein,MIP)-1α、MIP-1β、CCL20 的mRNA 表达水平明显低于SCS 组,而在移植前的肝脏中只有TNF-α、MIP-1α、MIP-1β、CCL20 的mRNA 表达水平差异有统计学意义。本研究采用大鼠肾脏作为实验对象,实验设计也有所不同,获取的肾脏置于4 ℃的HTK 液中保存12 h,而赵德芳等[37]对移植前的肝脏采用生理盐水保存约3 h。此外,本研究中的HMP 组肾脏在SCS 12 h后,继续进行2 h 的HMP,而SCS 组仅接受了12 h的SCS,因此HMP 组肾脏的冷缺血时间更长。这可能是导致HMP 组肾脏炎症因子表达水平明显升高的原因。相较于SCS,虽然HMP 升高了肾脏炎症因子的mRNA 表达水平,但改善了肾脏病理损伤,这可能与HMP 降低移植物代谢率、提供氧气、清除代谢产物、维护细胞膜稳定性和抗氧化等多种机制有关。
综上所述,肾脏移植物在HMP 期间的炎症反应被激活,在HMP 过程中降低移植肾的免疫炎症活性有望进一步提高机械灌注效果,改善移植物存活率。

