共刺激信号通路在异种移植中的作用研究进展
卫浩 杨树军 王科 孙圣坤
器官移植仍然是大多数晚期器官衰竭患者唯一可靠的治疗方法。等待器官移植的人数不断增加,但同种供者极度缺少,异种移植为解决器官短缺、治疗器官衰竭提供了可能[1]。随着CRISPR/Cas9 等相关技术的发展,经过基因改造的供体猪渐渐成为人类可能的器官来源之一[2]。同时,免疫抑制药的进步也在推动移植领域的发展,但是开发更安全、有效的免疫抑制药仍在进行中[3]。共刺激信号通路在同种异体移植领域的作用越来越受到重视,因此,本文将综述目前异种移植中共刺激信号通路的研究现状及面临的问题,旨在为异种移植中免疫抑制方案的优化提供参考。
1 共刺激信号概述
T 细胞在调控针对异体移植物的免疫反应中起着关键性作用,而T 细胞的活化增殖需要两个信号的协同刺激[4]:第一信号是T 细胞受体(T cell receptor,TCR)和抗原提呈细胞(antigen-presenting cell,APC)上的主要组织相容性复合体(major histocompatibility complex,MHC)——抗原肽复合物,第二信号是共刺激信号,由APC 表面的共刺激分子和T 细胞表面的相应受体相互作用后产生。共刺激分子能根据T细胞的生长、活化、分化过程和功能状态在合适的时间和位置进行表达,对T 细胞的分化和功能进行正向或负向调控。阻断正向共刺激信号,可以终止T 细胞活化,防止发生排斥反应,进而促进移植物长期存活和免疫耐受。此外,共刺激分子也可以提供抑制T 细胞活化、终止免疫应答的“共抑制”信号,促进激活该途径的相关治疗方案也可以促进移植物的存活和免疫耐受[5-6]。研究者们致力于在移植模型中探究T 细胞共刺激信号对器官移植排斥反应和免疫调节的机制,有研究表明共刺激信号可以作为诱导移植免疫耐受的靶点[7-8]。
2 共刺激信号通路与异种移植
CD28/细胞毒性T 淋巴细胞抗原(cytotoxic T lymphocyte-associated antigen,CTLA)-4/B7 和CD40/CD40L 通路被认为是主要的共刺激信号通路,与T 细胞和B 细胞的激活有关。笔者总结的目前异种移植中相关共刺激信号通路见图1。
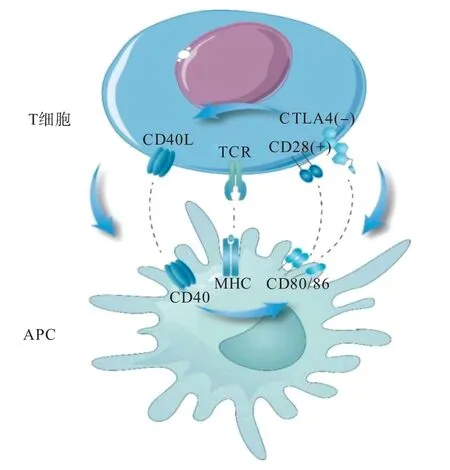
图1 异种移植中的相关共刺激信号通路示意图Figure 1 Schematic diagram of relevant costimulatory signaling pathways in xenotransplantation
2.1 CD28/CTLA-4/B7 通路
CD28 作为最早被发现的共刺激分子之一,它的阻断已经成为促进移植免疫耐受治疗策略发展的主要目标之一[9]。CD28 表达在所有小鼠幼稚T 细胞表面以及人类约80%的CD4+T 细胞和50%的CD8+T 细胞上[10]。CD28 必须结合其配体CD80(B7-1)和CD86(B7-2)才能诱导T 细胞活化、增殖和存活,多种抗CD28 抗体已被研发。一些传统的抗CD28 抗体已被证明可以有效地延长动物移植模型中的移植物存活时间,但仍残留一些激动剂的特性。抗CD28 抗体在小鼠中可抑制皮肤移植排斥反应[11],抗CD28 抗体FR104 与他克莫司、吗替麦考酚酯或西罗莫司(雷帕霉素)联用,可以防止非人灵长类动物同种肾移植中的排斥反应[12]。选择性CD28 阻断剂是一种很有潜力的替代药物,可直接与CD28 结合而不阻碍CTLA-4介导的正常免疫抑制信号。如抗CD28 单克隆抗体不仅保留了CTLA-4 依赖的免疫调节能力,还可抑制心脏移植和肾移植排斥反应[13]。但是选择性CD28 阻断剂在异种移植中的作用有待进一步研究。
CTLA-4 是CD28/CTLA-4/B7 通路中另一个重要的免疫调节分子[14-16]。CTLA-4 与CD28 具有同源性,这使与该通路有关的受体-配体相互作用更加复杂,如相互竞争配体CD80 和CD86[17-18]。与CD28和CD80/86 相比,CTLA-4 在T 细胞中的延迟表达及其更多的相互作用导致了其对T 细胞激活的调控作用,降低了活化的T 细胞数量和能力,同时保留了CD4+Foxp3+调节性T 细胞的发育和功能[18]。
CTLA-4-免疫球蛋白(immunoglobulin,Ig)由CTLA-4 的胞外结构域与人IgG1 的Fc 区融合而成[19]。由于CTLA-4 与B7 分子的结合亲和力远高于CD28,人们研发了CTLA-4-Ig,并将其作为CD28/B7 相互作用的竞争性抑制剂。美国食品与药品监督管理局(Food and Drug Administration,FDA)批准第一代CTLA-4-Ig 阿巴西普(abatacept)用于治疗类风湿性关节炎和银屑病[20-21],但其抑制B7-2(CD86)的能力远远不如内源性CTLA-4,导致体内B7 介导的T 细胞活化不完全阻断。在非人灵长类动物移植研究中,阿巴西普在延长同种异体移植物存活率方面效果不佳[22]。另一种CTLA-4 融合蛋白贝拉西普(belatacept)也因此被研发出来,它与阿巴西普的不同之处在于其配体结合域被两个氨基酸取代,与B7-1(CD80)和B7-2(CD86)的结合更强,从而产生更强的免疫抑制作用[19]。贝拉西普于2011 年6 月获得FDA 批准,同年4 月获得欧洲药品管理局批准,在肾移植中可代替钙调磷酸酶抑制剂[23]。与同种肾移植相比,贝拉西普在异种肾移植中的治疗效果并未达到预期。非人灵长类动物异种肾移植实验中,接受贝拉西普治疗的受体在移植术后早期(2~3 周)发生了排斥反应,组织学表现为抗体介导的排斥反应和细胞介导的排斥反应[24]。利用基因改造技术使供体猪产生CTLA-4-Ig 的效果也没有达到预期,可能因为CTLA-4-Ig 在供体猪体内产生过于广泛,抑制了供体猪的自身免疫,导致其生长过程中感染的发生率较高,影响供体生存[25]。
2.2 CD40/CD40L 通路
CD40 是肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)超家族成员,也称为TNFRSF5,主要由Ⅰ型跨膜蛋白组成,结构相对保守,在B 细胞、单核细胞、血小板和巨噬细胞以及非造血细胞如肌成纤维细胞、成纤维细胞和内皮细胞上表达[26]。诱导CD40 可以刺激APC 介导的促炎因子和趋化因子的释放。CD40 也会诱导CD80 和CD86 的上调,从而有助于CD28 介导的T 细胞活化与分化。此外,当与T 细胞上的CD40L(CD154)连接时,B 细胞上的CD40 信号促进其增殖、Ig 产生、同型转换和记忆B 细胞生成[27]。与CD40 一样,CD154 也是TNFR 超家族成员,以生物活性的可溶性形式存在,由蛋白水解裂解产生。CD154 主要在活化的T 细胞、B 细胞和血小板上表达,在单核细胞、自然杀伤细胞、肥大细胞和嗜碱性粒细胞上也可诱导其表达。
CD40/CD40L 通路在T 细胞介导的树突状细胞和巨噬细胞的激活以及T 细胞依赖的体液免疫应答中起着至关重要的作用[28-29]。抑制CD40/CD40L 之间的相互作用将抑制B 细胞和APC 激活以及随后的T 细胞活化与分化[30]。在实体器官移植的临床前模型中对CD40/CD40L 通路的阻断证实了这一观点,阻断CD40/CD154 通路将会延长同种异体移植物的存活时间[31]。相反,刺激CD40/CD154 通路可能有利于肿瘤免疫治疗[32]。阻断CD40/CD154 通路已经证明了其在猪到非人灵长类动物移植临床前模型中延长异种移植物无排斥反应存活时间的潜力[33]。
2000 年,Bühler 等[34]在猪到狒狒的造血祖细胞移植模型中,证实了基于环孢素的常规免疫抑制治疗不能抑制机体对移植物的免疫排斥反应,需要应用共刺激阻断剂抗CD154 单克隆抗体,结果发现T 细胞共刺激阻断可能促进移植受体对猪器官和组织的免疫耐受。Mohiuddin 等[35]在异种心脏移植中使用抗CD40 单克隆抗体3A8 和2C10R4,同样阻断了共刺激通路,受体存活时间分别为27 d 和146 d。在基因编辑猪到非人灵长类的心脏、肾脏、角膜和胰岛移植实验中也证实了阻断CD40/CD154 通路在免疫抑制治疗中的有效性[36-40]。阻断CD40/CD154 共刺激通路,联合使用雷帕霉素(或霉酚酸酯)和糖皮质激素等作为维持治疗,延长了异种心脏、肾脏等器官移植的术后存活时间[41-43]。将基因编辑猪肾移植到狒狒体内,经过早期的免疫诱导治疗后,维持治疗阶段仅给予抗CD40 单克隆抗体和促红细胞生成素,受体存活数月,Cooper 等[44]认为单独阻断CD40/CD154 共刺激通路就足以作为异种器官移植中的维持治疗。需要指出的是,共刺激药物并不能替代异种移植早期抗胸腺细胞球蛋白和抗CD20 单克隆抗体(利妥昔单抗)等免疫抑制药的应用[42]。
目前已知CD154 不仅在T、B 细胞上表达,而且也在活化的血小板上表达,阻断CD40L 可导致受体出现血栓栓塞[45-46]。在非人灵长类动物的临床前研究中,HU5C8 和ABI793 这两种抗CD40L 单克隆抗体已经在非人灵长类动物的临床前研究中发现了血栓形成[27,47]。此外,治疗狼疮和肾移植排斥反应的Ⅱ期临床试验中,同样观察到HU5C8 可导致血栓栓塞性并发症[27]。虽然可以同时使用非甾体抗炎药来预防血栓形成,但这类抗CD40L 单克隆抗体的临床应用还是受到影响。目前认为血栓形成与抗CD154 抗体的Fc 段有关[48-49]。最近,新型抗CD154 抗体TNX-1500 可避免这些不良反应,TNX-1500 是通过设计Fc段,减少了与Fc-γ 受体Ⅱa 的结合。在非人灵长类同种肾移植模型中,给予TNX-1500 可以有效阻断CD40/CD154 通路,显著延长同种异体移植物的存活时间,而无血栓栓塞性事件发生[50]。在异种移植中,TNX-1500 也发挥了较好的作用,受体长期存活[51]。研发不会引起血栓的抗CD154 抗体对于异种移植的发展十分重要,自2000 年以来,几乎所有成功的异种移植免疫抑制方案都是以阻断CD40/CD154 共刺激信号通路为基础的,包括ch5D12、3A8、Chi220 和2C10R4 等。不过越来越多的临床前证据表明,在异种移植中,抗CD154 抗体在延长移植物存活时间方面优于抗CD40 抗体[52]。
共刺激阻断药物在猪到非人灵长类动物的异种移植实验中取得良好的效果,受体移植术后存活时间远远超过6 个月,达到了临床异种移植试验的规定时间门槛,临床异种移植也因此得以积极开展。2022 年1 月Griffith 等[53]在美国马里兰大学医学中心为1 例57 岁的终末期心脏病患者实施了世界首例基因编辑猪-人心脏移植,免疫抑制方案包括使用新型人源化单克隆抗体(KPL-404),用于阻断CD40 共刺激通路,患者术后存活59 d。临床异种肾移植也在积极开展,2021 年,美国阿拉巴马大学和纽约大学朗格尼移植研究所的两支研究团队分别开展了临床级异种肾移植试验,前者将经过基因编辑的猪肾脏植入1 例脑死亡男性体内,在74 h 内,移植的猪肾脏保持活力并产生尿液,没有明显的超急性排斥反应,后者则是进行2 例猪-人异种肾移植,将经过基因编辑的猪肾脏与1 例脑死亡供者在体外相连,试验进行了54 h,并且未显示超急性排斥反应或抗体介导的排斥反应[54-55]。2023 年,美国阿拉巴马大学团队证实基因编辑猪的肾脏移植到脑死亡患者体内可以正常发挥肾功能至少1 周,维持患者的基本生命体征[56]。截止至目前,由于FDA 尚未批准抗CD40 单克隆抗体和抗CD154 单克隆抗体在人体的使用,因此上述异种肾移植临床试验暂未使用这两种抗体。虽然异种移植中的共刺激阻断免疫疗法主要在猪到非人灵长类动物移植模型中使用,不过依旧可以看到共刺激通路阻断在猪到人异种移植中的巨大潜力。
3 小结与展望
综上所述,共刺激阻断剂在异种肾移植中的作用十分关键且或将在未来临床试验中使用。目前解决异种移植模型中排斥反应的方案包括共刺激阻断剂和抗CD20 抗体、吗替麦考酚酯等药物联合使用。有许多新的药物通过阻断CD40/CD154 通路延长了异种移植物在受体体内的存活时间。短期内的临床前研究和较少的临床试验并不足以表明共刺激阻断剂在临床异种移植中的可靠性,抗CD154 抗体及抗CD40 抗体的效果仍需要验证。因此,对新的共刺激或共抑制靶点的研究,以及对临床异种移植中更可靠的共刺激药物的研发可能会成为未来研究的热点方向。

