6种红树幼苗对不同盐度的生理适应性
方发之 桂慧颖 黎肇家 张晓凤
(海南省林业科学研究院,海南省红树林研究院,海口 571000)
盐胁迫作为植物经常遭受的非生物胁迫之一,严重影响植株的正常生长,并降低植物的生产力[1]。因此,植物对盐胁迫的生理适应性和耐盐机制一直是植物生物学研究的热点问题[2-4]。植物遭受盐胁迫的主要原因是环境中过高的NaCl浓度引起渗透胁迫,植物很难从盐水环境中获取水分以及磷、钾、钙等营养元素。此外,植物体内过高的盐分积累会损伤细胞结构,影响细胞功能,最终抑制植物的生长和发育[5]。研究表明,盐胁迫会加剧细胞中的有毒代谢产物积累,抑制光合速率,引起细胞乃至整个植株的死亡[6]。植物对盐胁迫的生理适应是一个非常复杂的过程,涉及细胞的渗透调节、离子稳态、活性氧清除以及光合作用等[7]。虽然目前对植物的耐盐性进行了大量研究,但研究对象多集中于淡土植物,对盐胁迫的耐受性有限。盐生植物可以在盐浓度200 mmol·L-1以上的环境中生长,部分盐生植物具有非常高的抗盐能力[8]。因此,对盐生植物进行盐胁迫的生理适应性研究可能更有助于了解植物的耐盐机制。
红树林是生长在热带和亚热带河口的盐生热带植物群落,由于生境特殊,红树植物已演化出适应一定盐度环境的生理机制[9]。红树林植物没有耐盐代谢,但在长期的适应过程中进化出了排盐和泌盐的功能[10]。例如,在蒸腾作用的驱动下,根部的超滤作用可以排除海水中的盐分[11]。通过表皮蒸腾和位于叶片下侧的盐腺进行排盐,或把盐积累在叶片细胞中,通过落叶去除植物中的盐分[12]。红树林植物可以在细胞质中积累相应的溶质,确保细胞中渗透压的平衡[13]。研究表明,海榄雌属(Avicennia)红树植物的树液中仅有0.5~8.0 的盐分浓度,远低于海水盐度,表明红树植物已经在高盐的海水环境中产生了一定的适应性[12]。目前越来越多的研究开始聚焦于红树树种的耐盐性。例如:游惠明[14]表明,秋茄(Kandelia obovata)幼苗随着盐度升高,生长量和生物量的积累都降低。唐密等[15]发现一定范围内提高盐度可以促进无瓣海桑(Sonneratia apetala)和灌木桐花树(Aegiceras corniculatum)的生长,但盐度过高(≥30%)条件下2 种植物均无法存活,Krauss 等[16]研究发现,盐度分别为20%和15%时美洲红树(Rhizophora mangle)和海莲(Bruguiera sexangula)生长最好。但多种红树植物对不同盐度的生理适应和相关性仍有必要进一步探讨。
据调查,海南岛是中国红树植物种类分布最多的地方,是我国红树林的重要分布区[14,17]。以前,红树林在海南岛的河口港湾地带广泛分布,但是因为近几年人为过度影响,加上气候变化,导致红树林破坏严重,物种多样性降低,资源减少,生态系统循环也遭到破坏,致使保留下来的红树林面积减少且多为灌木或小乔木。因此,重建已遭破坏的红树林迫在眉睫,而对红树植物在不同盐度条件下的生理生长适应性研究对了解盐生植物的耐盐机制、群落保护和恢复都具有重要的现实意义和科学价值。本研究选取海南6 种典型红树植物幼苗:海莲、木榄(Bruguiera gymnorhiza)、角果木(Ceriops tagal)、红海榄(Rhizophora stylosa)、秋茄、桐花树为研究对象,通过控制8 个梯度的盐度环境因子,探讨6种红树植物幼苗生长生理适应性差异,揭示红树植物幼苗对盐度环境因素变化做出的响应规律。
1 材料与方法
1.1 试验材料
本试验在海南省临高县海南省林业科学研究院(海南省红树林研究院)马袅红树林苗圃进行(19°54′45″N,109°50′58″E;图1),选用人工培育的红树植物幼苗为试验材料。6 种红树植物幼苗均选取1 年生,植株大小基本一致,长势良好且健康的幼苗。盆栽选用规格为30 cm×30 cm×80 cm的白色塑料桶,桶底盛有15 cm 高的砂质作为底质,水淹高度为50 cm。人工海水由自来水和进口海盐配制,并用WYY35T型盐度计标定盐度。6种植物分别进行0、5%、10%、15%、20%、25%、30%、35%共计8 个盐度处理,每个处理3 个重复(共计24 桶),每个桶放3 株植物。2022 年4 月1 日,将盆栽放置在取苗地附近的空地,让其接近自然生长的条件,同时配备相应的遮雨设施,进行各项指标检测,并于6个月后(2022年10月1日)进行第2次指标检测。
1.2 试验方法
1.2.1 生态指标测定方法
1.2.1.1 幼苗生长指标测量
在幼苗种植前,使用精度为1 mm 的卷尺测量每一株幼苗的高度,并使用精度为0.01 mm的游标卡尺测量每一株幼苗的基径。种植的同时挂牌标记。在试验6个月后,采用同样的方法再次测量每一株幼苗的高度和基径。
1.2.1.2 幼苗生物量测量
试验结束后,将收集的每一株幼苗放入烘箱中110 ℃杀青2 h,而后将温度调节至80 ℃烘干幼苗直至恒质量,再使用精度为0.01 g的电子天平称量干物质质量。
1.2.2 生理指标测定方法
1.2.2.1 光合作用测定
利用便携式光合作用测量系统(LI-6400XT,美国)进行光合参数测定,测定时间选择在晴天的09:00—11:00,测定光强为1 200 μmol·m-2·s-1。每株幼苗选择3 片健康叶片,重复测量3 次,记录净光合速率[18]。
1.2.2.2 光合色素含量测定
光合色素测定采用分光光度法[19],采集新鲜植物叶片洗净后称取0.1 g,用蒸馏水和丙酮按1∶4 体积比配制的混合提取液直接提取,使用分光光度计测量在波长663 nm 和645 nm 处的吸光值。
式中:A663为波长663 nm 时的吸光值;A645为波长645 nm 时的吸光值;V为提取液体积,10 mL;D为稀释倍数;m为样本鲜质量,0.1 g。
1.2.2.3 超氧化物歧化酶(SOD)、丙二醛(MDA)、脯氨酸(Pro)测定
SOD 活性采用氮蓝四唑(NBT)法进行测定,以鲜质量计算(U·g-1);Pro含量采用茚三酮比色法进行测定,以鲜质量计算(μg·g-1);MDA 含量采用硫代巴比妥酸氧化法进行测定,以鲜质量计算(nmol·g-1)。3 种酶活性均使用苏州科铭生物技术有限公司酶试剂盒(超氧化物歧化酶试剂盒、脯氨酸含量测定试剂盒、丙二醛含量试剂盒),并参照试剂盒说明进行试验操作,以上指标参照李玲[20]的方法并略加调整。
1.3 数据处理
原始数据采用Excel 进行整理、并制作图表,采用SPSS 软件单因素方差分析计算各组间的差异显著性,R(ggcorrplot)计算不同参数之间的相关性。
2 结果与分析
2.1 6种红树植物幼苗在不同盐度下生长特征的变化
6种红树植物幼苗的株高增量、基径增量和生物量随着盐度的升高均呈现先上升后下降的趋势(图2)。整体而言,株高增量、基径增量和生物量最高值均出现在盐度5%~20%,盐度过高或过低3种指标均会下降。其中,在生物量积累中以秋茄的最适宜盐度最低(5%),桐花树的最高(20%);生物量的最高值由大到小依次为红海榄、角果木、桐花树、海莲、木榄、秋茄;适宜红树植物幼苗株高生长的盐度范围以木榄和海莲最大,为5%~20%,秋茄和红海榄其次,分别为5%~15%和10%~20%,角果木株高只在15%的盐水中生长最好;适宜红树植物幼苗基径生长的盐度范围以木榄最大,为10%~20%,角果木、海莲、桐花树、秋茄其次,分别为10%~15%、10%~15%、15%~20%、5%~10%,红海榄基径只在20%的盐水中生长最好。整体而言红树植物幼苗株高生长所需的盐水盐度范围比基径生长所需的盐度范围更大。
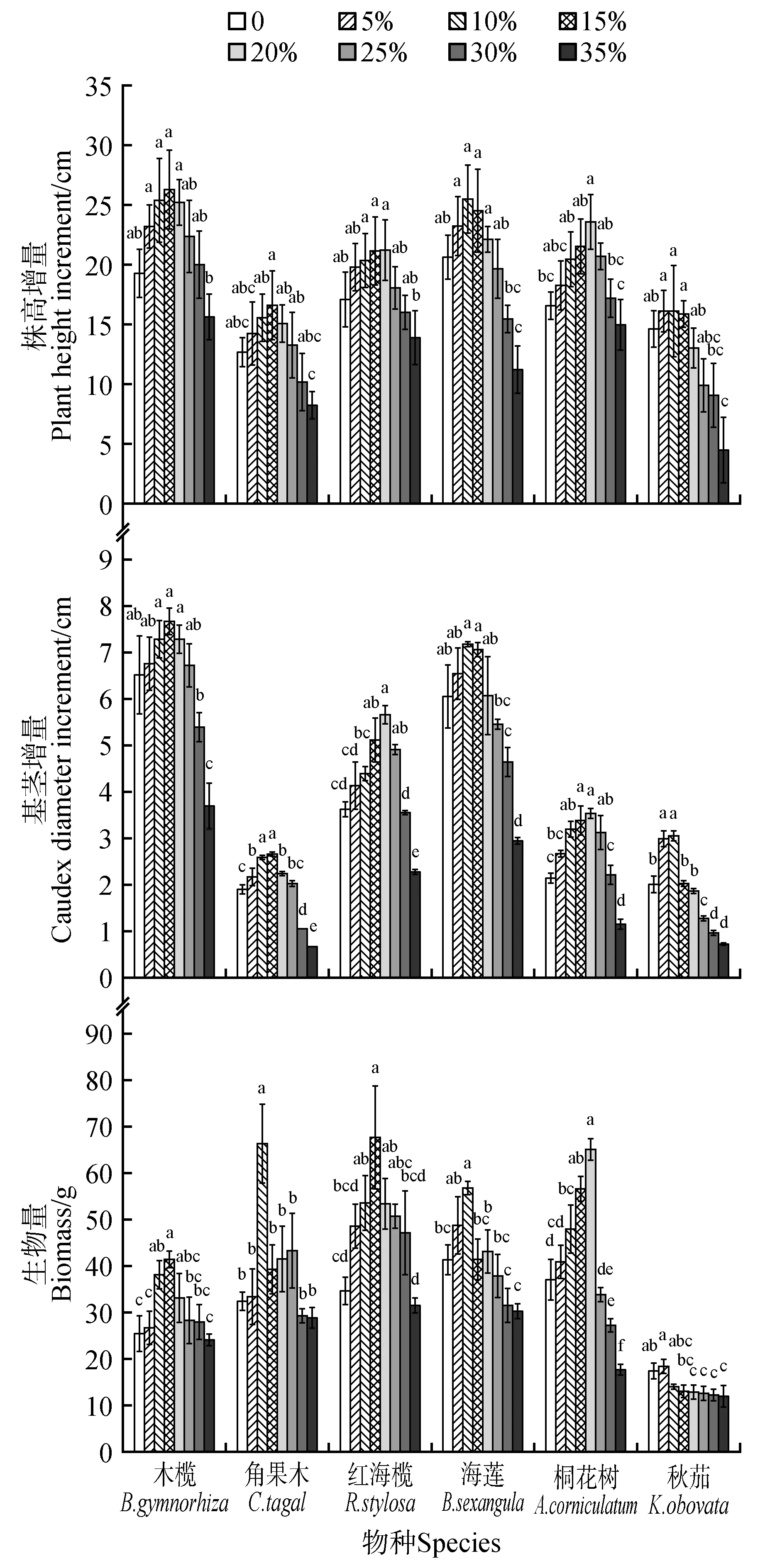
图2 6种红树植物幼苗在不同盐度下的株高增量、基径增量和生物量不同小写字母代表同物种在不同盐度下的差异显著(P<0.05);下同Fig.2 Plant height increment,base diameter increment and biomass of six mangrove seedlings under different salinity The different lowercase letters represented the significant differences of the same species under different salinit(yP<0.05);the same as below
2.2 盐度对6种红树植物幼苗净光合速率和叶绿素含量的影响
试验过程中,木榄、角果木、海莲和秋茄4种红树植物幼苗的净光合速率均随着盐度的升高逐渐降低,最高值出现在淡水条件中,红海榄和桐花树2 种红树植物幼苗的净光合速率随着盐度的升高呈现先升高后降低的趋势,最高值分别出现在盐度20%和25%。6 种红树植物幼苗的最高净光合速率以红海榄最大,桐花树其次,角果木最小(图3)。
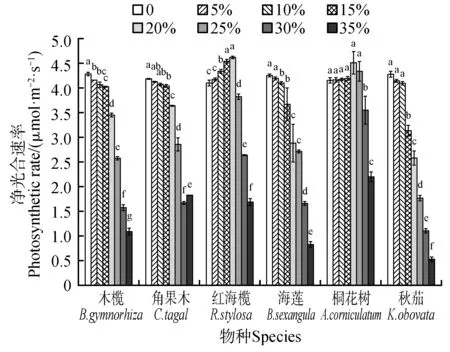
图3 不同盐度对红树幼苗叶片净光合速率的影响Fig.3 The effects of different salinity on net photosynthetic rate of mangrove leaves
6种红树植物幼苗的叶绿素质量分数(叶绿素a、叶绿素b 和总叶绿素),最低值出现在盐度5%~20%,盐水盐度超过20%或低于5%均会引起红树植物幼苗的叶绿素质量分数升高,相比低盐度盐水,高盐度的盐水会引起叶绿素质量分数大量增加,6种红树植物幼苗的叶绿素质量分数最高值均出现在盐度30%或35%的盐水中,分别高出最低值的0.45~1.86 倍,以叶绿素b 的质量分数升高最多,高出最低值的0.85~1.86倍(图4)。
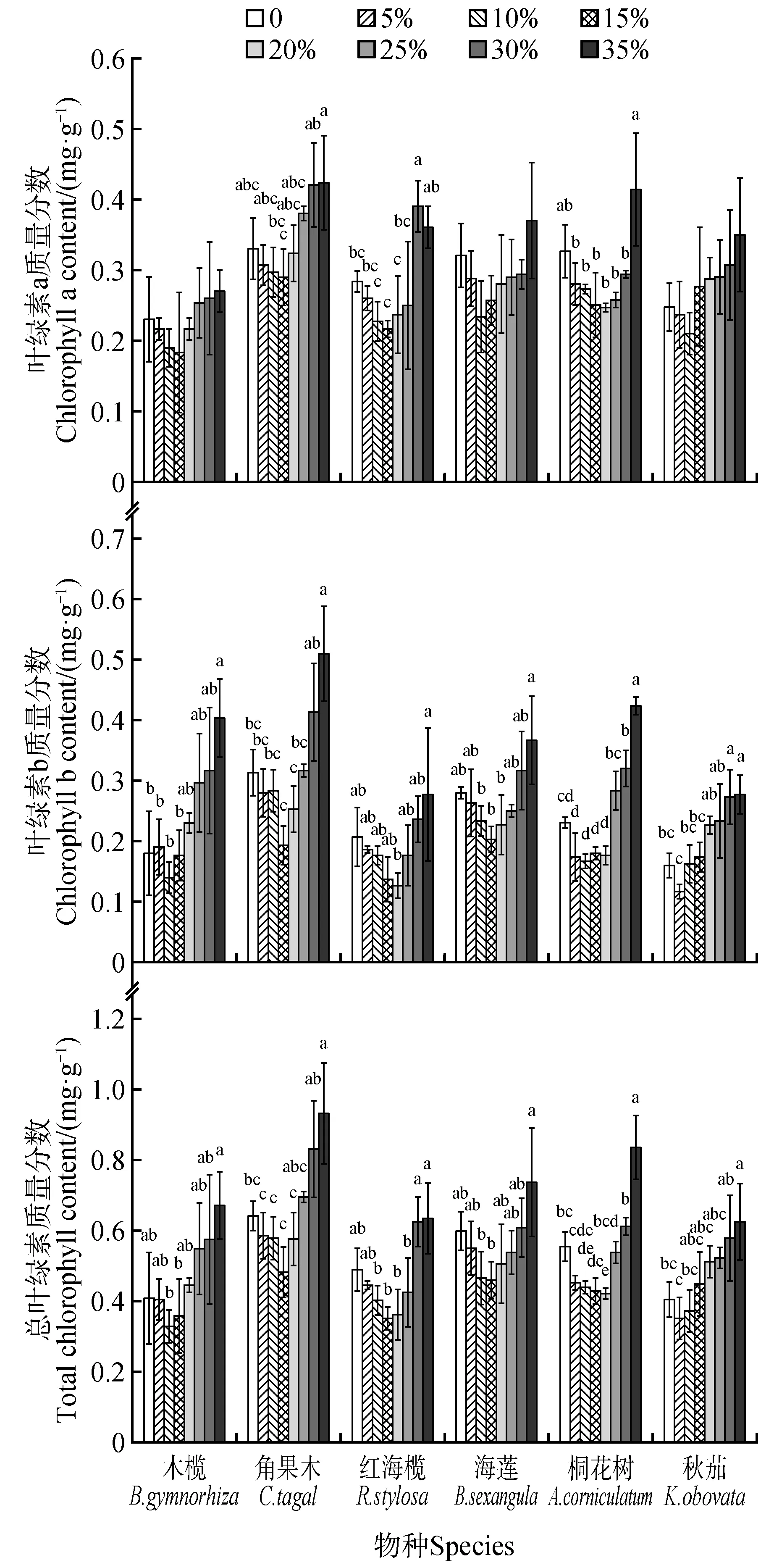
图4 盐度对红树幼苗叶绿素质量分数的影响Fig.4 The effect of different salinity on chlorophyll content of mangrove seedlings
2.3 盐度对6种红树植物幼苗叶片内抗逆性生理指标的影响
6 种红树植物幼苗的MDA 质量摩尔浓度、SOD 活性、Pro 质量分数呈现在低盐度保持相对稳定,后期随盐度升高而逐渐升高,最低值均出现在盐度5%~20%,最高值均在盐度35%处出现(图5)。
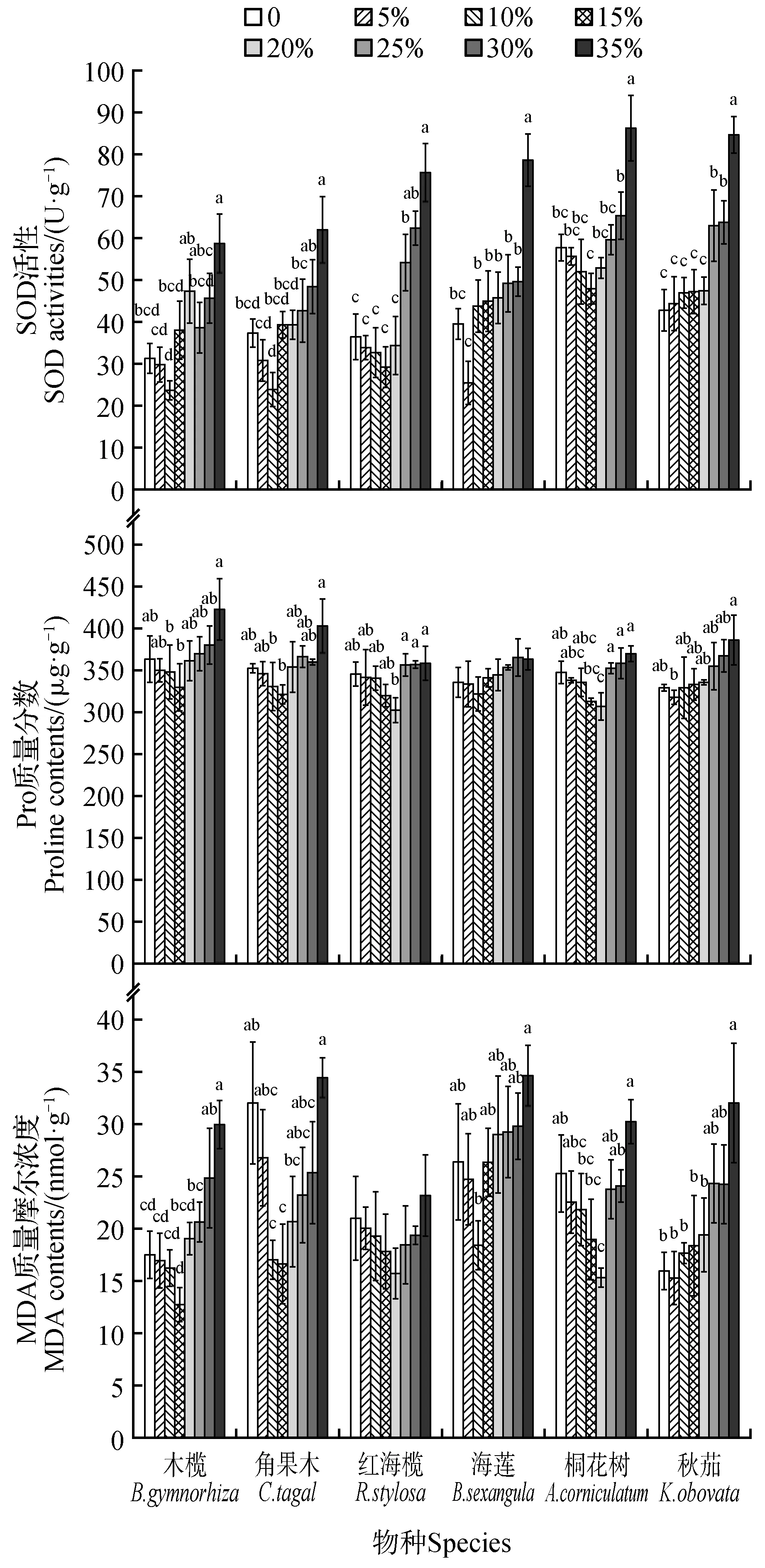
图5 盐度对红树幼苗SOD活性、Pro质量分数和MDA质量摩尔浓度的影响Fig.5 The effects of different salinity on SOD activity,proline content and MDA content of mangrove seedlings
2.4 不同盐度下红树幼苗生物量、叶绿素与抗逆性生理指标之间的相关性
不同盐度下,红树幼苗的叶绿素质量分数(叶绿素a、叶绿素b、总叶绿素)与MDA 质量摩尔浓度、SOD 活性、Pro 质量分数之间呈正相关,生物量仅与净光合速率呈正相关,生物量、净光合速率与叶绿素质量分数、抗逆性生理指标之间均呈负相关(图6)。
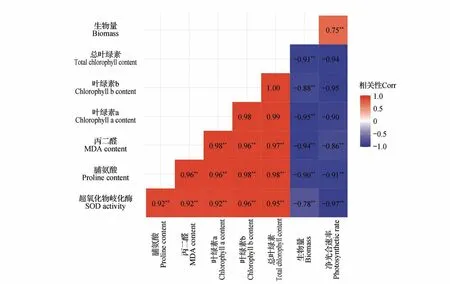
图6 不同盐度下红树幼苗生物量、叶绿素与抗逆性生理指标之间的相关性星号表示显著相关(**P<0.01)Fig.6 The correlation of biomass,chlorophyll content and physiological indexes of stress resistance of mangrove seedlings under different salinity The asterisk indicated significant correlations(**P<0.01)
3 讨论
3.1 6种红树幼苗的适宜生长盐度
红树林作为热带沿海或潮汐低地地区的一种特殊群落,显著的特征是可以耐受海水中一定的盐度水平[21]。但是过高或过低的盐度均会严重影响红树植物的生长,导致植株的外观形态发生变化,严重的可能会引起植株死亡[22]。本研究中,6 种红树植物幼苗在盐度5%~20%具有最高的株高增量、基径增量和生物量,表明6 种红树植物幼苗适宜生活在5%~20%的盐水中,与前期研究的统计结果[23]类似。相关研究表明,海水的盐度一般在30%以上[24],远高于适宜6 种红树植物生长的最高盐度(20%),可能的原因是红树林主要生长于河口和海岸线等海陆交汇处,水文条件复杂,包括海水、河水、地下水和雨水等多种水源均在此处汇聚,并在潮汐的影响下相互作用,海水的盐度被稀释所导致[25]。6种红树植物幼苗中,仅桐花树在高盐度的海水中(20%)具有最高的株高增量、基径增量和生物量,耐盐性最高,可能与植物中具有典型的盐腺进行泌盐有关[26]。
3.2 6种红树幼苗的光合作用与盐适应性
红树树种虽然可以在具有一定盐度的海水中生长,但盐度过高会对红树树种产生胁迫作用,影响植物正常的生理状态。研究表明,叶绿体中过高的Na+和Cl-含量,会抑制光系统Ⅱ功能和光合电子传递,降低核酮糖二磷酸羧化加氧酶活性,红树的光合作用能力与物种控制共质体中盐浓度的能力有关[21]。逆境环境中,盐胁迫影响渗透胁迫,Na+和Cl-过度积累会破坏细胞中的离子平衡,减少其他离子吸收,引起细胞脱水和澎压减小[27]。此外,盐胁迫还会破坏叶绿体膜或细胞中其他细胞器的结构,降低植物气孔导度,减少CO2吸收,降低光合作用速率[28-30]。6 种红树树种中,木榄、角果木、秋茄3种红树植物幼苗的净光合速率均随着盐度的升高而逐渐降低。木榄、角果木和秋茄均属于常见的拒盐红树树种,根部结构可以阻止多余的盐分进入植物体,保持细胞中较低盐分浓度,光合作用的下降可能是因为根系在高盐度环境中受到盐胁迫加剧。比较有趣的是红海榄,同样属于拒盐红树树种,却在20%盐度下有较高的净光合速率,这可能与红海榄特殊的次生木质部结构有关,红海榄的次生木质部具有大量纤维状导管、环管管胞、螺旋雕纹与附物、生长轮和薄壁细胞(含淀粉粒)等结构,可以加强导管在高负压下对水分的聚合力,提高水分输导过程中的安全性与有效性,减少栓塞发生,适应高盐环境[31]。6种树种中,桐花树可以在25%盐度下有效率的进行光合作用,耐盐能力最强。桐花树属于泌盐植物,除根系拒盐之外,植物体中还有特殊的盐腺,可以把积累的多余盐分排出,具有较高的耐盐能力[26]。植物的光合作用速率与叶绿素含量直接相关,叶绿素a与叶绿素b是高等植物进行光合作用的主要色素,其含量变化在一定程度上可以反应光合作用的高低[32-33]。盐胁迫条件下,一些植物的叶绿体类囊体膜会被破坏,叶绿素合成减少,光合作用速率下降[34-35]。但是,本研究发现6 种红树树种在受到盐胁迫时,叶绿素含量逐渐升高。同时,在相关性分析中,叶绿素含量与抗逆性生理指标呈正相关,表明盐胁迫可能会导致叶绿素含量上升。6 种红树植物在盐胁迫条件下叶绿素含量上升可能是一种抗性反应,目的是为了在逆境中通过提高叶绿素含量尽量维持植物的光合作用[36];而相关性分析显示,叶绿素含量与生物量和净光合速率呈负相关,表明由于随着盐胁迫的加剧,叶绿素含量的增加并不能弥补盐胁迫造成的光合速率损失。
3.3 6种红树幼苗的抗逆反应与盐适应性
本研究结果显示,随着盐度的上升,6 种红树林植物幼苗的SOD 活性、Pro 含量和MDA 含量均呈现低盐度保持稳定(或略降低),后期随盐度升高而升高的趋势。外界胁迫作用会诱导植物体内产生多种活性氧,包括超氧化物、过氧化氢、羟基自由基等[37-39]。SOD 作为抗氧化酶的一种,可以将超氧化物转化为H2O2和O2,H2O2继续被过氧化氢酶和过氧化物酶分解,起到清除活性氧的作用,是反应植物抗逆性的一个重要指标[22]。当植物遇到外界胁迫时,通常会提高SOD 活性以抵御外界不利因素的影响[40]。本研究中,SOD 活性最低值均出现在盐度5%~20%,与6种红树植物幼苗适宜生活的盐度范围相同,超过20%盐度,SOD 活性逐渐上升,最高值均出现在盐度35%,表明35%盐度严重胁迫了红树植物幼苗的生长,与廖宝文等[18]的研究结果类似。丙二醛是膜脂质过氧化的重要产物,是评价膜脂过氧化的一项重要指标。植物在逆境环境中,细胞膜会受到影响,导致其细胞膜的完整性破坏或丧失,可以体现植物在逆境中受到的胁迫程度[41]。例如,研究发现,通过低压贮藏可以减少杨梅(Myrica rubra)果实中MDA 的积累,抑制细胞膜透性增加,延长果实保鲜期[42];海水稻(Oryza sativa)品种在受到盐胁迫时,积累的MDA含量少于盐敏感品种IR29,细胞膜损伤小,表现出非常强的抗逆性[43];在盐胁迫时,通过硝普酸钠处理秋茄,可以降低植物组织中MDA 含量,减轻细胞的氧化损伤[44]。本研究中,6 种红树植物幼苗MDA 含量随盐度上升显著上升,表明受到的盐胁迫越来越严重,特别是在盐度35%的条件下,MDA含量升至最高,表明幼苗细胞膜在高盐环境中受到了严重的破坏。Pro 作为细胞中重要的渗透调节物质,当植物受到环境胁迫时,Pro 含量会大量增加,通过维持细胞渗透压或提高抗氧化能力,来维持细胞正常的生理功能[45-46]。前期研究表明,小花木榄(Bruguiera parviflora)在生长过程中会通过调节Pro含量影响细胞中糖类和总氨酸含量,抵御外界环境胁迫[47];廖宝文等[18]研究发现,在高盐条件下,尖瓣海莲(Bruguira sexangulavar.rhynchopetala)中Pro 含量是中低盐条件下的2~3倍,表明在高盐条件下逆境加剧了对尖瓣海莲幼苗的伤害;张留恩等[48]的研究也表明,在水淹条件下,老鼠簕(Acanthus ilicifolius)会通过增加Pro 含量来增加细胞抗性,抵御水淹胁迫。本研究中 6 种红树植物幼苗中Pro 含量在5%~20%处于较低水平,后随着盐度的增加而上升,在35%盐度下达到最高值,表明随着盐度上升,6 种红树植物幼苗受到的环境胁迫逐渐加重。值得注意的是,虽然在低盐环境中抗逆性生理指标保持相对的稳定,但在无盐环境中,6 种红树植物幼苗的MDA 含量、SOD 活性和Pro 含量仍略高于在低盐生长环境中的MDA含量、SOD 活性和Pro 含量,表明基于红树树种本身的物种特性,无盐环境仍不利于红树幼苗的生长。因此,本研究显示,在受到外界胁迫时,6种红树植物幼苗会通过增加叶片中SOD 活性、Pro 含量和MDA 含量,提高植物抗逆性,抵御外界不良环境的影响。

