不同载体和农杆菌对苜蓿瞬时表达影响的研究
孙 敏 杨红红 王安琪 张悦婧 达晓伟 张 继,2孙 坤 吴建平,2 冯汉青,2*
(1.西北师范大学 生命科学学院,兰州 730070; 2.西北师范大学 新农村发展研究院,兰州 730070)
在植物中表达外源基因主要有2种方法:第一种稳定转化,即将外源基因整合到植物基因组中,并通过筛选和鉴定形成稳定的转基因植株[1]。第二种是通过农杆菌(Agrobacterium tumefaciens)介导的瞬时表达技术在植物中快速表达目的基因,即将目的基因整合到农杆菌Ti 质粒的T-DNA 中,通过农杆菌对植物体细胞的侵染使T-DNA 转移到植物细胞核中;尽管大部分转入的T-DNA 并未整合到植物基因组中,但外源基因可在短期内借助植物细胞的转录和翻译系统进行表达[2-3]。因此,与第一种方法相比,农杆菌介导的瞬时表达技术节省了筛选、鉴定和子代遗传等步骤,能够在短期内在植物中表达外源基因[2]。目前,农杆菌介导的瞬时基因表达技术已成为研究植物基因功能和蛋白质定位的有力工具,而且通过该技术可以以植物为生物反应器快速完成药用蛋白、抗体、抗原的生产,因此该技术也具有重要的应用价值[4-5]。
苜蓿(Medicago sativa)是世界上除了大豆外种植量最多的豆科植物[6],其地上部分产量高,营养价值丰富,适口性好,是动物的优良饲料,被誉为“牧草之王”[6-7]。一方面,对苜蓿中基因功能等理论问题的深入研究需要借助外源基因转化和表达技术;另一方面,依托苜蓿的饲草功能,在苜蓿中转入动物疾病相关的抗原或抗体可制备动物的口饲疫苗[8],可进一步提升苜蓿的利用价值。因此,如何在苜蓿中进行快速有效的基因转化已成为相关研究的重点问题。
目前,已有诸多课题组对苜蓿进行了稳定转化的研究,其主要策略是通过携带外源基因的农杆菌对苜蓿的叶片[9-11]、花[12]、根[13]、子叶或下胚轴[14]进行转染,并通过外植体再生获得稳定转化的苜蓿植株。通过上述策略,有效提高了苜蓿的农艺学性状或增加了苜蓿的应用价值。例如,Wang 等[15]将IbOr 基因转入苜蓿中使其稳定过表达,从而增加了苜蓿中类胡萝卜素的积累量并提高了苜蓿对多种非生物胁迫的抗性。Ullah 等[16]将无花果曲霉(Aspergillus ficuum)中的磷酸单酯酶编码基因稳定转化苜蓿,由此实现了通过苜蓿进行磷酸单酯酶的生产。但是,上述的过程通常需6个月以上,整个周期较为漫长,且涉及到转化、筛选、植株再生等多个环节,技术步骤相对繁琐[9]。其次,通过上述方法对苜蓿进行稳定转化也受到苜蓿品种的限制。已有诸多工作表明不同苜蓿品种的稳定转化效率、外植体再生能力,乃至外植体对培养基的敏感度均和苜蓿品种有关,其原因可能在于稳定转化过程中外植体的形成、植株的再生能力等均会受到苜蓿品种基因型的影响[10-11,14,17]。因此,在苜蓿中进行外源基因的稳定遗传转化受到多种因素的制约,无法有效满足目前对苜蓿理论和应用研究的需求。
如上文所述,与稳定的遗传转化相比,植物瞬时表达可在短期内实现外源基因的表达。但目前如何在苜蓿中有效地进行外源基因的瞬时表达并提高其表达量尚缺乏相应的研究。从生物学的角度讲,农杆菌介导的外源基因瞬时表达是一系列复杂生物学事件的结果,包括了农杆菌对植物组织的侵染、外源基因对植物基因表达系统的利用,以及蛋白质生物合成和在组织中的积累等[18]。因此,农杆菌的类型和浓度、外源基因的拷贝数,以及外源基因表达的时间性等因素是决定外源基因进行有效的瞬时表达及其表达量的关键因素。
鉴于以上原因,本研究以绿色荧光蛋白(GFP)基因作为报告基因,以非复制型和复制型载体为不同类型的表达载体,非复制型表达载体缺乏在植物细胞中进行复制的能力;复制型表达载体是基于菜豆黄矮病毒构建的表达载体,可以通过滚环复制机制在植物细胞中快速复制形成多拷贝[19-20],以LBA4404 和EHA105 为不同类型的农杆菌菌株,研究了表达载体类型、农杆菌菌株类型、农杆菌浓度、侵染后孵育时间等要素对苜蓿叶片瞬时表达的影响,并以本氏烟草(Nicotiana benthamiana)作为对比以期建立高效的苜蓿瞬时基因表达技术,为相关工作提供借鉴和参考。
1 材料与方法
1.1 植物材料培养
苜蓿的培养:将苜蓿种子(中苜一号,购自江苏沐阳鼎盛种业有限公司)在25 ℃蒸馏水中浸泡12 h 后,置于用蒸馏水润湿的双层纱布中,在光照下孵育6 h。用蒸馏水冲洗种子,并在23 ℃黑暗条件下用单层纱布覆盖2~3 d(期间用蒸馏水保持纱布湿润)。将萌发的种子移植到培养基质中(体积比为2∶1 的营养土和蛭石的混合物),并在25 ℃、湿度为50%、16 h 光照/8 h 黑暗的环境中培养至2周龄时用于农杆菌侵染。
本氏烟草的培养:将育苗块(购买于上海尚新园艺有限公司)放入托盘中,用蒸馏水浸泡2~3 h,使育苗块充分吸收水分,每个育苗块种植2~3 粒本氏烟草种子,用透明塑料盖覆盖托盘,并将其置于25 ℃、湿度为50%、16 h 光照/8 h 黑暗的环境中培养。生长2周后,移除塑料盖,每2天对植株施用1次14.8 g·L-1的营养液(Jack’s fertilizer),继续在上述条件下培养至4 周龄时移苗以提供充足的空间继续生长,将5周龄的植株用于农杆菌的侵染。
1.2 农杆菌的构建
非复制型表达载体(pBIN+-GFP-HA,详见Rairdan 等[21])由Bouwmeester 教 授(Wageningen University)馈赠;基于BeYDV(Bean yellow dwarf virus,菜豆黄矮病毒)的复制型载体(pBYR2,详见Chen等[19])由Mason 教授(Arizona State University)馈赠(以下简称为“复制型载体”)。在2 种载体的35S启动子下游构建绿色荧光蛋白基因作为报告基因,并将2 种载体分别转入LBA4404 和EHA105 农杆菌菌种中,用50 mg·L-1卡那霉素、25 mg·L-1利福平和25 mg·L-1氯霉素筛选LBA4404 阳性克隆;用50 mg·L-1卡那霉素和25 mg·L-1利福平筛选EHA105阳性克隆。继而产生4 种载体/农杆菌组合:1 revector/LBA4404(携带复制型载体的LBA4404 菌株);2 non-re-vector/LBA4404(携带非复制型载体的LBA4404 菌株);3 re-vector/EHA105(携带复制型载体的EHA105 菌株);4 non-re-vector/LBA4404(携带非复制型载体的EHA105菌株),并用于以下试验。
1.3 菌悬液的制备
将携带复制性和非复制性的LBA4404 菌株分别接种于含有50 mg·L-1卡那霉素、25 mg·L-1利福平和25 mg·L-1氯霉素的YEB 琼脂平板上划线培养,在28℃下生长2 d;将携带上述载体的EHA105菌株接种于含有50 mg·L-1卡那霉素(Kana)和25 mg·L-1利福平(Rif)的YEB 琼脂平板上划线培养,在28 ℃下生长2 d。从YEB培养基上挑取单菌落接种到含有相同筛选抗生素的50 mL YEB 液体培养基中,28 ℃下振荡(180 r·min-1)培养24 h[22]。5 000 r·min-1离心10 min 收集细菌,用侵染缓冲液(10 mmol·L-1MES-KOH,pH=5.5、10 mmol·L-1硫酸镁、100 μmol·L-1乙酰丁香酮)洗涤2次。将农杆菌重悬于50 mL 侵染悬浮液中,通过测量600 nm 处的光密度(OD)确定细菌浓度。将农杆菌菌液利用侵染缓冲液稀释至7 个不同的浓度(OD600=0.2、0.4、0.6、0.8、1.0、1.2、1.5)用于苜蓿叶片的侵染;将农杆菌菌液利用侵染缓冲液稀释至5个不同的浓度(OD600=0.2、0.4、0.6、0.8、1.0)用于本氏烟草叶片的侵染。分别在侵染后的第3、5、7、9天进行检测与分析,以未进行转化的LBA4404和EHA105为对照。
1.4 植物瞬时转化
选取大小、长势均匀的5周龄本氏烟草植株和2周龄的苜蓿植株,用针头在叶片背面的表皮上刺出1 个小口,用无菌注射器吸取2 mL 农杆菌悬液,通过无针注射口将菌悬液通过下表皮伤口注入叶片进行注射侵染[23]。侵染后在25 ℃、湿度为50%、16 h 光照/8 h 黑暗的培养环境中孵育培养,并在所需时间点(见上)取样观测。
1.5 绿色荧光蛋白(GFP)荧光的检测和分析
将植物叶片置于荧光体式显微镜(徕卡M205 FA,德国)下,用450~490 nm 的激发波长激发,在500~550 nm 的发射波长区间检测GFP 释放光;用Image J软件分析GFP荧光表达强度[24]。所得数值至少为3 次独立试验的平均值,数据以平均值±标准差表示。使用IBM SPSS Statistics 20.0 软件对数据进行单因素方差分析,并用Excel 作图,以P<0.05表示显著性差异。
2 结果与分析
2.1 不同表达载体及农杆菌菌株对苜蓿和本氏烟草叶片瞬时表达的影响
本研究在农杆菌侵染菌液浓度以及侵染后植株孵育时间(即侵染后植株生长时间,以下简写为dpi)均相同的情况下(侵染菌液浓度为OD600=0.8,侵染后孵育时间为7 d),比较了4 种载体/农杆菌组合对苜蓿叶片的瞬时转化效果的区别。如图1~2所示,re-vector/LBA4404侵染苜蓿叶片后,GFP明显表达;而在用non-re-vector/LBA4404侵染苜蓿叶后,没有检测到GFP 的表达。当用re-vector/EHA105 和non-re-vector/LBA4404 侵染苜蓿叶后,均没有检测到GFP 的表达。因此,以上观察显示,仅携带复制载体的LBA4404菌株能够在苜蓿叶中实现外源基因的瞬时表达。
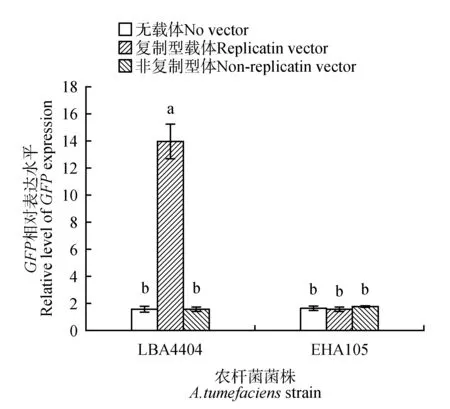
图1 不同表达载体及农杆菌菌株对苜蓿叶片GFP 表达量的影响不同小写字母代表在统计学上具有显著差异(P<0.05),下同。Fig.1 Different expression vectors and A. tumefaciens strains on expression level of GFP in alfalfa leaves Different letters on top of the bars indicated significant difference(sP<0.05),the same below.
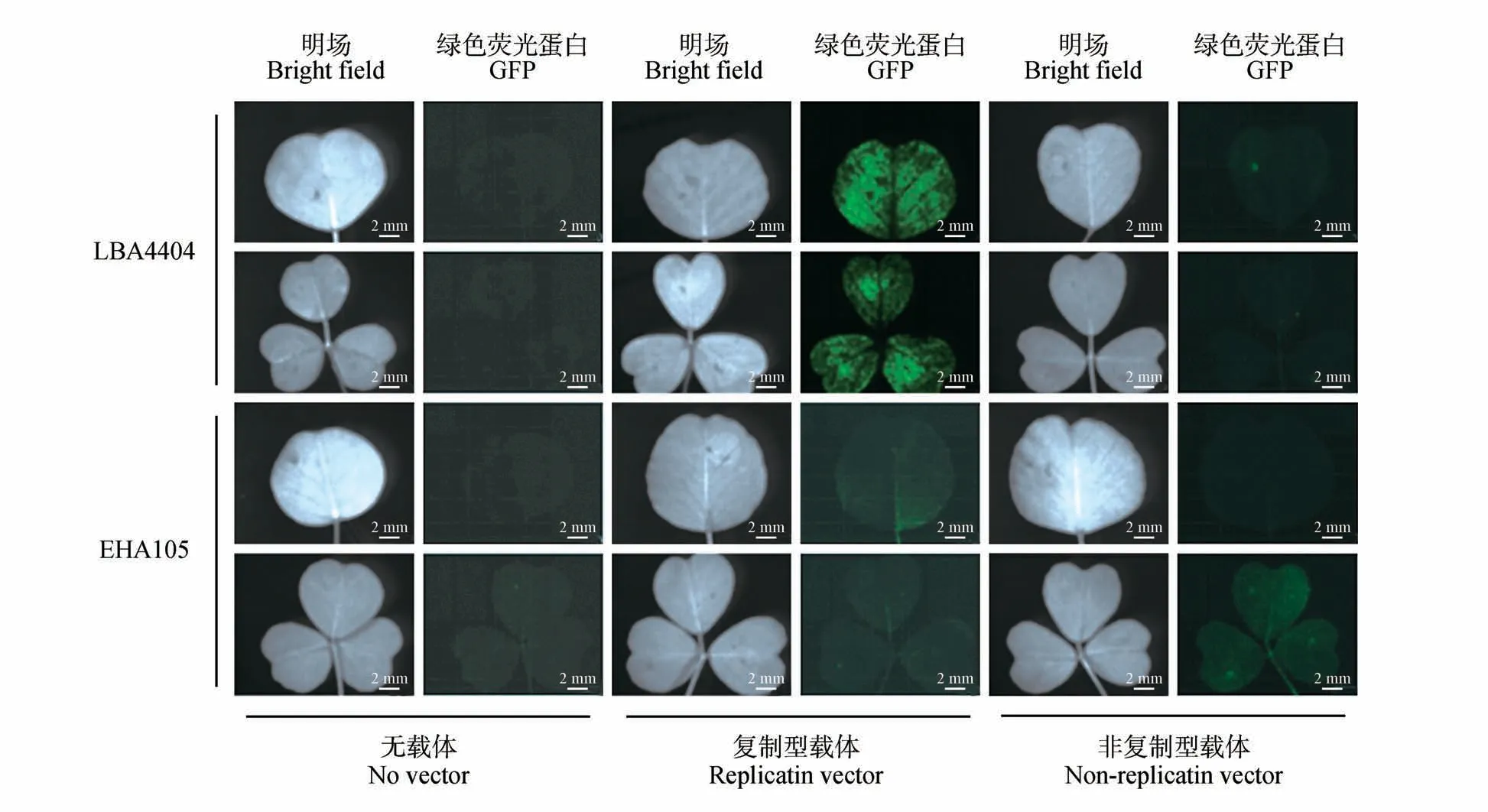
图2 苜蓿叶片中代表性GFP表达情况Fig.2 Representative expression of GFP in alfalfa leaves
以上在苜蓿中的结果提示了LBA4404 能够介导外源基因的转化,且需要较高的基因拷贝以形成有效的外源基因的表达。同时,以上观察也提示了另一问题,即这种现象可能也和苜蓿这种特定的植物种类有关。因此,将上述4 种的载体和菌株的组合对本氏烟草叶片进行了侵染,以判断所观察到的现象和植物种类的可能联系(图3~4)。结果表明,和苜蓿中的结果不同,4 种载体和菌株的组合均可在本氏烟草叶片形成GFP 的明显表达。进一步观察发现,在用LBA4404 侵染的本氏烟草叶片后,复制型载体介导的GFP 表达水平比非复制型载体高约5 倍;但在用EHA105 侵染的本氏烟草叶中,复制型和非复制型载体介导的GFP 表达水平无显著差异。以上结果表明,在瞬时转化过程中表达载体、农杆菌,以及植物之间存在着一定的依赖于种类的相互作用关系。
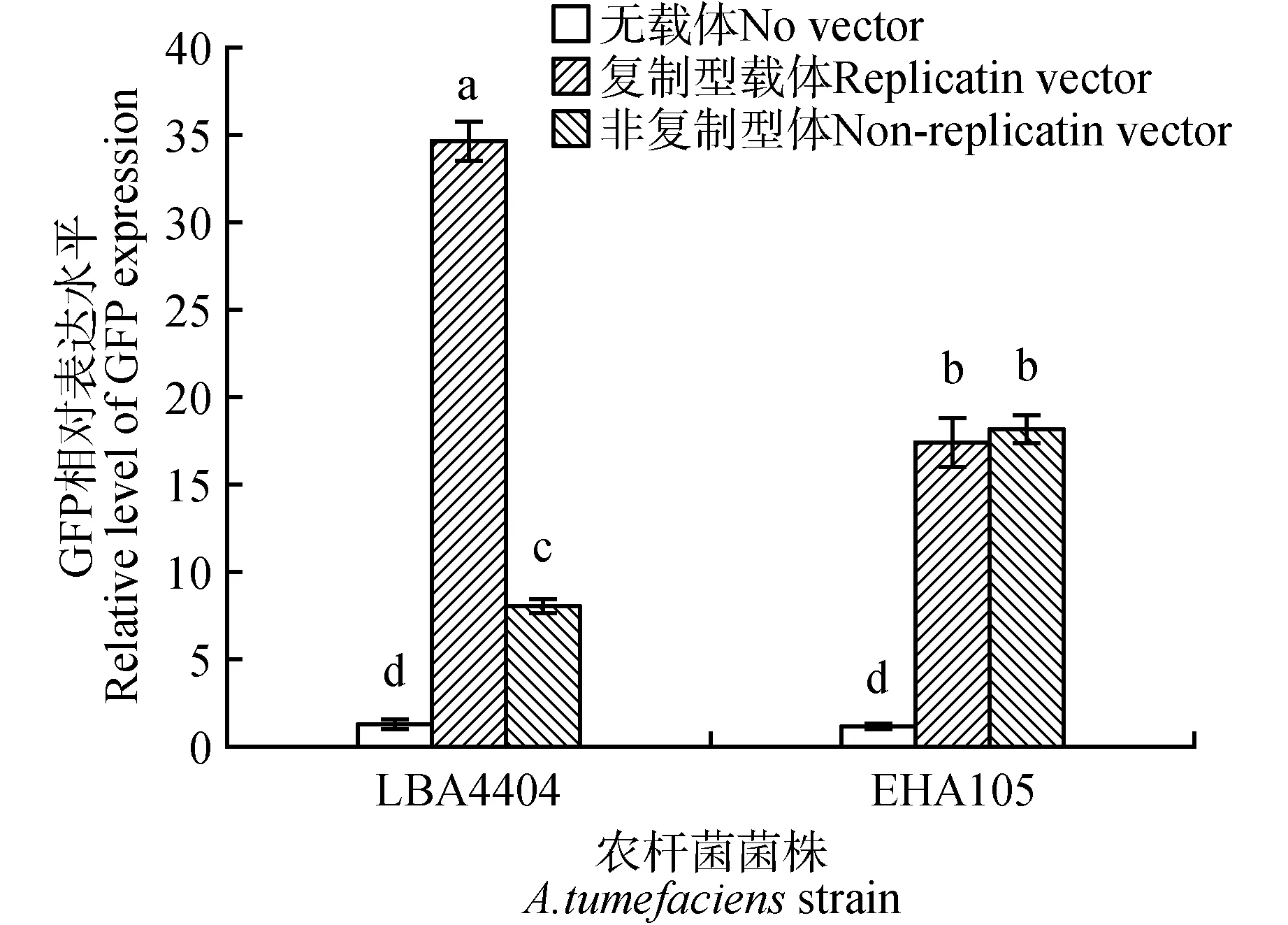
图3 不同表达载体及农杆菌菌株对本氏烟草叶片GFP表达量的影响Fig.3 Different expression vectors and A. tumefaciens strains on expression level of GFP in N. benthamiana leaves
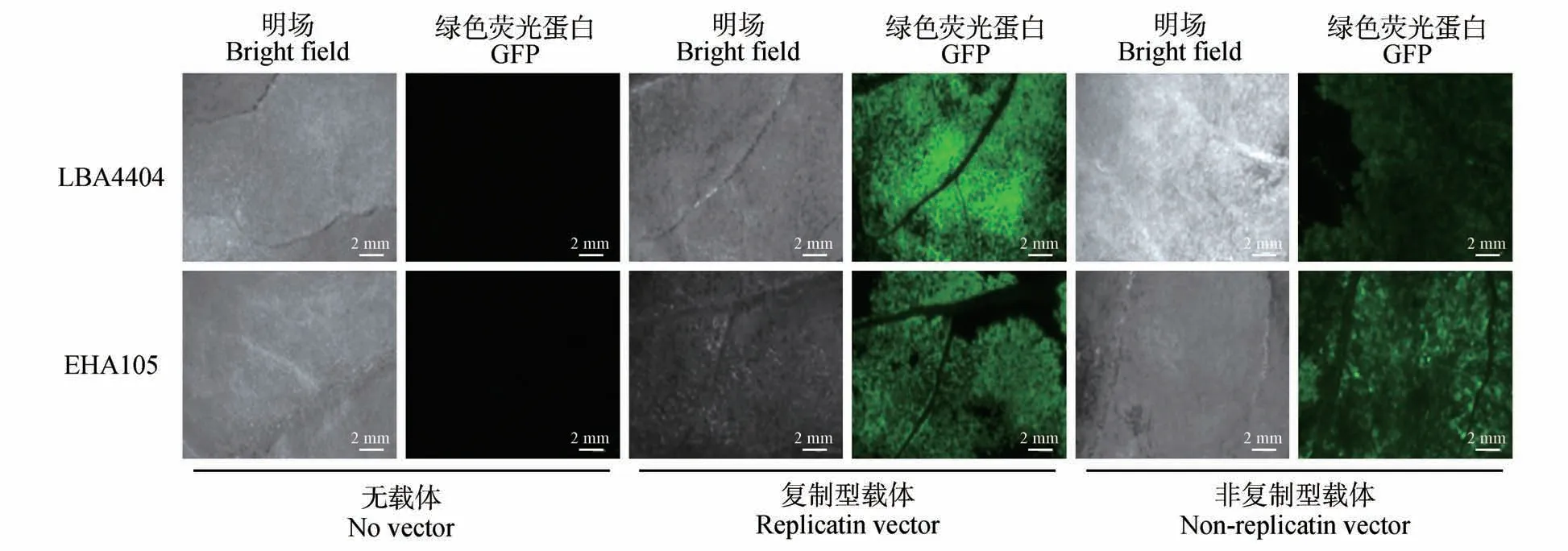
图4 本氏烟草叶片中代表性GFP表达情况Fig.4 Representative expression of GFP in N. benthamiana leaves
2.2 不同浓度的的re-vector/LBA4404 对苜蓿叶片瞬时表达的影响
如上研究结果所示,较之其他载体和菌株的组合,re-vector/LBA4404 能够在苜蓿叶中有效实现GFP的瞬时表达,本文进一步研究了不同浓度的revector/LBA4404菌悬液(OD600=0.2、0.4、0.6、0.8、1.0、1.2、1.5)对苜蓿叶中GFP瞬时表达的影响(图5~6)。结果显示,随着re-vector/LBA4404侵染菌液浓度的增加,GFP表达水平呈现出先增加后降低的趋势:revector/LBA4404菌悬液浓度在0.2到1.0(OD600)这一区间增加时,苜蓿叶片中GFP 的表达水平随着LBA4404浓度的增加而增加。re-vector/LBA4404浓度为1.2和1.5时,GFP表达较之LBA4404浓度为1.0时有一定程度的降低。综上,re-vector/LBA4404菌株在浓度为1.0时苜蓿叶片中GFP表达量最高。
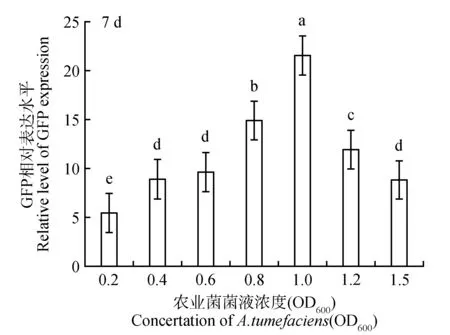
图5 不同re-vector/LBA4404 侵染菌液浓度对苜蓿叶片中GFP表达量的影响Fig.5 Different re-vector/LBA4404 infect bacteria liquid concentration on the GFP expression level in alfalfa leaves
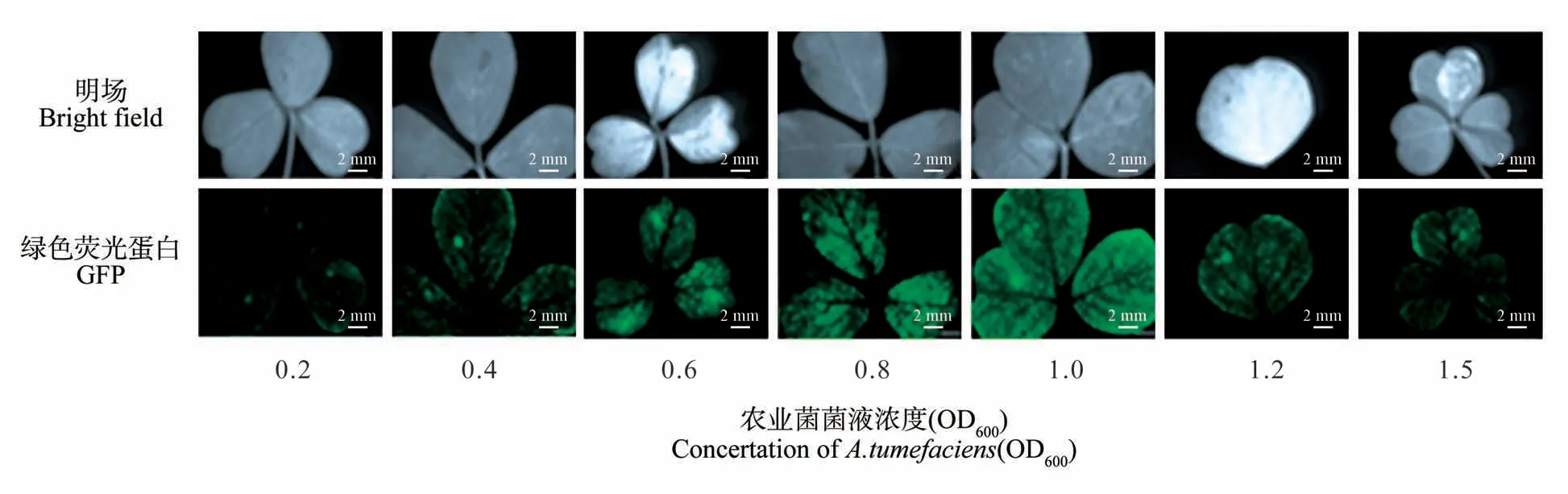
图6 苜蓿叶片中代表性GFP表达情况Fig.6 Representative expression of GFP expression level in alfalfa leaves
以本氏烟草叶片为对比发现(图7~8),re-vector/LBA4404菌悬液浓度为0.4(OD600)时,本氏烟草叶片中GFP 瞬时表达水平最高;LBA4404 浓度的进一步增加导致GFP 瞬时表达水平有所降低。以上对比结果表明,相较于本氏烟草叶片,在苜蓿中实现最高水平的瞬时转化需要更多的农杆菌。
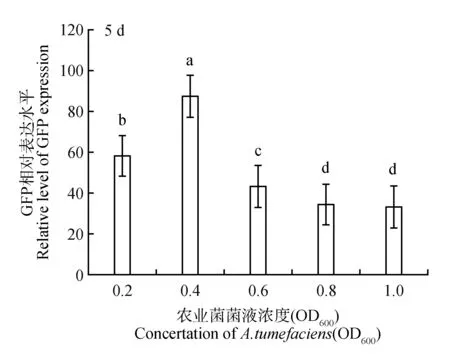
图7 不同re-vector/LBA4404 侵染菌液浓度对本氏烟草叶片GFP表达量的影响Fig.7 Different re-vector/LBA4404 infect bacteria liquid concentration on the GFP expression level in N.benthamiana leaves
2.3 携带复制型载体的LBA4404 菌株侵染后不同孵育时间对苜蓿叶片瞬时表达的影响
进一步研究了在re-vector/LBA4404 侵染后不同的dpi对苜蓿叶片瞬时表达的影响(见图9~10)。观察发现,在菌悬液浓度较低(包括OD600值为0.2、0.4、0.6)的情况下,dpi 从3 d 增加至5 d 能够小幅提升GFP 的表达水平;而dpi从3 d增加至7 d则大幅度提升了GFP 的表达水平,并在dpi 为7 d 时达到峰值;dpi 的进一步增加使得GFP 的表达水平较之峰值有所下降。菌悬液处于中度浓度(包括OD600值为0.8、1.0)时,dpi 从3 d 增加至5 d 即可大幅提升GFP 的表达水平,dpi 至第7 天时GFP 表达水平达到峰值;此后GFP 的表达水平随dpi增加有所降低。菌悬液处于较高浓度(包括OD600值为1.2、1.5)时,dpi 从3 d 增加至5 d 即使得GFP 表达水平并达到峰值,dpi 为7、9 d 时GFP 的表达水平均较峰值有所降低。
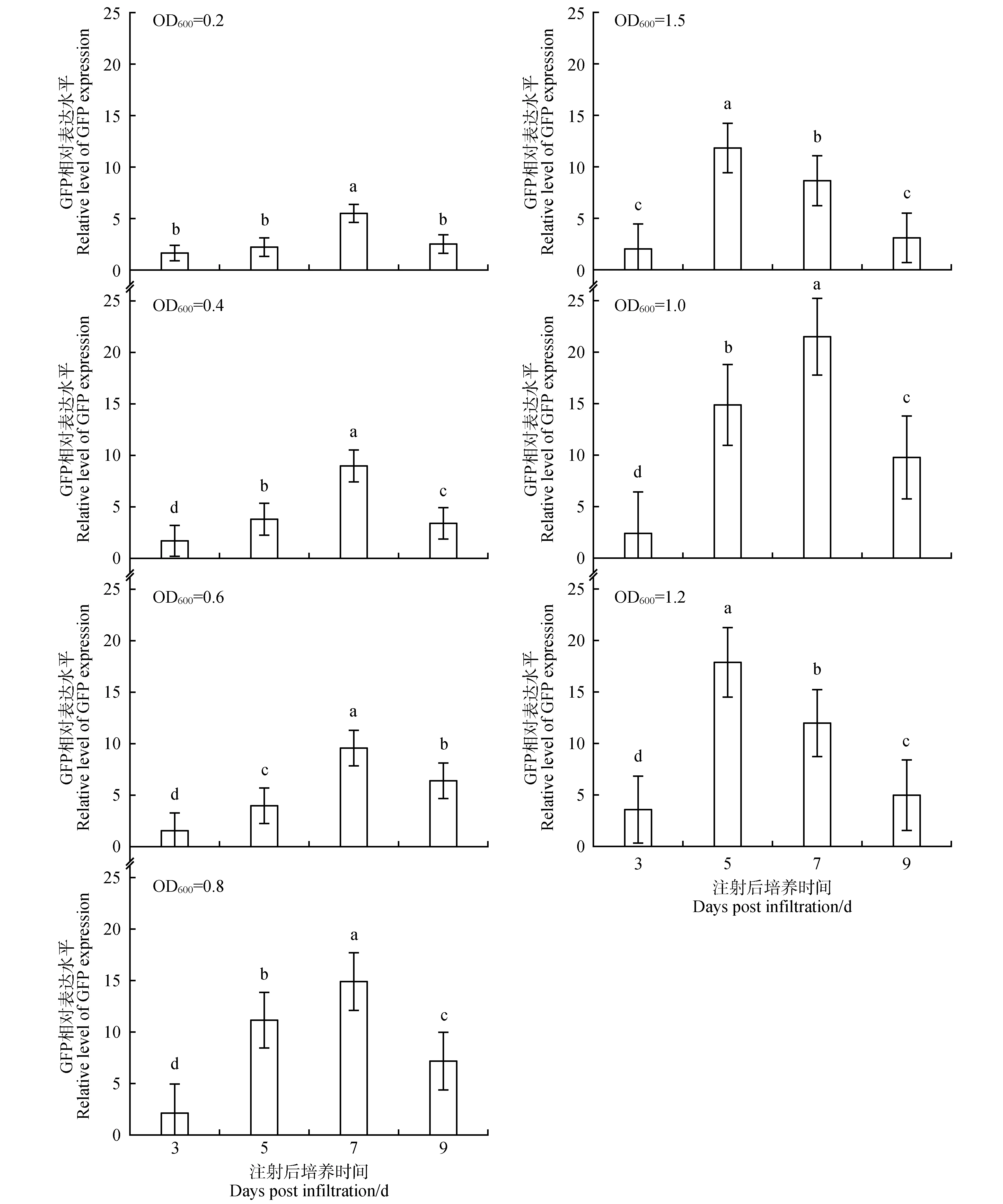
图9 农杆菌侵染后不同孵育时间对苜蓿叶片中GFP表达量的影响Fig.9 Effect of different incubation time on GFP expression in alfalfa leaves after infection with A. tumefaciens strains
通过比较不同dpi 对本氏烟草叶片GFP 表达的影响发现(见图11~12),在re-vector/LBA4404 菌悬液浓度为0.2、0.4、0.6 或1.0(OD600)时,dpi 为5 d时本氏烟草叶片中GFP 表达水平最高;LBA4404浓度为0.8(OD600)时,dpi 为7 d 时本氏烟草叶片中GFP 表达水平最高。综上观察表明,苜蓿和本氏烟草中dpi 为5 d 或7 d 时GFP 瞬时表达水平最高。
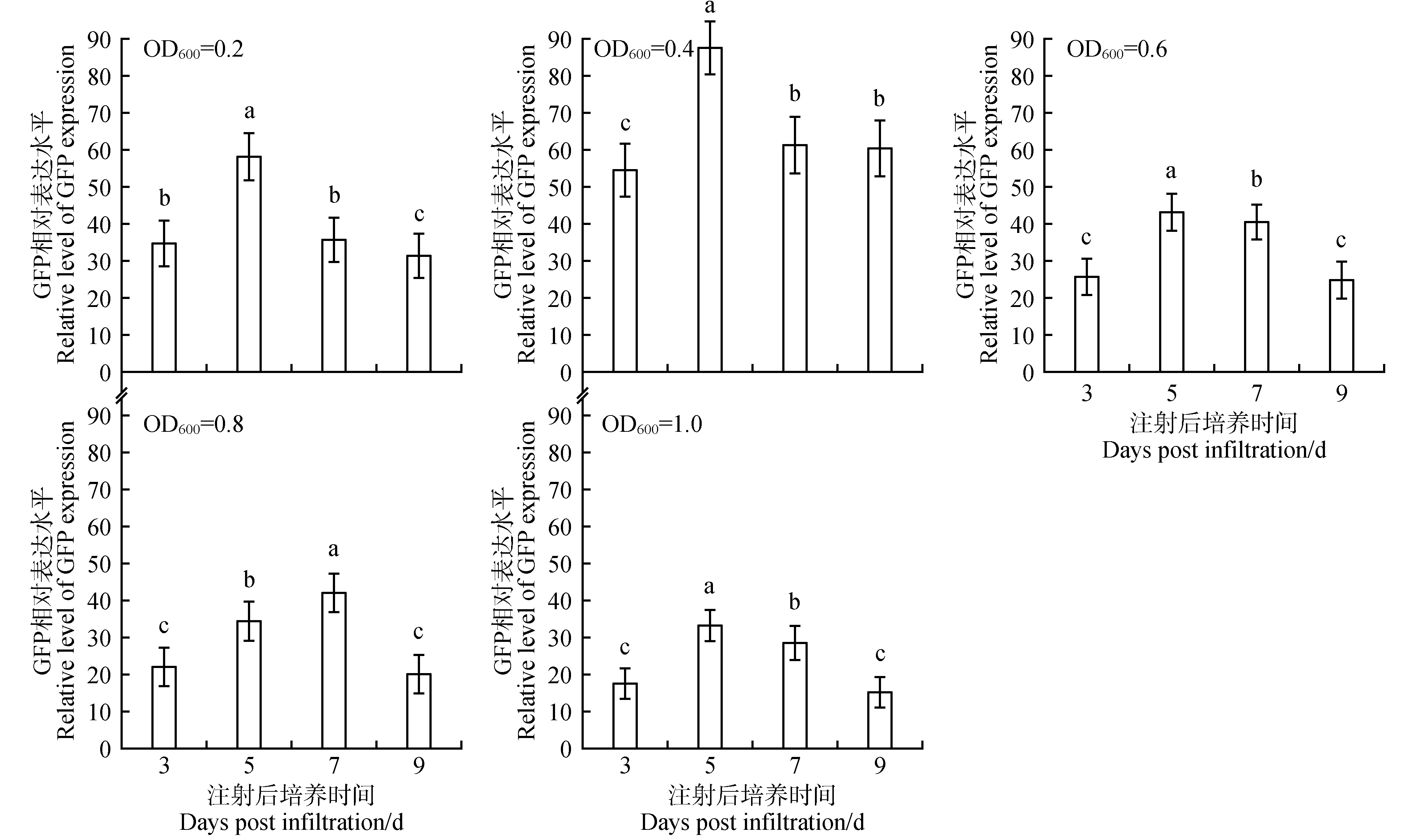
图11 农杆菌侵染后不同孵育时间对本氏烟草叶片中GFP表达量的影响Fig.11 Effect of different incubation time on GFP expression in N. benthamiana leaves after infection with A. umefaciens strains
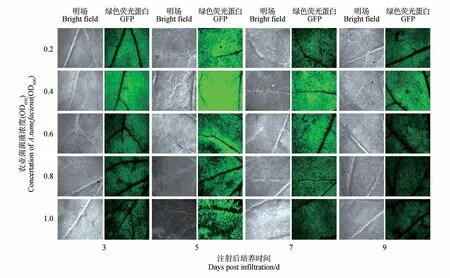
图12 农杆菌侵染后不同孵育时间下本氏烟草叶片中GFP表达情况Fig.12 GFP expression in N. benthamiana leaves after infection with A. tumefaciens strains at different incubation time
3 讨论
目前,在拟南芥和烟草等模式植物中利用瞬时表达揭示了诸多基因的功能和蛋白质的定位。如上文所述,苜蓿是重要的动物饲草,利用瞬时表达在苜蓿中进行基因转化不仅有助于快速揭示苜蓿中的一些理论问题,也可通过转入动物疾病相关的抗原或抗体编码基因来制备动物的口饲疫苗。但是,在苜蓿中进行瞬时表达的研究尚不多见;并且,如何有效提升苜蓿中外源基因的瞬时表达水平更是鲜有报道。
本研究利用携带非复制型和复制型载体的LBA4404和EHA105对苜蓿叶片进行侵染。其中,复制型表达载体是基于菜豆黄矮病毒构建的表达载体,其在植物细胞中可以通过滚环复制机制形成多拷贝。观察发现,仅仅携带复制型载体的LBA4404 能够在苜蓿中进行GFP 的瞬时表达(图1~2);这表明,在苜蓿中进行外源基因的瞬时表达需要特定的农杆菌,并且外源基因拷贝数的增加能够有效提高苜蓿中瞬时表达的水平。相似的是,较之其他载体和农杆菌的组合,在本氏烟草中re-vector/LBA4404 也介导了最高的GFP 表达量(图3~4),其表达水平高于苜蓿。以前的研究表明,不同的植物种类对于农杆菌的敏感性不同[25]。因此推测,苜蓿和本氏烟草对于LBA4404 农杆菌的敏感性的差异可能导致了成功侵染2 种植物的农杆菌的数量不同,并继而影响了后续的T-DNA的转运和外源基因的表达等。另外我们也注意到,尽管携带非复制型和复制型的EHA105无法在苜蓿中介导GFP 的表达,但其可以在本氏烟草中实现GFP 的表达,而且携带非复制型和复制型的EHA105 侵染本氏烟草叶后并没有出现GFP 表达水平的显著差异(图3~4)。一方面,这一观察提示了EHA105 可能无法有效地对苜蓿进行有效的侵染,进一步体现了苜蓿和本氏烟草对农杆菌的敏感性的差异;另一方面,这一观察也表明复制型载体能否通过增加外源基因拷贝数提高植物瞬时表达的水平和农杆菌的类型具有重要的联系,这种联系只是由于苜蓿对EHA105 的不敏感性而无法被体现。综上,这些观察反映了在瞬时转化过程中不同的表达载体、农杆菌,以及植物之间存在着特定的相互关系或协同作用,并最终决定了植物中外源基因是否能够有效表达以及表达水平。
由于携带复制型载体的LBA4404 在苜蓿中均形成了最高的外源基因表达量。因此,本文进一步研究了re-vector/LBA4404 菌悬液浓度和侵染后孵育时间对苜蓿中GFP 瞬时表达的影响。结果表明,随着re-vector/LBA4404 菌悬液浓度或侵染后孵育时间的增加,GFP 瞬时表达水平并未表现出简单的线性增加,而是呈先升后降的趋势;在菌悬液浓度为1.0(OD600)且dpi 为7 d 时苜蓿叶片中GFP表达水平最高(图5~6、9~10)。这种变化趋势的原因可能是多方面的。首先,农杆菌对于植物具有一定的毒性;这种毒性,尤其是农杆菌在植物中达到较高丰度时,能够抑制植物的光合、呼吸以及其他的代谢过程[26]。因为蛋白质的表达依赖光合、呼吸以及矿物质代谢为其提供底物和能量[27];因此,过高浓度的菌液或过长的侵染后孵育时间有可能通过抑制植物的代谢而减少了外源基因表达产物的积累水平。其次,表达载体中的一些必要组件的表达产物也可能对植物细胞产生影响。本研究使用的基于BeYDV 的复制型载体中,Rep和RepA 组件对于该载体的复制是必需的。但是,Rep和RepA的表达产物被发现能够诱导植物细胞死亡[28]。因此,过高浓度的菌液或过长的侵染后孵育时间也有可能导致了更多植物细胞的死亡,从而降低了植物表达蛋白的能力或导致了更多所表达的蛋白质被降解。因此,除了农杆菌和载体外,适当的菌液浓度和侵染后孵育时间也是获得外源基因最高水平的表达的关键因素。
我们也注意到,对于苜蓿和本氏烟草,最高的GFP 表达水平所对应的最佳菌悬液浓度或侵染后孵育时间均有所不同。在苜蓿中,LBA4404 菌悬液浓度为1.0(OD600)、dpi 为7 d 时苜蓿叶片中GFP表达水平最高;在本氏烟草中,当LBA4404菌株的浓度为0.4(OD600)且dpi 为5 d 时,GFP 瞬时表达水平最高(图5~12)。综合分析表明,苜蓿中实现最高的GFP 表达水平需要的最佳菌悬液浓度和最佳侵染后孵育时间均高于本氏烟草。
尽管较之通常使用的本氏烟草,苜蓿的瞬时转化看上去需要更多的农杆菌和更长的时间,但本氏烟草中含有的尼古丁等成瘾性物质限制了转基因本氏烟草在畜牧等领域的应用。作为重要的饲草,苜蓿不含成瘾性物质,且种植面积大。因此,在苜蓿中进行外源基因的遗传转化有助于提高苜蓿这种重要饲草的理论研究水平和应用价值。目前,大多数实验室采用体细胞胚胎发生及植株再生策略对苜蓿进行稳定遗传转化,即先对苜蓿器官或组织进行转化,再通过筛选、外植体培养、植株再生等过程获得稳定转化的苜蓿植株[3,10]。但该过程耗时费力,且转化效率受到器官(或组织)类型、品种等多种因素的制约;而且苜蓿的异交性质使所获得的转基因植株可能在田间出现所转入的基因丢失、漂移等问题,以及公众对转基因安全性的关注[17,29]。尽管无法形成能够稳定遗传的转基因苜蓿,本研究所用的瞬时表达技术避免了苜蓿稳定遗传转化中的筛选、再生等冗长过程,可以在1 周左右即实现目的基因的高效表达,且由于所转化的基因不存在可遗传性,也避免了基因丢失、漂移等问题。这特别适合短期内在苜蓿中进行目的基因功能的验证以及在苜蓿中快速合成利于养殖的重组蛋白(如动物疾病相关的抗原或抗体)。近期,吴艳菊等[30]利用真空侵染法在苜蓿发芽种子中进行了GUS(β-葡萄糖苷酸酶编码基因)的瞬时表达。但在理论和实际应用中,苜蓿的叶片通常为主要的研究对象及饲料的主要来源;而在苜蓿叶片中进行外源基因瞬时表达的研究尚鲜有报道。因此,本研究所得结果有助于建立高效的苜蓿叶片的瞬时表达体系,进一步为苜蓿的理论研究和应用等相关工作提供方法和参考。

