毛薯多糖提取分离工艺优化及抗氧化活性研究黎善铭
桂海霞 梅朋飞 刘鸿艳 陈世坚 吴文嫱
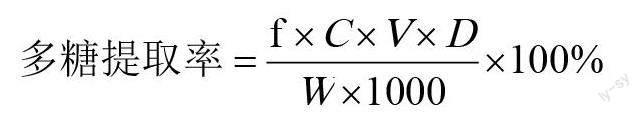




关键词:毛薯;多糖;热水提取法;工艺优化;抗氧化活性
中图分类号:Q539 文献标识码:A
毛薯(Dioscorea esculenta)又名甜薯、甘薯、小山药、蔓眉(黎语)等,为薯蓣科薯蓣属藤本植物。毛薯营养价值丰富,口感粉香微甜,具有健脾止泻,益肺滋肾,解毒敛疮的功效[1]。毛薯抗旱耐肥、少病虫害且长势强,是很好的耐旱作物[2],其全生育期很少施用农药,是健康的绿色食品,主要种植在海南、广东南部和广西南部,不耐低温。
研究发现,多种植物多糖具有清除自由基、增强抗氧化酶活性、抑制脂质过氧化、保护生物膜、延缓衰老的作用[3]。植物多糖还具有降血糖、免疫调节和抗肿瘤等生物活性[4-6]。毛薯富含植物多糖,且具有一定的药用价值。国外研究表明,毛薯具有抗氧化活性,调节胃肠道功能。其乙醇提取物具有一定的生物活性,和阿霉素联合使用能对抗乳腺癌细胞的发育周期[7]。长期食用毛薯能诱导肌肉性类固醇激素水平的增加,从而有助于降低2 型糖尿病的胰岛素抵抗[8]。
植物多糖提取的方法有热水提取法、超声波提法、酶水解法、醇沉法、微波提取和碱提法等[9-10]。不同提取方法获得的多糖提取率有差异,各有优缺点。何娇等[11]采用3,5-二硝基水杨酸测定了毛薯干粉总还原糖含量,高达71.08%。黎丹等[12]收集了80 份毛薯种质,采用醇沉法提取毛薯Ds96 粗多糖,其提取率为12.34%,研究还表明毛薯营养品质不低于河南铁棍山药。热水提取法提取成分完全,有利于后续从活性物质中精制多糖[13]。
目前,国内外尚未见对毛薯药用成分的研究分析,也未见对毛薯多糖开展药用价值的研究报道。为了研究毛薯多糖的功能以及进一步开发利用,迫切需要优化毛薯多糖提取工艺并获得较好活性的精制多糖。本研究拟采用热水提取法提取毛薯多糖,以温度、料液比、提取时间为影响因素,优化毛薯多糖提取的最佳工艺。经过进一步分离纯化后, 采用1,1-二苯基-2-三硝基苯肼(2,2-Diphenyl-1-picrylhydrazyl, DPPH)法、羟自由基法、超氧阴离子法和还原法检测毛薯多糖抗氧化还原活性。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 毛薯Ds96(广西博白)来自海南大学薯蓣种质资源圃,铁棍山药来自河南焦作。
5%苯酚水溶液,购自雷根生物试剂有限公司;浓硫酸,购自广州化学试剂厂;标准葡萄糖、Vc 溶液,购自上海源叶生物科技有限公司;DPPH,购自麦克林有限公司;二乙氨基乙基纤维素52(DEAE-52 纤维素)、葡聚糖凝胶G-100(SephadexG-100 葡聚糖),购自西宝生物科技有限公司;水杨酸、铁氰化钾、邻苯三酚、三氯乙酸等,均购自西陇化工有限公司。
1.1.2 仪器与设备 PL403 电子天平,购自梅特勒-托利多仪器(上海)有限公司;UV-1899PC紫外可见分光光度计,购自翱艺仪器(上海)有限公司;DHG-9013A 鼓风干燥箱,购自上海恒一科学仪器有限公司;HWS-26 电热恒温水浴锅,购自上海恒一科学仪器有限公司;LC-RE-52AA旋转蒸发仪,购自EYELA 公司;SCIENTZ-12N冷冻干燥机,购自宁波新芝生物科技有限公司。
1.2 方法
1.2.1 葡萄糖标准曲线绘制 准确称取105 ℃烘干至恒重的标准葡萄糖25 mg 定容于250 mL 容量瓶中,配制成1 mg/mL 的葡萄糖标准溶液。分别吸取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mL 的标准葡萄糖溶液于洁净试管中,用水补足至1 mL,加入5%苯酚水溶液1 mL 及浓硫酸5 mL,震荡均匀,静置25 min,于490 nm 处检测吸光度值,以蒸馏水为空白对照,以葡萄糖浓度为横坐标(x),以吸光度值为纵坐标(y),绘制葡萄糖标准曲线,计算回归方程。
1.2.2 实验材料处理 将资源圃中采挖的新鲜毛薯和山药块茎洗凈后削皮,切成2 mm 左右的薄片。于105 ℃高温杀青20 min,抑制酶促氧化,于60 ℃条件下烘干至恒重,粉碎机粉碎成粉末,过100 目筛,干燥密封保存。
1.2.3 毛薯多糖热水提取法单因素实验 称取干燥至恒重的毛薯块茎粉末100~500 mg,溶于5 mL的蒸馏水中,在一定温度的水浴中浸提,取出后以5000 r/min 离心15 min,取20 μL 上清液稀释至5 mL,取1 mL 进行多糖含量测定。对温度、料液比、提取时间进行单因素实验,实验重复3次。温度设置的处理水平为40、50、60、70、80 ℃;料液比设置的处理水平为1∶10、1∶15、1∶20、1∶25、1∶30;提取时间设置的处理水平为1、2、3、4、5 h。
1.2.4 毛薯多糖提取正交实验设计 在单因素研究的基础上进行正交实验设计,以提取温度(A)、料液比(B)、提取时间(C)为影响因素,以毛薯多糖吸光度值为评价指标,设计三因素三水平L(3)正交实验表,确定毛薯多糖的最佳提取工艺。根据毛薯多糖正交优化实验结果,再进行3次平行实验,以验证最佳工艺的提取条件。
1.2.5 毛薯粗多糖的分离纯化 (1)Sevag 法脱蛋白。取一定量的粗多糖溶液,向其中加入1/5体积的正丁醇-氯仿混合液(其体积比为1∶4),磁力搅拌器高速搅拌30 min 后,以8000 r/min 离心20 min,取上清,避免吸取中间蛋白层,重复2 次。
(2)透析。毛薯多糖经Sevag 法脱蛋白后,须旋蒸去除氯仿,将脱蛋白后的毛薯多糖溶液倒入透析袋中,倒入2/3 的位置后将透析袋的另一端用夹子夹住,将透析袋放入装有蒸馏水的容器中,水要没过整个透析袋。多糖溶液于蒸馏水中透析72 h,中间隔断换水,以除去单糖、低聚糖和盐等小分子杂质。
( 3 ) DEAE-52 纤维素柱层析( 4.5 cm×65 cm)。将经过脱蛋白、透析后的毛薯多糖溶液浓缩至20 mL,上DEAE-52 纤维素柱进行分级纯化,先以20 mL 蒸馏水洗脱,然后以0.1~0.5 mol/LNaCl 溶液进行线性洗脱,流速为2 mL/min,每2 min 收集1 管,于490 nm 处以苯酚-硫酸法测定吸光度,绘制洗脱曲线,横坐标(x)为接收管数,纵坐标(y)为吸光度。
(4)SephadexG-100 凝胶柱层析(4.5 cm×65 cm)。经DEAE-52 纤维素柱纯化后的毛薯多糖溶液浓缩至50 mL。加20 mL 毛薯多糖浓缩液到预先用0.1 mol/L NaCl 溶液平衡的SephadexG-100 凝胶柱上,用0.1 mol/L NaCl 溶液进行洗脱,流速为1 mL/min,每5 min 收集1 管。在490 nm处以苯酚-硫酸法测定吸光度,绘制洗脱曲线,横坐标(x)为接收管数,纵坐标(y)为吸光度。
(5)紫外吸收光谱法。将凝胶柱层析后的毛薯多糖溶液的浓度调整为1 mg/mL 后, 于200~600 nm 范围内进行全波长扫描,观察在260、280 nm 波长附近是否有特征吸收峰。
1.2.6 毛薯多糖抗氧化还原活性研究 以Vc 溶液作为阳性对照,以山药全粉多糖作为阴性对照,测定毛薯精多糖、毛薯表皮多糖、毛薯全粉多糖的DPPH 自由基清除能力、羟自由基(·OH)清除作用、超氧阴离子(·O)的清除作用和还原能力并进行比较。
(1)DPPH 自由基清除能力测定。准确称取4 mg DPPH,用无水乙醇溶解定容到100 mL 的棕色容量瓶中,制得0.1 mmol/L DPPH 自由基溶液。移取浓度分别为1、2、3、4、5 mg/mL 毛薯精多糖、山药全粉多糖、毛薯表皮多糖、毛薯全粉多糖、Vc 溶液2~10 mL 的离心管中,并分别加2 mLDPPH 溶液,混匀30 min 后于517 nm 测定吸光度值Ai;用无水乙醇代替DPPH 自由基溶液测定吸光度值Aj,空白对照用无水乙醇代替样品溶液测定吸光度值A0,以上各离心管均做3 组平行试验。按下述公式计算多糖对DPPH 自由基的清除率:
DPPH 清除率=[1–(A–A)/A]×100%
(2)羟自由基(·OH)清除作用。分别配置不同浓度的毛薯精多糖、山药全粉多糖、毛薯表皮多糖、毛薯全粉多糖、Vc 溶液,加入2 mL 浓度分别为1、2、3、4、5 mg/mL 的样品溶液,然后分别加入2 mL 的FeSO(9 mmol/L)和H2O2溶液(9 mmol/L)混匀后静置10 min,再加入2 mL的水杨酸(9 mmol/L)混匀,静置30 min 于510 nm测定吸光度值A。用蒸馏水代替水杨酸测定吸光度值A,空白对照用蒸馏水代替样品溶液测定吸光度值A,按下述公式计算多糖溶液对羟自由基的清除率:
羟自由基清除率=1–[(A–A)/A]×100%
(3)超氧阴离子(·O)的清除作用。分别配置不同浓度的毛薯精多糖、山药全粉多糖、毛薯表皮多糖、毛薯全粉多糖、Vc 溶液,加入2 mL浓度为1、2、3、4、5 mg/mL 的样品溶液于10 mL离心管中,再分别加入4.5 mL 的 Tris-HCl 缓冲液(1 mol/L,pH 8.2),于50 ℃水浴30 min,加入1 mL 邻苯三酚(2 mmol/L)反应10 min,于325 nm 处测定吸光度值A,用蒸馏水代替邻苯三酚测定吸光度值A,空白对照用蒸馏水代替样品溶液测定吸光度值A,按下述公式計算多糖溶液对超氧阴离子的清除率:
超氧阴离子清除率=[1–(A–A)/A]×100%
(4)还原能力测定。分别配置不同浓度的毛薯精多糖、山药全粉多糖、毛薯表皮多糖、毛薯全粉多糖、Vc 溶液,移取浓度分别为1、2、3、4、5 mg/mL 1 mL 的样品溶液分别置于10 mL 离心管中,依次加入2.5 mL 的磷酸盐缓冲溶液(0.2 mol/L,pH 7.4)、2.5 mL 铁氰化钾(1% wt),摇匀后置于50 ℃水浴中30 min,流水冷却,再加入2.5 mL 的三氯乙酸溶液(10% wt)摇匀,5000 r/min 离心10 min。移取2.5 mL 上清液于另一10 mL 离心管中,依次加入2.5 mL 去离子水、0.5 mL 三氯化铁溶液(0.1% wt)摇匀,静置10 min于700 nm 处测定样品的吸光度值。吸光度值越高,表明其还原能力越强。
1.2.7 多糖提取率计算方法 参照高英春[14]的计算方法。
式中,f:换算因子0.9;C:测得样品的葡萄糖浓度(mg/mL);V:测定液总量(mL);D:稀释倍数;W:样品质量(g)。
1.3 数据处理
运用SPSS 20.0 软件进行差异显著性分析,正交实验采用方差分析,组内比较采用t 检验。
2 结果与分析
2.1 葡萄糖标准曲线
以葡萄糖浓度(mg/mL)为x 轴,以吸光度值为y 轴,建立葡萄糖标准曲线,得到回归方程y=0.9746x+0.0065 , R=0.9996 , 在葡萄糖浓度0~1 mg/mL 范围内,线性关系良好。
2.2 毛薯多糖热水提取法的实验结果
2.2.1 单因素实验 控制其他条件不变的前提下,分别对温度、料液比和提取时间进行热水提取法单因素实验。由图1 可知,当温度在40~70 ℃区间时,随着温度的升高,多糖提取率逐渐升高,当温度达到70 ℃时,多糖提取率最高,为1.29%;当温度达到80 ℃时,多糖提取率骤然降低,毛薯粉发生热凝固,无法成为混悬液,多糖无法析出。当料液比在1∶10~1∶30 区间时,1∶10 处理获得的多糖提取率最高,为2.38%;随着料液比的增加,多糖提取率逐渐降低。当时间在1~5 h 区间时,2 h 处理获得的多糖提取率最高,为3.29%。
2.2.2 正交实验 根据毛薯多糖热水提取法单因素实验结果,设置了三因素三水平L(3)正交实验的处理,其具体设计方案见表1。由表2 可知,毛薯多糖的提取率最高达1.94%,最佳提取工艺条件为ABC,即温度为70 ℃,料液比为1∶15,时间为3 h。在极差分析中,温度、料液比和时间的R 值分别为0.52、0.07、0.20,温度的R 值最大,影响毛薯多糖提取的因素依次为温度>时间>料液比。方差分析结果表明,温度对热水提取毛薯多糖的影响差异显著(P<0.05),料液比和时间的影响均未达到差异显著性水平(P>0.05)。
2.2.3 毛薯多糖提取工艺验证 对毛薯多糖优化工艺进行验证,3 次平行实验多糖提取率分别为1.97%、1.91%、1.93%,平均值为1.94%,相对标准偏差为1.60%,所建立的毛薯多糖优化提取工艺稳定可行。
2.3 毛薯粗多糖的分离纯化
2.3.1 DEAE-52 纤维素柱层析 通过DEAE-52纤维素柱,经苯酚-硫酸法检测得到1 个峰形明显的洗脱峰,并无其他峰,表明毛薯多糖是一种中性多糖(图2)。收集30~60 管的毛薯多糖洗脱液,采用旋转蒸发仪浓缩,通过冷冻干燥器进行冻干,获得纯化的毛薯多糖,可用于后续实验。
2.3.2 SephadexG-100 葡聚糖凝胶柱层析 通过SephadexG-100 葡聚糖凝胶柱层析柱,经苯酚-硫酸法检测得到1 个均一的洗脱峰,且峰形基本对称,表明纯化后获得的毛薯多糖纯度均一(图3)。收集38~70 管的毛薯多糖洗脱液,采用旋转蒸发仪浓缩,通过冷冻干燥器进行冻干,获得毛薯精多糖。
2.3.3 紫外全波长扫描 1 mg/mL 的毛薯精多糖溶液在180~600 nm 紫外扫描显示为末端吸收,在260 nm 和280 nm 处无明显的紫外吸收,曲线平滑,表明毛薯精多糖中无蛋白、核酸及多肽等杂质(图4)。
2.4 毛薯多糖抗氧化还原活性结果
2.4.1 DPPH 自由基清除能力 由图5 可知,Vc浓度为1~5 mg/mL 时,DPPH 自由基清除率基本维持在90% 以上, 山药全粉多糖清除率为30%~50%,且有浓度梯度效应。毛薯表皮多糖的清除能力强于山药全粉多糖、毛薯全粉多糖和毛薯精多糖,清除率为40%~70%。而毛薯全粉多糖和毛薯精多糖的清除能力较弱,清除率在10%左右。毛薯精多糖清除率最高为15.33%,清除率随浓度的升高逐渐下降。毛薯表皮多糖的DPPH 清除能力高于山药全粉多糖、毛薯全粉多糖和毛薯精多糖。
2.4.2 羟自由基清除能力 由图6 可知,Vc 浓度为1~5 mg/mL 时,清除能力随着浓度的升高而升高,清除率最高可达到99.01%。山药全粉多糖、毛薯表皮多糖、毛薯全粉多糖和毛薯精多糖均具有浓度梯度效应,在浓度为5 mg/mL 时,清除率均最高,分别为48.08%、44.66%、33.06%和34.74%。毛薯表皮多糖和山药全粉多糖的羟自由基的清除能力高于毛薯全粉多糖和毛薯精多糖。
2.4.3 超氧阴离子自由基清除能力 由图7 可知,Vc 的超氧阴离子清除能力较高,清除率基本维持在80%以上。毛薯精多糖在1 mg/mL 时,清除率为67.35%。山药全粉多糖、毛薯表皮多糖、毛薯全粉多糖和毛薯精多糖的清除能力随着多糖浓度的升高而逐渐降低, 山药全粉多糖在5 mg/mL 时,清除率低至4.12%。毛薯表皮多糖的清除能力降低速率仅次于山药全粉多糖,在5 mg/mL 时,清除率为18.97%,而毛薯全粉多糖和毛薯精多糖的清除能力降低速率较缓, 在5 mg/mL 时,清除率分别为57.20%和48.53%。毛薯全粉多糖的超氧阴离子清除能力高于毛薯精多糖、毛薯表皮多糖和山药全粉多糖。
2.4.4 还原能力 由图8可知,Vc浓度为1~5 mg/mL时, 还原力基本维持在2.5 以上。在浓度为1~5 mg/mL 时,山药全粉多糖和毛薯表皮多糖的还原能力随着多糖浓度的升高而增强,具有梯度浓度效应,在5 mg/mL 时还原力分别为0.98 和0.77。而毛薯全粉多糖和毛薯精多糖的还原能力较弱,还原力为0.1~0.2;毛薯精多糖浓度为1~5 mg/mL 时,还原能力最高为0.17。山药全粉多糖的还原能力高于毛薯表皮多糖、毛薯全粉多糖和毛薯精多糖。
3 讨论
3.1 毛薯多糖的提取工艺优化
本研究采用热水提取法对毛薯多糖提取工艺进行优化。根据单因素和正交实验的结果表明,热水提取法提取毛薯多糖的提取率最高为1.94%,其最佳工艺条件为:温度70 ℃,料液比1∶15,提取时间3 h。目前尚未见毛薯多糖提取工艺优化的报道,黎丹等[12]采用醇沉法获得的毛薯粗多糖提取率高达12.34%,表明毛薯中不少种质多糖的含量不低于铁棍山药。在薯蓣科薯蓣属近缘物种多糖提取的研究中,孙峰[15]采用热水提取法在料液比1∶9、温度50 ℃、提取时间2.5 h和75%乙醇沉淀的处理时,鲜山药多糖的提取率为0.2449%。王珊珊[16]采用水提醇沉法提取铁棍山药多糖,在料液比1∶9、温度71 ℃、提取时间2.3 h 和pH 为7.16 时,其多糖提取率为9.57%。邓寒霜[17]采用热水提取法提取穿山龙薯蓣多糖,在料液比1∶25、温度95 ℃和提取时间106 min的处理时,其多糖提取率为2.115%。温度过高、过碱会影响多糖的抗氧化活性[18]。智文莉[19]采用超声-微波法在料液比1∶10、提取时间360 s 和功率380 W 时,铁棍山药多糖提取率仅为1.39%。可见,不同的提取方法获得的提取率不同,醇沉法的提取率普遍高于热水提取法,这与醇沉法多次离心收集有关。与薯蓣属其他近缘物种相比,经本研究条件优化后获得的毛薯多糖提取率较好,可用于后续开发。
3.2 毛薯多糖的抗氧化活性
通过对经分离纯化得到的纯度均一中性多糖的毛薯多糖进一步研究发现,毛薯精多糖DPPH法、羟自由基法、超氧阴离子法和还原法的抗氧化活性分别为15.33%、34.74%、67.35%和0.17。毛薯多糖抗氧化活性尚未见报道,有学者对薯蓣属其他物种开展了多糖的氧化还原功能研究。陈树俊等[20]比较不同浓度的佛手山药中性多糖的抗氧化活性中发现,在浓度为2.0 mg/mL 时,其DPPH 自由基、羟基自由基、超氧陰离子自由基的清除率分别为35.6%、38.3%和31.9%。毛薯精多糖的超氧阴离子清除率优于佛手山药多糖。单承莺等[21]采用毛胶薯蓣(D. subcalva)多糖检测双氧水、超氧阴离子自由基、羟基自由基的清除活力,结果表明毛胶薯蓣具有体外抗氧化活性,抗氧化活性大小和浓度与毛薯多糖的羟自由基和超氧阴离子具有量效关系。王珊珊[16]提取铁棍山药多糖进行抗氧化活性检测,结果表明以常用抗氧化剂VE 为阳性对照,在300 μg/mL 时,其DPPH、羟自由基和超氧阴离子的清除率分别为81%、88%和68%。而本研究提取的铁棍山药全粉多糖的最高清除率分别为57.75%、48.08%和77.96%,其抗氧化活性的差异可能是由于提取条件中pH 的不同而导致,也可能是多糖的单糖组成有差异。本研究结果表明铁棍山药全粉水提多糖抗氧化还原活性数值均优于经过分离纯化后的毛薯精多糖。
毛薯精多糖和毛薯全粉多糖的抗氧化还原活性基本一致,而毛薯表皮多糖的抗氧化还原活性除了羟自由基清除活性外,均比毛薯精多糖清除率高,可能是毛薯表皮提取物未纯化彻底,表皮中可能含有单宁、植酸和其他一些抗氧化活性物质[22]。毛薯精多糖在多次除杂和纯化后可能丢失了某些活性物质,或者毛薯的抗氧化还原活性物质存在于表皮中,有待进一步研究证实。

