新型青枯雷尔氏菌来源双核含铜酪氨酸氧化酶的异源表达及生化性质鉴定
崔鹏鹏,单瑞达,王怡淑,b,李 霞,b,孙登岳,b*,曾志雄*
齐鲁工业大学(山东省科学院) a.生物工程学部;b.生物基材料与绿色造纸国家重点实验室,山东 济南 250353
帕金森病是一种神经系统性疾病,其主要发病原因为患者大脑中的黑质和纹状体神经细胞受到损伤[1-2],从而损坏多巴胺神经元,引起多巴胺生成不足[3]。由于帕金森病无法根治,目前利用药物缓解病症成为常见的治疗手段。帕金森病多发于中老年群体,随着人类进入老龄化社会,帕金森病发病率逐年增多[4-5]。对于治疗帕金森病新药的研制和药品原料的合成尤为重要。
左旋多巴(levodopa,L-DOPA)是多巴胺的前体物质,具有多巴胺不具备的功能——通过血脑屏障[6-7],L-DOPA进入脑细胞后,经体内脱羧酶的催化生成多巴胺,而起到治疗帕金森病的作用[8-9]。目前临床上常用的药物为左旋多巴或者以左旋多巴为主要成分的药物,如美多芭[10]、帕金宁[11]、息宁[12]等。L-DOPA对于治疗弱视、非药源性震颤麻痹综合征[13]等疾病有一定作用。此外,还具有辅助治疗精神分裂症[14]和抗衰老的功效。
目前,L-DOPA的合成方法主要有植物提取法、化学合成法和生物合成法。藜豆和猫豆[15-16]等含有L-DOPA的植物是植物提取左旋多巴的重要原料,但由于原料少、产量低、工艺复杂[17]等原因植物提取法逐渐被淘汰。化学合成法是以乙内酰脲和香草醛为原料,利用不对称合成手段,需要8步化学反应[18],但反应中使用大量金属催化剂,对环境有污染,产物中含有有毒的D-DOPA[19],不利于工业生产。随着生物技术的进步,利用生物合成法生产L-DOPA受到越来越多的关注。目前生物合成法常利用的酶有3种[20]:转氨酶(transaminase)、酪氨酸酚裂解酶(tyrosinephenoll-yase,TPL)和酪氨酸酶(tyrosinase)。由于转氨酶法利用含有毒性的前体物质和操作步骤繁琐[21],很少用于商业生产;酪氨酸酚裂解酶法中的底物邻苯二酚对酶的活性有抑制作用;因此,利用酪氨酸酶生物法合成L-DOPA成为最适宜的选择,其在酶法催化合成L-DOPA方面具有重要的价值。
报道的酪氨酸氧化酶(tyrosinase,TYR)是一种双核含铜的氧化还原酶[22],它能催化酪氨酸生成L-DOPA,催化反应式如图1所示[23]。Lunt[24]等在嗜酪氨酸微螺菌(Microspiratyrasinatica)中首次发现能催化合成L-DOPA 的酪氨酸酶;Krishnaveni[25]等在顶头孢霉(Acremoniumrutilum)也发现了酪氨酸酶,用于合成L-DOPA。由于该酶同时具有二酚酶活性能继续催化L-DOPA氧化生成多巴醌,为抑制二酚酶活性需要添加还原剂,但不利于工业生产。因此寻找新型底物专一性的酪氨酸酶用于L-DOPA的生物催化合成具有重要意义。
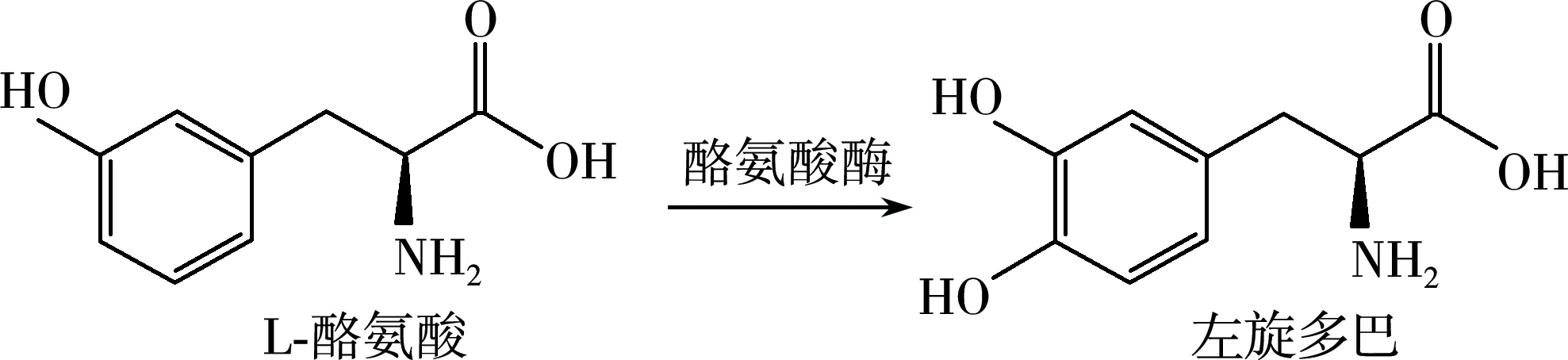
图1 由酪氨酸合成L-DOPA的催化反应式
实验室前期工作发现了一种来源于青枯雷尔氏菌(Ralstoniasolanacearum)的新的酪氨酸酶基因TYR,本研究对该来源的RsTYR蛋白进行异源表达、纯化,研究其酶学性质,并确定了其酶学性质参数,通过同源序列对比和系统发育树对RsTYR的家族属性进行了分析,确定了催化活性的关键位点。这对以后该酶的改造及应用提供了一定基础。经过高效液相色谱法(HPLC)分析,表明RsTYR能特异性的将酪氨酸氧化为L-DOPA且没有副产物。因此,该酶可直接利用L-酪氨酸作为底物一步催化合成L-DOPA,未来有望于在降低治疗帕金森病药物的成本方面发挥作用。
1 材料与方法
1.1 材料与仪器
大肠杆菌BL21(DE3)、DH5α菌株等(博迈德生物公司);酵母提取物、胰蛋白胨(OXOID公司);NaCl等常规试剂(国药集团化学试剂有限公司);异丙基β-D-1-硫代半乳糖苷(IPTG)(北京博奥拓达科技有限公司);质粒提取试剂盒(Omega公司);蛋白Marker(北京聚合美生物科技有限公司);Ni-NTA Agarose亲和树脂、凝胶过滤色谱柱和离子交换色谱柱(美国GE公司);DNA聚合酶 Prime STAR Max、限制性核酸内切酶BamHⅠ、HindⅢ 和连接酶 Solution Ⅰ(宝日医生物技术有限公司);超滤管(Millipore公司)。
超声波破碎仪(美国SONICS公司);Analytikjena凝胶成像系统(德国耶拿公司);高速冷冻离心机(日本日立公司);KTA pure(美国GE公司);SIL-20A高效液相色谱仪(日本岛津公司);电泳系统(美国Bio-Rad公司);PCR仪和BioPhotometer plus(德国Eppendorf公司)。
1.2 方法
1.2.1 RsTYR表达载体的构建
在金唯智公司合成RsTYR蛋白的基因序列,以合成的基因作为模板设计PCR引物Primer F:CGCGGATCC ATGGTCGTG CGCCGCAC;Primer R:CCCAAGCTT TTAAATCAC GGCCACTTC AATGC。目的基因经过PCR扩增得到。在需扩增目的基因的5'端和3'端分别引入限制性核酸内切酶BamHⅠ和HindⅢ的酶切位点。PCR体系设置为25 μL。PCR程序流程:98 ℃预变性30 s;98 ℃变性10 s;54 ℃退火15 s;72 ℃延伸5 s;30个循环;72 ℃再延伸10 min。扩增的目的片段和载体pET-28a由限制性内切酶BamHⅠ和HindⅢ进行双酶切,对酶切产物纯化回收,用Solution Ⅰ 16 ℃连接30 min。将构建好的质粒用热激转化法转化至E.coliDH5α感受态细胞中,挑取转化子,进行双酶切验证,最后把酶切验证正确的样品送至测序公司进行验证。
1.2.2 蛋白纯化条件及步骤
通过热激转化法将测序正确的重组质粒转化到E.coliBL21(DE3)感受态细胞中培养过夜,挑取转化子转接到5 mL试管LB液体培养基中进行培养,再将培养液转接到1 L摇瓶LB液体培养基中培养,待OD值达到0.6~0.8后,在培养液中加入IPTG作为诱导剂诱导蛋白过夜表达。4 000 r/min,4 ℃离心15 min收菌。由于RsTYR蛋白在两端含有His标签,采用镍亲和层析法对蛋白质进行初步纯化。将收集的菌体沉淀于裂解缓冲液中悬浮。加入50 mg/mL的溶菌酶,1 mol/L的PMSF和β-巯基乙醇混匀30 min。随后用超声波破碎仪在低温条件下破碎细胞。破碎结束之后,13 000 r/min、4 ℃离心1 h。把离心得到的上清液与预先平衡好的Ni树脂在4 ℃条件下结合1 h,先用洗脱缓冲液1(裂解缓冲液)洗脱树脂,再用洗脱缓冲液2(20 mol/L咪唑)洗脱树脂,最后在4 ℃下用10 mL Elution buffer(250 mol/L咪唑)洗脱,将含有目的蛋白的洗脱组分混合在一起,在4 ℃下通过超滤管进行浓缩,并通过Source Q离子柱和Superdex 75凝胶过滤柱进一步纯化。
1.2.3 RsTYR的酶活性测定和催化产物分析
采用岛津SIL-20A高效液相色谱仪对催化产物经行分析。500 μL反应体系:Tris-HCl缓冲液(pH 7.5)100 mol/L,酪氨酸底物2 mol/L,酶质量浓度0.5 mg/mL。将配制好的反应体系于室温反应90 min,反应结束后用沸水浴灭活5 min终止反应。将催化反应后的反应液12 000 r/min离心10 min,用0.22 μm滤膜过滤上清液,进行色谱分析。设定3组平行试验。各项参数:C18色谱柱(5 μm,4.6 mm×250 mm,Hanbon,China);流动相为体积分数2%乙酸溶液-甲醇(90∶10);流速为0.5 mL/min;检测波长为280 nm;柱温为室温;进样量为40 μL。通过标准曲线对产物进行定量,以产物L-DOPA的总量来计算酶活。
1.2.4 RsTYR酶学性质测定
(1)RsTYR蛋白的最适反应温度及其稳定性。测定该酶的最适反应温度,选择20~60 ℃的温度条件,在100 mol/L Tris-HCl缓冲液(pH 7.5)条件下进行测定。
测定酶的温度稳定性,在20~55 ℃条件下将酶分别保温(0.5、1、2 h),然后冰浴10 min,测定残余酶活性,以4 ℃温度下的酶活性为100%。
(2)RsTYR蛋白的最适反应pH及其稳定性。测定pH对酶活力的影响,选择pH 5.5~10.0 (100 mmol/L)的缓冲液。PBS缓冲液(pH 5.5~8.5),Tris-HCl 缓冲液(pH 6.0~9.0),HEPES缓冲液(pH 6.5~9.5),MES缓冲液(pH 5.5~6.5),Gly缓冲液(pH 8.5~10.0)。通过测定RsTYR的残余活力来计算酶活,把酶活力最高的作为对照。
测定酶的pH稳定性,将稀释至3.6 μmol/L的酶液置于上述缓冲液中,4 ℃ 反应1 h,通过测定RsTYR的残余活力来计算酶活,把酶活力最高的作为对照。
1.2.5 金属离子对RsTYR酶活性的影响
在最适温度和最适pH的条件下,测定各种金属离子对RsTYR活性的影响,金属离子的浓度为1 mmol/L,以不添加金属离子的反应的酶活性作为100%。
2 结果讨论
2.1 RsTYR的序列同源性及催化结构位点分析
通过文献发掘和已经被报道的其他来源的酪氨酸酶,我们对这些来源不同的氨基酸序列利用生物学软件MEGA X来进行序列比对,利用Espript 3.0对比对结果进行着色美化,结果如图2所示,虽然RsTYR与来源于Streptomycescastaneoglobisporus、Bacillusmegaterium、Juglansregia的酪氨酸酶都是Ⅲ型铜蛋白酶,活性位点均包含6个His[26],但他们的序列相似度较低不到10%,表明虽属不同来源,但其催化功能方面进化较为一致,具有相同的催化位点。其中,RsTYR酶和报道的来源于Juglansregia的酪氨酸酶序列相似度较高(>50%)。之后,我们将得到的不同来源的酪氨酸酶序列利用MEGA X生物分析软件构建系统进化树分析其蛋白家族属性。结果如图3所示,结合序列比结果,RsTYR同样是属于Tyrosinase Superfamily家族的酶。

图2 RsTYR序列比对

图3 RsTYR的系统发育树分析
来源于Juglansregia的酪氨酸酶(jrTYR)的晶体结构已被解析,且和RsTYR序列相似度相对较高,因此,本实验以jrTYR(PDB:5CE9)晶体结构为模板对RsTYR进行同源建模,分析其催化结构及催化活性位点。三维结构分析结果如图4所示,RsTYR同样具有两个保守的铜结合结构域Cu(A)和Cu(B),其保守的催化结合位点为His81、His93、His102、His227、His231、His253,每个铜活性中心都与3个His结合在一起,这和报道的jrTYR是一致的[27-28],表明了RsTYR确实属于Tyrosinase Superfamily家族,且为Ⅲ型铜蛋白酶。

注:(a)RsTYR模拟结构模型。α-螺旋、β-折叠和无规则卷曲的颜色分别为青色、紫色和浅粉色;(b)活性中心和催化位点的示意中心。Cu2+的活性中心呈棕色球状,催化位点(H81、H93、H102)和(H227、H231、H253)分别呈绿色和黄色棒状。
2.2 RsTYR-pET-28a载体构建
首先,用菌落PCR法对构建好的重组质粒进行验证,经验证能得到一条1.5 kb的条带,符合目的基因的大小(图5(a));然后用限制性核酸内切酶BamHⅠ和HindⅢ对RsTYR-pET28a进行双酶切验证,能够得到两条条带,大小分别为1.5 kb和5.3 kb(图5(b)),符合目的基因的大小;最后把酶切验证正确的重组质粒送至测序公司进行测序,测序后序列正确,证明成功构建重组质粒。
2.3 RsTYR诱导表达条件优化
运用生物信息学软件DANMAN对RsTYR的核酸序列进行分析,预测得到其分子量约为54.4 ku。诱导温度设置为16、25、37 ℃,诱导剂IPTG的浓度设置为0.1、0.2、0.5 mmol/L,诱导时间为12 h,优化诱导条件,得到最适条件。首先使用DeNovix DS-11分光光度计对不同诱导条件下得到的上清液测定可溶性蛋白的质量浓度,再通过Image lab对聚丙烯酰胺凝胶电泳图进行灰度分析,最后得到目标蛋白的质量浓度。结果如图6所示,当温度为25 ℃、诱导剂浓度为0.5 mmol/L时诱导12 h,上清液中可溶性蛋白质量浓度达到最高为0.4 mg/mL。由图可得,随着温度和诱导剂浓度升高,目的蛋白的质量浓度降低,可能是在高温条件下,目标蛋白不能正确折叠,从而形成包涵体沉淀。综上所述,蛋白得正确表达需要适当的诱导剂浓度和中低温等诱导条件。
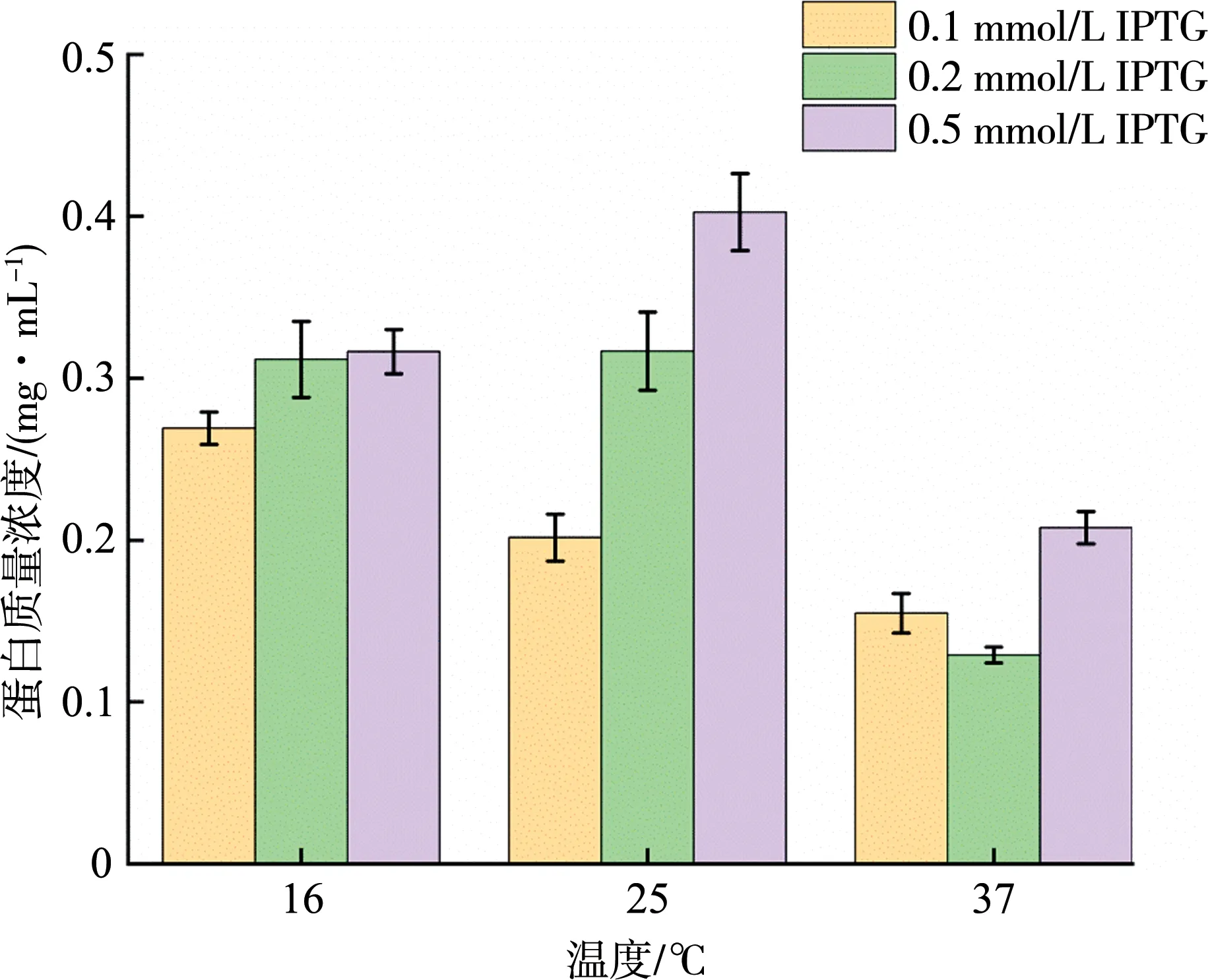
图6 不同诱导条件下上清液中可溶性RsTYR蛋白的浓度
2.4 RsTYR的表达纯化
通过聚丙烯酰胺凝胶电泳(SDS-PAGE)图7(a)分析,目的蛋白能够在上清液中可溶性表达,由Ni树脂亲和层析可以看出在含有250 mol/L咪唑的洗脱缓冲液中含有较多的目的蛋白,表明RsTYR与Ni树脂有较强的亲和力,目的蛋白条带在45~65 ku之间有明显表达,且蛋白分子量和预测值(54.4 ku)大致一样。然后依次用阴离子交换层析和凝胶过滤层析对目的蛋白进行纯化,从阴离子吸附层析(图7(b))和凝胶过滤层析分析(图7(c))中能够看出目的蛋白分别在22.87 mL和12.58 mL位置流出。结合SDS-PAGE图分析,经纯化后能够得到纯度较高的目的蛋白,并且该蛋白为单体,以此蛋白作为后续酶学性质的测定。
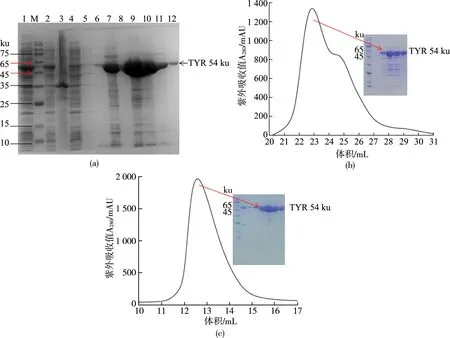
注:(a)RsTYR在质粒pET28a中表达的SDS-PAGE分析。泳道1为超声;泳道2为上清液;泳道3为沉积物;泳道4为通过;泳道5为洗涤缓冲液1;泳道6为洗涤缓冲液2;泳道7为洗脱前的树脂;泳道8为洗脱后的树脂;泳道9-12为洗脱缓冲液;(b)使用SOURCE Q柱通过离子交换纯化RsTYR;(c)使用Superdex 75 10/300GL柱通过凝胶过滤纯化RsTYR。
2.5 RsTYR底物特异性及催化产物分析
首先,按照1.2.3中的催化体系分别测定了RsTYR对L-酪氨酸和L-DOPA的底物特异性,结果如图8(a)所示,实验测得RsTYR可催化2 mmol/L的L-酪氨酸生成0.08 mg/mL的L-DOPA;然而,RsTYR对底物L-DOPA的催化体系中仅有底物L-DOPA的保留峰且与标品的峰值几乎相同,说明RsTYR不催化L-DOPA。因此L-酪氨酸是RsTYR的最适底物,并且RsTYR对L-DOPA没有催化活性。实验进一步分析了RsTYR对L-酪氨酸的催化产物,HPLC检测结果如图8(b)所示,实验组在6.577 min出现了产物L-DOPA的保留峰且无其他杂峰,表明L-酪氨酸经RsTYR酶催化后,产物单一,且为L-DOPA。和报道的酪氨酸酶(如mushroom tyrosinase)[29]相比,RsTYR对L-酪氨酸具有底物特异性,其能够一步生物催化合成L-DOPA。
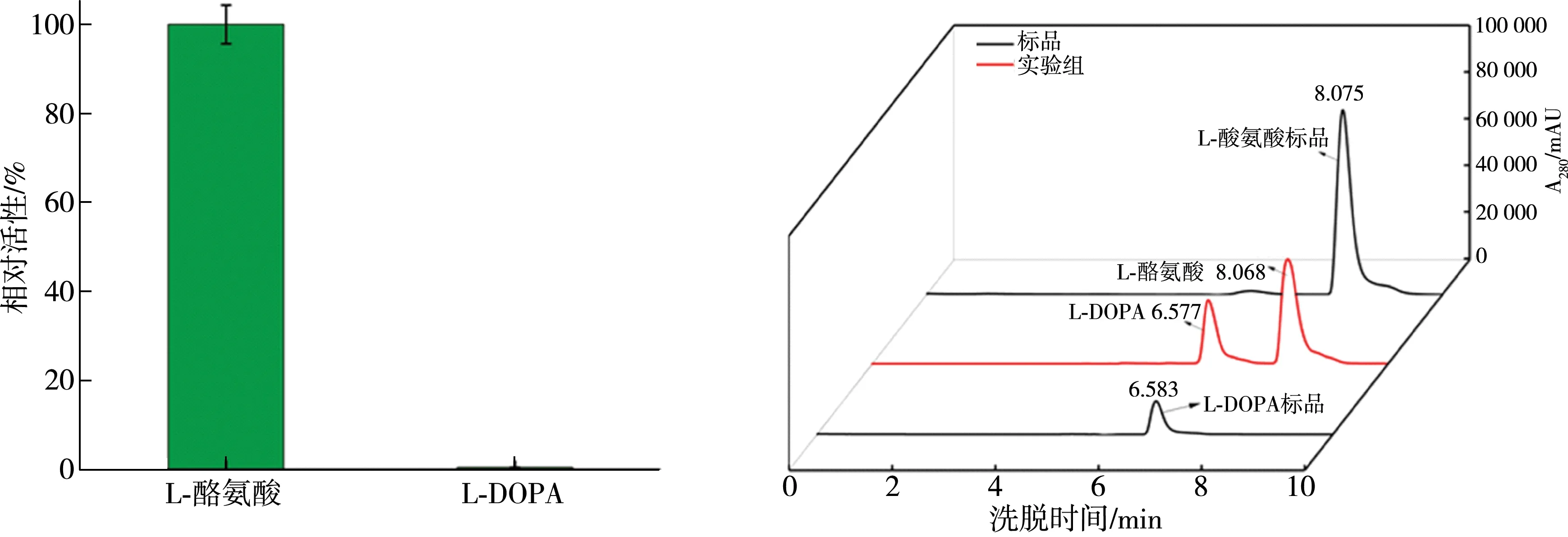
(a)RsTYR的底物特异性分析 (b)高效液相色谱法测定L-酪氨酸的催化产物
2.6 酶学性质分析
2.6.1 温度对RsTYR催化活性及稳定性的影响
温度的变化会引起酶活性的变化。当温度的升高时,底物分子热运动加快,分子碰撞的机会增加,从而提高了酶的活性。本质上酶是蛋白质,过高的温度往往会引起蛋白质的变性,而这种变性是不可逆转的,从而会降低酶活性甚至失活。
温度与RsTYR酶活性的关系如图9(a)所示,RsTYR在45 ℃时酶活性最高。在20~40 ℃,酶活性保持上升趋势。在40~50 ℃,酶活力在80%以上。但当温度超过50 ℃时,其催化活性迅速降低,在60 ℃时,活性仍能保持在30%左右。因此RsTYR在体外的最适催化温度为35~50 ℃。

(a)温度对RsTYR活性的影响 (b)RsTYR的温度稳定性
将酶置于不同温度下保温0.5~2 h,再冰浴冷却10 min,经反应后测定其残余活性。由图9(b)可知,保温时间越长,酶活性越低,并且温度越高,保存时间越长其活性下降幅度越大。在20~45 ℃,保温2 h的酶仍具有50%以上的活性,当保存温度升到60 ℃时,随着保存时间的增加,活性下降幅度越大,但仍有30%左右的残余酶活,由此可见RsTYR对温度耐受性比较强,应属于中高温酶。
2.6.2 pH对RsTYR催化活性及稳定性的影响
pH的改变也会导致酶的活性发生变化。当pH发生变化时,酶活性中心某些基团的解离程度可能也会发生改变,这种改变就包含解离基团的底物与其辅酶之间的荷电状态的改变,影响酶的亲和力,酶活性中心的空间构象也会改变,从而引起酶活性的改变。当酶处于过酸或过碱的环境时,都会造成酶的失活且不可逆。
从图10(a)中可以看出在不同pH的缓冲液中RsTYR酶活性的变化,RsTYR在pH为6.5的PBS缓冲液中有最高的酶活性,同时随着该缓冲液pH的增加,酶活性逐渐降低。在相同的pH下,比较Tris-HCl和MES缓冲液,PBS更适合RsTYR的催化反应。极端pH条件如8.5及以上,RsTYR仅有20%左右的活性,说明碱性环境不利于RsTYR的催化。所以,PBS缓冲液是RsTYR催化反应最理想的缓冲液,并且最适反应pH为6.5。
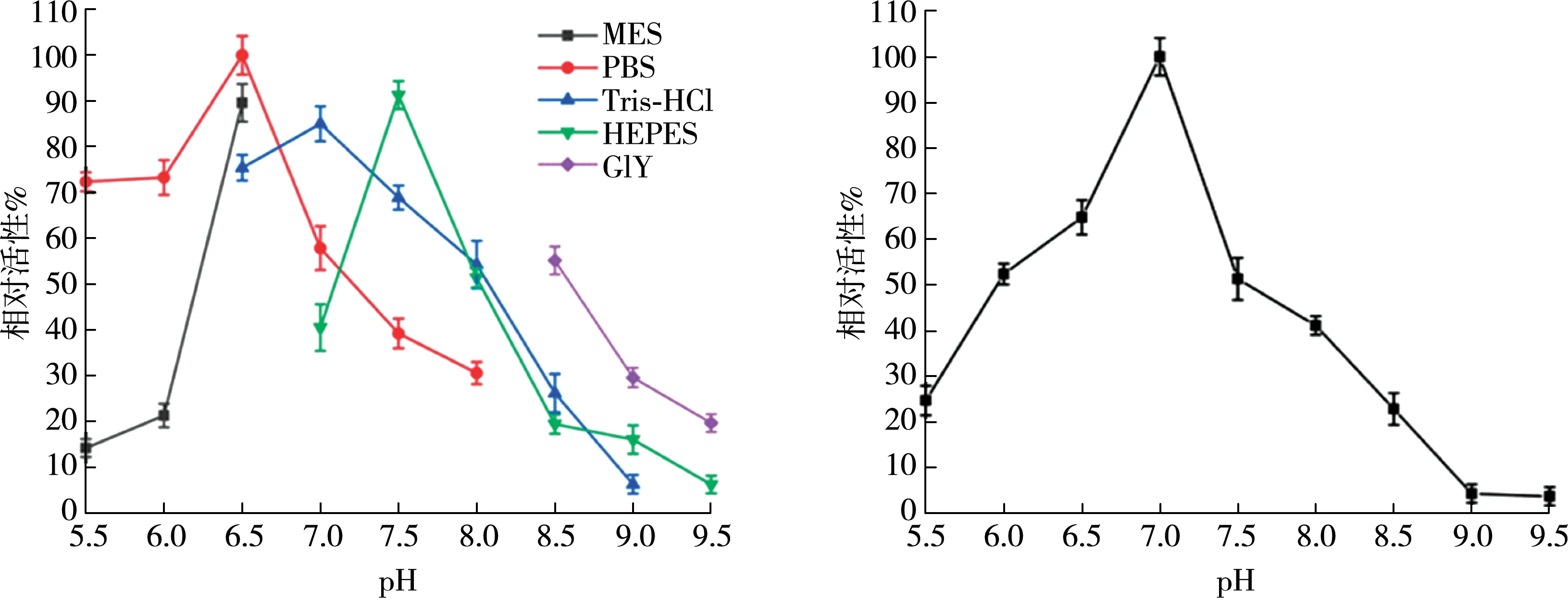
(a)pH对RsTYR活性的影响 (b)RsTYR的pH稳定性
将酶置于pH 5.5~9.5下,4 ℃保温1 h,测定其残余活性。由图10(b)可知,在pH 6.0~7.5 间,酶仍具有50%以上的活性。在pH 7.0时,RsTYR最稳定。以上表明RsTYR在pH为中性的环境酶活性较强也最稳定,碱性环境则会对RsTYR造成破坏,降低其酶活性。
2.6.3 RsTYR的酶动力学参数
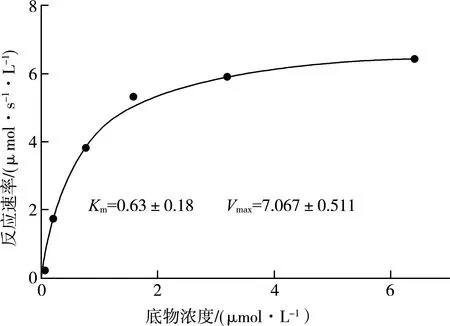
以L-酪氨酸作为底物(0.05~6.4 μmol/L)测定RsTYR的酶动力学参数,利用Graphpad Prism 8软件中的Michaelis-Menten方程[30]对数据进行非线性回归拟合。结果如图11所示,RsTYR对L-酪氨酸的酶动力学参数Km为0.63 μmol/L、kcat为9.61 s-1,kcat/Km为15.25 μmol·s-1·L-1。
2.7 金属离子对RsTYR酶活性的影响
RsTYR和各种金属离子在4 ℃的环境下孵育1 h,在最适反应条件下进行催化,测定其残余活性。结果由图12可知,K+能够提高RsTYR的活性,活性提高了48%,其他金属离子均不同程度的抑制了RsTYR的活性,其中Co2+和Cu2+对RsTYR的活性抑制程度最强,其活性仅为不添加金属离子的7%和6%。但当Cu2+的浓度为50 μmol/L时RsTYR的酶活性达到1.96倍,说明Cu2+的浓度对RsTYR的活性有显著的影响,在高浓度金属离子存在的情况下RsTYR稳定性较差。
3 结 论
当今社会老龄化程度越来越高,中老年群体患病几率逐渐增大,帕金森病患者逐年增加,如今已成为第二大神经性疾病[31]。L-DOPA作为治疗帕金森病的有效药物成分,自二十世纪六十年代L-DOPA被Birkmayer[16]证实具有治疗PD的疗效,对于L-DOPA的工业生产一直受到重视。由于生物合成法与植物合成法和化学合成法相比具有成本低、步骤简单、绿色环保等特点,也来越受到人们的关注。酪氨酸酶合成法是生物合成L-DOPA的重要手段,但其本身同时具有二酚酶活性能够继续催化L-DOPA,对工业生产不利,因此,对于新型酪氨酸氧化酶的研究及其应用都具有重要的意义。
本研究将来源于青枯雷尔氏菌(Ralstoniasolanacearum)的RsTYR成功的在大肠杆菌E.coliBL21(DE3)中进行异源表达,并得到了较高的表达量,RsTYR的蛋白分子大小为54.4 ku。经过Ni树脂亲和层析、离子交换层析和凝胶过滤层析三步纯化,获得了纯度较高的RsTYR蛋白。与此同时,还对RsTYR蛋白的酶学性质进行研究,实验发现RsTYR酶的最适温度为45 ℃,这要优于Streptomycessp.酪氨酸酶[32-33];最适反应温度范围为35~50 ℃;最适反应pH为6.5,这与一些报道的链霉菌酪氨酸酶的相似[32-35];pH在6.0~7.5的范围内该酶较为稳定。PBS缓冲液是RsTYR的最适催化反应缓冲液。RsTYR的酶动力学参数Km为0.63 μmol/L、kcat值为9.61 s-1,kcat/Km为15.25 μmol·s-1·L-1。kcat/Km的值与酶的催化效率成正比,与jrTYR相比kcat/Km的值是其5.6倍[28],说明RsTYR的催化效率更高。采用HPLC对酪氨酸的催化产物进行了分析,证明酪氨酸经RsTYR特异性催化后,产物为L-DOPA。通过序列同源性分析,确定了RsTYR属于Tyrosinase Superfamily,预测了该酶的催化位点。本研究对RsTYR的理化性质进行了基础研究,这为后续对于该酶的蛋白晶体结构、催化机制解析和定向改造提供了基础。

