滑液囊支原体RAA快速检测方法的建立与应用
吴颖臻,杨福剑,杜文珍,陈莹,张宗尧,磨美兰,黄腾,谢庆华,黄裕富,唐雪梅*,韦天超*
(1. 广西大学动物科学技术学院,广西 南宁 530005;2. 广西参皇养殖集团有限公司,广西 玉林 537000)
滑液囊支原体(Mycoplasmasynoviae,MS)是一种重要的禽类病原体,可引起家禽呼吸道疾病和关节炎性滑膜炎。MS感染的鸡多呈隐性经过,导致出现严重的免疫抑制、生长发育迟缓,还会引起产蛋下降,造成较大的经济损失[1]。该病原主要传播方式是水平传播,还可经蛋垂直传播[2]。
目前MS感染常用诊断方法包括:病原分离培养,血清学诊断和分子生物学方法。其中病原分离培养所需的成本高,耗时长,培养的条件苛刻,不适合快速诊断和检测;血清学诊断虽方便快捷,但其敏感性低,存在交叉反应,所以常与其他诊断结果一起判断;分子生物学方法如聚合酶链式反应(polymerase chain reaction,PCR)、实时荧光定量 PCR(quantitative real-time PCR,qPCR)以及环介导等温扩增(loop-mediated isothermal amplification,LAMP)虽比分离培养方便快捷,但其所检测的场地有所限制,对仪器以及人员要求高[3]。重组酶介导的等温扩增技术(recombinase-aided amplification,RAA)是近年来建立的一种新型体外核酸扩增手段,所用的重组酶是从细菌或真菌中分离获得的,该技术在常温等温条件下(一般为 37~42 ℃)反应5~30 min即可实现对目的基因片段的扩增[4]。RAA对设备要求低,普通RAA法特异性好、灵敏度高,只需要一个水浴锅就可完成扩增,耗时短(5~30 min)、操作简便且无需专业人员也能进行操作,适合在基层或者经济欠发达的地区推广。RAA技术已在病原体检测、疾病诊断等多个领域成功应用[5-7]。本研究建立了MS的RAA新型检测方法,为MS感染的诊断与流行病学调查提供了重要手段。
1 材料与方法
1.1 菌(毒)株核酸模板
本研究中使用的滑液囊支原体(MS)疫苗株MS-H株、鸡毒支原体(MG)TS-11株、大肠杆菌(E.coli)参考株(ATCC25922)、沙门菌(SE)参考株 (CVCC538)、新城疫病毒(NDV)La Sota株、禽传染性喉气管炎病毒(AILTV)K317株、禽呼肠孤病毒(ARV)CA株、禽传染性支气管炎病毒(IBV)H120株、H9N2亚型禽流感病毒(AIV)以及实验室3株MS分离株的DNA或cDNA均储存在-20 ℃冰箱中。
1.2 主要试剂
细菌DNA提取试剂盒购自上海生工有限公司;DL2000 DNA Marker购自TaKaRa公司;酚/氯仿(1∶1)购自索莱宝生物科技有限公司;大肠杆菌DH5α感受态细胞和质粒小提试剂盒购自北京康为世纪生物科技有限公司;RAA核酸扩增试剂盒(基础型)购自杭州众测生物科技有限公司。其他常规试剂由本实验室保存。
1.3 引物的设计与合成
针对 GenBank公布的 MSvlhA基因序列(HQ326479.1)的保守区域,结合RAA反应原理,采用Primer Primier 6.0与Oligo 7.0相结合设计2对特异性引物,以及文献[8]提供的PCR引物F3/R3,均交由南宁捷尼斯生物科技有限公司合成,引物序列如表1。

表1 引物名称及序列
1.4 样本处理
将棉拭子插入鸡喉头及上颚裂处,刮取分泌液,随后将拭子放入含0.8~1 mL DMEM的2 mL 离心管中,置37 ℃ 100 r/min的摇床中,扩培12 h,用细菌DNA提取试剂盒提取。
1.5 RAA反应体系的建立及引物筛选
在重组酶干粉的反应管中先加入41.5 μL A Buffer,再依次加入2 μL上下游引物(10 μmol/L)、2 μL MS DNA,B Buffer 2.5 μL,混合均匀,放置于恒温水浴锅中39 ℃反应30 min。待扩增结束后,加入酚/氯仿(1∶1)50 μL,振荡均匀,12 000 r/min 离心3~5 min。取上层溶液8 μL进行凝胶电泳反应(胶浓度1.5%),电压 120 V 反应 30 min,在凝胶成像系统上获取结果。比较2对引物的扩增情况,筛选最佳引物。
1.6 标准质粒的制备
选用RAA反应体系中最优的上下游引物,将提取的MS标准质粒DNA按以下反应体系:PCR Mix 12.5 μL,ddH2O 8 μL,上下游引物(10 μmol/L)各1 μL,模板DNA 2.5 μL。反应程序:95 ℃ 5 min;95 ℃ 15 s,58 ℃ 15 s,72 ℃ 30 s,共计35个循环;72 ℃ 5 min。反应完毕,将扩增的片段连接至载体pMD18-T,转化到DH5α感受态细胞,菌液PCR验证后为阳性菌株,送至华大基因公司测序,测序结果在NCBI上比对,用质粒提取试剂盒提取质粒DNA,-20 ℃保存。
1.7 RAA反应体系的优化
在反应体系中分别加入终浓度为0.1、0.2、0.3、0.4、0.5 μmol/L的上下游引物,同时确保其它反应体系不变,筛选出最佳引物浓度。
反应时间的优化,分别进行10、15、20、25和30 min扩增,同上筛选出最佳反应时间。
确定最优引物浓度和反应时间后,设置反应温度为25、27、29、31和33 ℃,用上述方法进行检测,筛选出最佳反应温度。
1.8 RAA法特异性和敏感性的评估
分别取MS、MG、E.coli、SE、NDV、IBV、ILTV、ARV、AIV的DNA或cDNA作为模板,进行扩增,以验证该方法的特异性。
用分光光度计测定抽提的重组质粒浓度,并将其按10倍倍比稀释为10-10~10-1共10个浓度梯度,各取2 μL不同浓度的质粒配制RAA反应体系,设立ddH2O代替阳性质粒模板的阴性对照,以选出其最优敏感性。浓度计算公式:拷贝数(copies/μL)=(浓度ng/μL×6.02×1023×10-9)/(扩增片段长度×660)。
1.9 重复性试验
选取不同浓度质粒标准品(6.53×1011copies/μL、6.53×109copies/μL、6.53×107copies/μL)作为模板按照已经优化好的RAA法进行3次重复性试验,以验证该方法的重复性。
1.10 临床样本检测
选取临床表现为精神不振、伴有轻微呼吸道症状,个别表现出单侧或双侧关节、脚垫肿大,走路困难的患病鸡只,采集其咽喉拭子共计100份,按照1.5提取样本DNA作为模板,用优化好的RAA法对其进行检测。同时根据文献[8]中常规PCR法,合成特异性引物F3/R3(见表1),进行常规PCR检测,比较2种方法的检测结果,验证新建立方法的有效性。
2 结果与分析
2.1 RAA法引物的筛选以及建立
针对MSvlhA基因设计出的2对引物,两两组合后,通过观察条带的大小以及条带的亮度来筛选出最优的引物组合,其扩增产物的结果如图1所示,通过扩增效率选择 F2/R1 为最优引物组合,其扩增片段长度为188 bp。

M. DL2000 DNA Marker;1. F1/R1;2. F1/R2;3. F2/R1;4. F2/R2;N.阴性对照。
2.2 引物浓度的优化
结果如图2所示,扩增出目的条带的引物最低浓度为0.2 μmol/L,随着引物浓度的增加,扩增效率逐渐增强。综合考虑,选择引物浓度为0.4 μmol/L,上下游引物添加量各为2 μL。

M. DL2000 DNA Marker;1~5.0.5~0.1 μmol/L;N.阴性。
2.3 反应时间的优化
确定最优引物浓度后,保持其他条件不变的情况下,设置时间梯度,结果如图3所示,在10 min时便能扩增出目的条带,但在15 min后会有杂带出现,即选择反应时间为15 min。

M. DL2000 DNA Marker;1. 10 min;2. 15 min;3. 20 min;4. 25 min;5. 30 min;N.阴性对照。
2.4 反应温度的优化
结果如图4所示,在25~33 ℃之间均能扩增出条带。在29 ℃时条带最亮,扩增效率最高,在30~33 ℃则会有杂带出现,即最优的反应温度为29 ℃。

M.DL2000 DNA Marker;1. 25 ℃;2. 27 ℃;3. 29 ℃;4. 31 ℃;5. 33 ℃;N.阴性对照。
2.5 RAA法特异性
利用建立好的基础RAA方法,对MS、MG、E.coli、SE、NDV、IBV、ILTV、ARV、AIV进行扩增,结果如图5所示,只有MS出现特异性条带,其余病原核酸的检测结果均为阴性,表明RAA检测方法具有良好的特异性,与其他常见禽病原体无交叉反应。

M.DL2000 DNA Marker;1~4. MS;5. MG;6. E.coli;7. SE;8. NDV;9. IBV;10. ILTV;11. ARV;12. AIV。
2.6 RAA法敏感性
测定MS重组质粒浓度为134.68 ng/μL,经10倍倍比稀释后的浓度分别为6.53×1010~6.53×101copies/μL。结果显示,模板量低于6.53×105copies/μL时,未见目的条带(图6A),说明该方法对 MS 的最低检出限度为6.53×105copies/μL;另外,用相同引物进行的常规 PCR 最低检出限度为13.06×107copies/μL(图6B),因此,建立的RAA比普通PCR灵敏度高出100倍。

M.DL2000 DNA Marker;1~10. 浓度分别为6.53×1010~6.53×101 copies/μL;N.阴性对照。
2.7 重复性试验
选取浓度为6.53×1011copies/μL的重组质粒作为重复性试验结果代表,如图7所示。试验结果显示均能扩增出目的条带,且条带大小与试验预期相符,无明显差异,说明该方法具有良好的重复性。

M.DL2000 DNA Marker;1~3. 浓度为134.68 ng/μL的质粒3次重复性试验;N.阴性对照。
2.8 样品检测
应用建立的MS RAA法对临床样品进行检测,结果如表2所示,与常规PCR结果100%符合,且2种检测方法结果为阳性的均是来自同一临床病料,表明RAA法完全适用于临床。
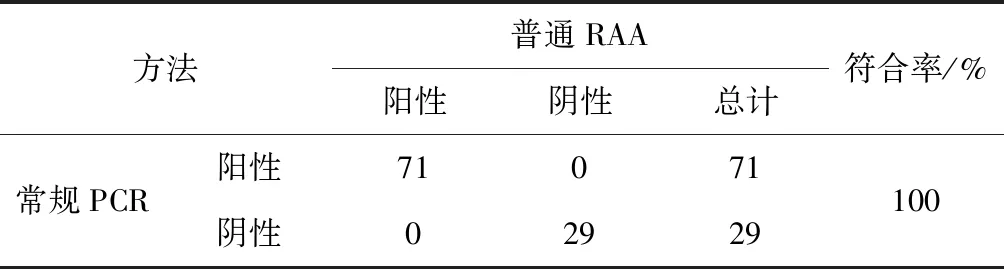
表2 临床样品的检测
3 讨论
滑液囊支原体在鸡群感染日益严重,给养殖业造成了巨大的经济损失[9]。病原分离培养虽是鉴定MS的金标准,但其培养条件苛刻、周期长,操作复杂,不适应养禽业疾病快速诊断的需要。血清学检查易出现假阳性不适用于临床早期诊断[10];PCR虽然准确率比病原分离培养要高,但MS在体内的数量随着感染时间的延长可能在这些组织中含量过低,导致PCR的结果为阴性,而个体仍会发病[11]。邓显文等[12]建立的LAMP方法虽然可在水浴锅中62 ℃反应1 h,90 ℃作用5 min灭活,便能读出结果,但其设计引物复杂。目前所建立的分子生物学检测方法普遍存在相对费时且不适用现场快速检测的缺点[13]。研究和建立一种快速有效、简便的检测方法对防控MS的传播和我国养禽业的健康发展具有重大意义。
RAA技术是我国近些年来自主研发,很适合在基层和资源匮乏的地区推广使用。Wang等[14]、Fan等[15]、Mu等[16]建立了用RAA技术检测新城疫病毒、非洲猪瘟病毒和大肠杆菌O157:H7的方法。本研究通过设计2对引物两两结合进行筛选,选择出最优的1对引物,在29 ℃条件下发生等温扩增反应,15 min内便出检测结果,其检测的最低灵敏度为6.53×105copies/μL,具有较好的特异性。对收集的临床样本,所得结果与普通PCR一致。卞红春等[17]建立的方法是在38 ℃ 25 min可检测出MS,其敏感性为15.5 pg/μL,而本研究在同类方法上有所优化,反应温度更接近常温,更省时,敏感性更高。
RAA引物比PCR引物要长,没有专门的设计软件,所以在设计时需符合其原则。其最优长度一般在30~36 bp,低于30 bp、高于36 bp也可用,但是最长不能超过45 bp。5′端要避免出现多个G,最佳为C 或T;3′端最佳为G 和 C;GC含量介于40%~60%为最佳,避免引物二聚体和发卡结构的出现[16]。对扩增产物的长度也有要求,扩增产物的片段大小为100~200 bp 最佳,建议不超500 bp,这两点引物设计原则可使反应更加灵敏。克服RAA检测方法的不足之处还需进一步的探索。
综上所述,本研究建立了MS RAA 新型检测方法,该方法检测时间短,反应灵敏,特异性好,对仪器以及人员的要求不高,适用于在养殖场等现场进行检测,为MS感染的诊断和流行病学调查提供了新的技术手段。

