维甲酸对体外热处理猪精子活力、抗氧化性能及其糖脂代谢的影响
石一凡,李晓彤,刘俊泽,李春梅,李延森
(南京农业大学动物科技学院家畜环境控制与智慧生产研究中心,江苏 南京 210095)
在生猪养殖业中,公猪发挥重要作用。为了提高优质公猪资源的利用率,降低饲养成本,同时降低动物之间疾病的传播风险,人工授精被广泛用于养猪业。液体形式储存的公猪精液在猪的人工授精中较为普遍,但精子对温度变化比较敏感,多于15~17 ℃条件下保存运输,在稀释液中可维持精子生育能力3~7 d[1-2],当温度升高时精子活力明显降低。
精液保存中最大的问题是在保存过程中对精子结构的损害,导致精子的生育能力差[3]。精子在保存过程中生育能力降低的机制尚不完全清楚。然而,最近人们对活性氧(reactive oxygen species,ROS)在保存过程中对精子功能和受精能力的作用越来越感兴趣。适宜水平的ROS对于正常受精、获能、运动和顶体反应是必不可少的[4]。据报道,在精液保存和人工授精的各种过程中,由于过度或不适当形成的ROS造成氧化损伤,精子活力和生育能力降低[5]。精子分化程度高,无DNA修复机制,细胞膜含较高水平的多不饱和脂肪酸,且本身细胞质抗氧化酶少,更易受氧化应激损伤[6]。精子功能障碍和ROS的过量产生之间存在关联,高温引起损伤的机制之一是氧化应激。精子质膜过氧化损伤被认为是雄性不育的重要病理机制[7-8]。已知脂质过氧化物可引起精子细胞的各种损伤,如膜损伤和运动性降低[9]。许多研究表明,膜脂质过氧化是保存在4 ℃的液体精液[10]和冷冻保存的精液[11]中精子功能缺陷的原因之一。此外,热应激诱导的氧化应激会促进过早获能,并增加获能和顶体反应精子的比例[12]。这种过早获能的状态会降低精子的寿命、受精和胚胎发育速度。精子细胞可能携带诱导卵母细胞损伤的代谢物,如脂质过氧化和抗氧化剂的减少,损害胚胎发育[13]。因此,随着保存时间和温度的增加,精子产生过多的ROS可能会对精子造成损伤,进而对精子质量产生影响,影响母猪受孕率及产仔数[14]。
维甲酸(retinoic acid,RA)是维生素A进入动物体内后的活性代谢物,有调节细胞氧化还原平衡的能力。研究表明,人类精子上有维甲酸受体α(retinoic acid receptor α,RARα)蛋白表达,且在精索静脉曲张患者精子中表达降低,这暗示RA与精子活力有一定关系[15]。我们之前的研究发现,RA能改善高温对小鼠附睾精子活力产生的影响,提高小鼠睾丸抗氧化能力[16]。用浓度为100 nmol·L-1RA处理人精子,可使其存活率显著升高,精子丙二醛(malondialdehyde,MDA)含量降低,重新调整精子能量代谢水平,提示给予RA补充可能是治疗男性不育的一种有前途的治疗方法[17]。基于以上研究,本文首先确立体外热损伤模型参数,其次筛选适宜RA处理剂量,并确定猪精子中是否表达RARα,探究体外高温处理对猪精子的影响以及RA的保护作用,以期为延长公猪精液体外保存期限提供策略。
1 材料与方法
1.1 试验材料
成年大约克夏种公猪精液(活力>70%),购自江苏省南通市如东县日昇畜牧养殖有限责任公司。
1.2 试验试剂
EBSS购自上海源培生物科技股份有限公司;RA、Triton X-100购自上海源叶生物科技有限公司;DMSO购自北京兰杰柯科技有限公司;牛血清白蛋白(BSA)、PBS、RIPA裂解液购自北京索莱宝科技有限公司;葡萄糖测定试剂盒购自上海荣盛生物药业有限公司;总胆固醇、甘油三酯、丙酮酸、MDA、总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)和总抗氧化能力(T-AOC)检测试剂盒购自南京建成生物科技有限公司;RARα抗体购自武汉爱博泰克生物科技有限公司;Alexa flour 488、DAPI染液购自上海碧云天生物科技有限公司。
1.3 试验设计
1.3.1 建立高温体外猪精子损伤模型
将相同来源的精液随机分为5组:0、1、2、3和4 h组,每组3个重复,为了消除精液稀释液中其他物质对试验的影响,将精液1 000g离心15 min,弃去上清,加入EBSS培养基重悬,分别于39 ℃中孵育0、1、2、3和4 h后,利用计算机辅助精子分析方法(computer-aided sperm analysis,CASA)测定不同组别精子活力,选出适合的孵育时间用于后续试验。
1.3.2 筛选RA适宜添加浓度
将相同来源的精液随机分为6组,用不含RA(CON组)和含不同浓度RA(10、50、100和1 000 nmol·L-1组)的EBSS重悬(RA用DMSO溶解),DMSO组用含相应剂量DMSO的EBSS重悬,每组设置3个重复,39 ℃下孵育3 h,测定精子活力,筛选出RA的最适添加浓度用于后续试验。
1.3.3 RA对体外高温条件下猪精子活力的影响
将相同来源的精液随机分为4组,分别为:37 ℃、37 ℃+RA、39 ℃、39 ℃+RA,每组设3个重复,精液1 000g离心后加入EBSS重悬,根据1.3.2中得出的RA浓度,37 ℃+RA组和39 ℃+RA组培养基中RA终浓度为100 nmol·L-1,37 ℃组和39 ℃组培养基中不含RA;37 ℃组和37 ℃+RA组于37 ℃下孵育3 h,39 ℃组和39 ℃+RA组于39 ℃下孵育3 h,测定精子活力。
1.4 样品采集
将1.3.3中样品处理完成后,精液1 000g离心15 min,精子用PBS洗涤2遍后储存于200 μL离心管中,于-80 ℃冰箱中保存备用。
1.5 测定指标和方法
1.5.1 精子活力测定
将载玻片和盖玻片置于37 ℃载物台上预热,用移液枪将样品轻轻吹打混匀,吸取10 μL于预热的载玻片上,加盖盖玻片,立即在400倍显微镜下观察精子,每个样品至少选取5个视野,利用CASA检测精子活力。精子活力根据其运动特征划分为:总活力、前进运动精子比例、快速运动精子比例、慢速运动精子比例、原地运动精子比例和不运动精子比例。
1.5.2 精子代谢指标测定
向精子样品中加入RIPA裂解液,充分裂解后,10 000g离心5 min,收集上清液,按照试剂盒说明书中步骤测定相关指标。采用比色法测定精子中丙酮酸含量:丙酮酸能与显色剂反应,产物在碱性溶液中显红棕色,颜色深浅与丙酮酸含量成正比。采用葡萄氧化酶法测定精子中葡萄糖含量。采用COD-PAP法测定精子中总胆固醇含量:反应生成的醌类化合物颜色深浅与胆固醇的含量成正比。采用CPO-PAP法测定精子中甘油三酯含量:反应生成的醌类化合物颜色深浅与甘油三酯的含量成正比。
1.5.3 精子抗氧化性能测定
向精子样品中加入RIPA裂解液,充分裂解后,10 000g离心5 min,收集上清液,使用TBA法测定精子MDA含量,分别采用羟胺法、钼酸铵法、比色法和FRAP法测定精子T-SOD、CAT、GSH-PX和T-AOC。步骤严格按照说明书进行。
1.5.4 精子RARα的定位
将精液样本1 000g离心15 min,PBS洗涤2遍,使用2% PFA/PBS将精子固定30 min,取20 μL精液涂片,在超净台自然风干。加100 μL含0.5% Triton X-100的PBS通透10 min,PBS洗涤3次,置于摇床上,每次5 min。用免疫组化笔在精子周围画圈,在圈内滴加200 μL含10% BSA的PBS室温封闭30 min。甩去封闭液,然后滴加RARα抗体(1∶200稀释)作为一抗4 ℃孵育过夜。PBS洗涤3次,然后滴加Alexa flour 488(1∶200稀释)作为二抗37 ℃孵育15 min。不滴加一抗的精子细胞作为阴性对照。PBS洗涤3次后,加DAPI染液避光孵育10 min。PBS洗涤3次后,滴加3滴抗淬灭剂,加盖盖玻片,立即在激光共聚焦显微镜下观察。
1.6 数据统计与分析
试验数据先用Excel 2010进行整理,用SPSS 25.0分别对处理时间筛选试验结果和浓度筛选试验结果进行单因素方差分析(One-way ANOVA),Duncan法进行多重比较。对RA和温度两因子水平试验数据进行双因素方差分析,Duncan法进行多重比较,试验数据均用“平均值±标准误”表示,P<0.05表示差异显著。
2 结果
2.1 高温条件下不同处理时间对体外猪精子活力的影响
在39 ℃条件下孵育不同时间对精子活力的影响如图1所示。与处理前相比,39 ℃处理2、3和4 h后精子总活力均显著降低(P<0.05);39 ℃处理4 h后前进运动精子比例和快速运动精子比例显著降低(P<0.05);39 ℃处理2 h和3 h后慢速运动精子比例显著增加(P<0.05);39 ℃处理2 h和3 h后原地运动精子比例显著升高(P<0.05);39 ℃处理2、3和4 h后不运动精子比例显著升高(P<0.05)。随着孵育时间的增加,精子的运动性能逐渐变差。因此,本试验选择39 ℃孵育3 h进行后续试验。
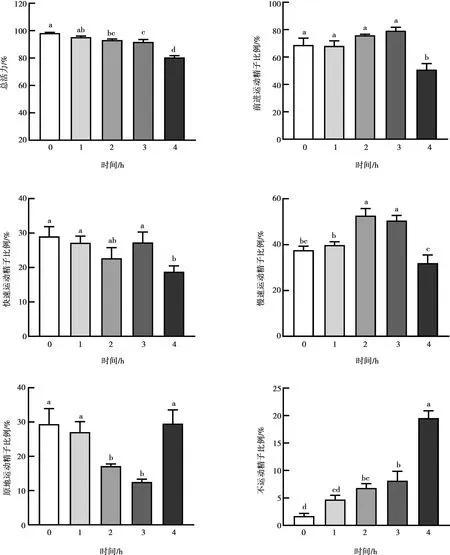
相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。
2.2 高温条件下不同浓度RA对体外猪精子活力的影响
不同浓度RA对高温条件下猪精子活力的影响如图2所示。培养基中添加DMSO不会对精子活力产生显著影响(P>0.05),培养基中含50 nmol·L-1和100 nmol·L-1RA能显著提高精子总活力(P<0.05),显著降低不运动精子比例(P<0.05),含10 nmol·L-1和100 nmol·L-1RA能显著提高前进运动精子比例,且浓度为100 nmol·L-1作用效果最好。更高的剂量1 000 nmol·L-1RA未对精子运动性能产生显著影响(P>0.05)。因此,选用100 nmol·L-1浓度RA继续进行试验。
2.3 RA对体外高温条件下猪精子运动能力的影响
培养基中含100 nmol·L-1RA对体外高温条件下猪精子运动能力的影响如图3所示。由图3可知,与37 ℃相比,39 ℃培养3 h会显著降低精子总活力及前进运动精子比例(P<0.05),显著提高不运动精子比例(P<0.05),培养基中含100 nmol·L-1RA能显著降低原地运动精子比例(P<0.05)。与39 ℃相比,培养基中含100 nmol·L-1RA能显著提高精子总活力、前进运动精子比例以及快速运动精子比例(P<0.05),显著降低不运动精子比例(P<0.05)。说明高温能显著降低体外培养精子运动能力,100 nmol·L-1RA能使热处理精子运动能力得到显著改善。

采用双因素方差分析温度和RA的互作效应T*RA;*表示差异显著(P<0.05);孵育时间为3 h。
2.4 RA对体外高温条件下猪精子抗氧化性能的影响
培养基中含100 nmol·L-1RA对高温条件下体外猪精子抗氧化能力的影响如图4所示。由图可知,与37 ℃相比,39 ℃培养能显著增加精子MDA水平(P<0.05),降低精子T-SOD活力(P<0.05);与39 ℃相比,培养基中含100 nmol·L-1RA能显著降低精子MDA水平(P<0.05),提高精子T-SOD活力(P<0.05)。
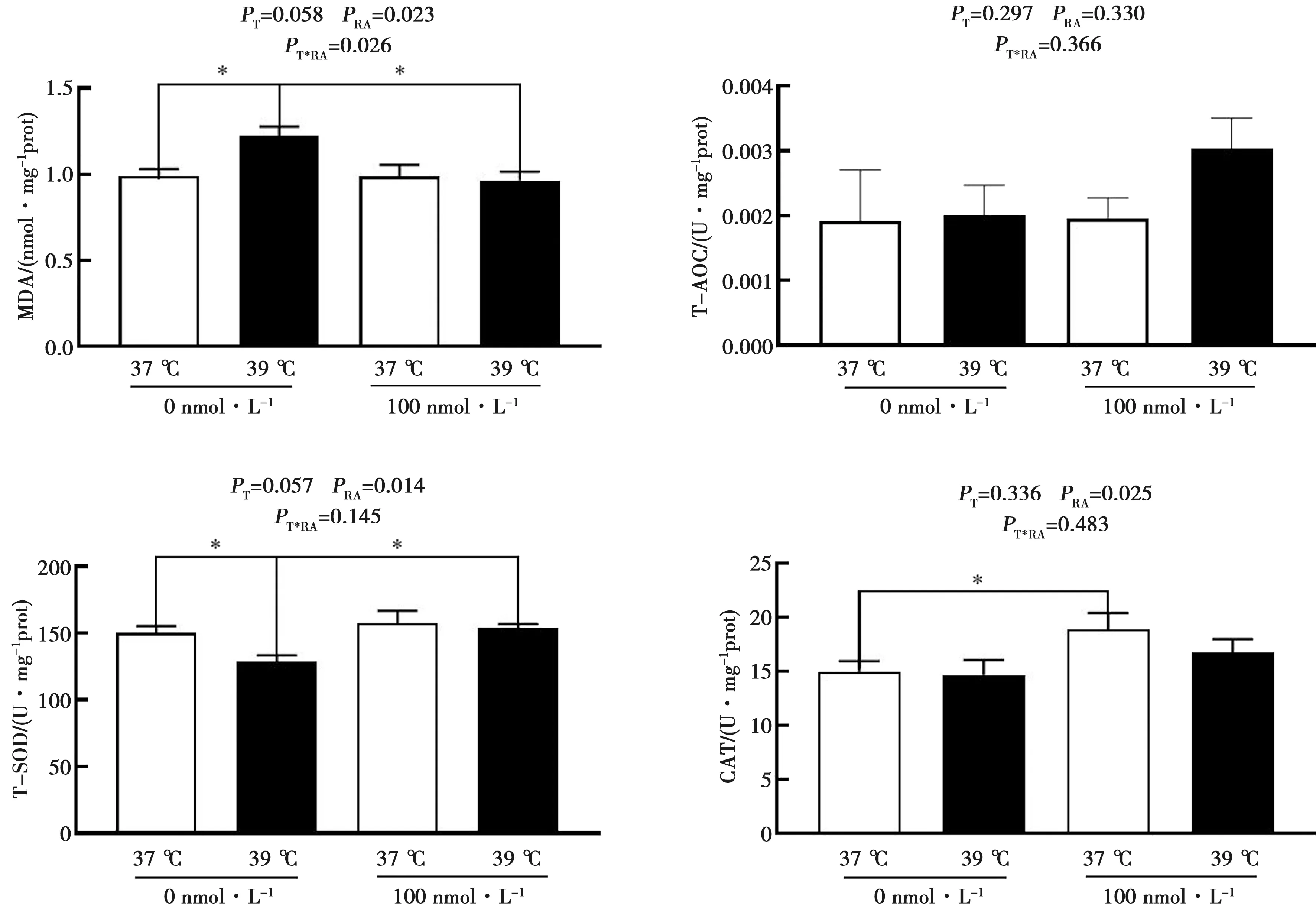
采用双因素方差分析温度和RA的互作效应T*RA;*表示差异显著(P<0.05);孵育时间为3 h。
2.5 RA对体外高温条件下猪精子脂质和葡萄糖代谢的影响
培养基中含100 nmol·L-1RA对体外高温条件下公猪精子代谢的影响如图5所示。由图可知,热处理和RA处理对精子丙酮酸、葡萄糖、总胆固醇及甘油三酯含量无显著影响。
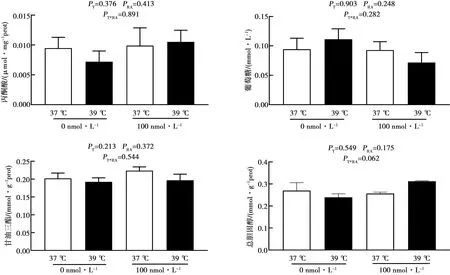
采用双因素方差分析温度和RA的互作效应T*RA。
2.6 猪精子RARα的定位及其与RA关系
猪精子RARα的免疫荧光定位结果如图6所示。猪精子RARα蛋白表达主要集中在精子尾部的主段和末段,头部和富含线粒体的中段有较弱表达,但不明显。如图可见,培养基中添加100 nmol·L-1RA未发现与未添加RA组精子RARα表达位置的明显变化。
3 讨论
当环境温度超过其热中性区的上限时,猪就会发生热应激。热应激会影响所有类型的睾丸细胞,其中精子发生过程较易受到热应激的影响[18]。精子形成后对环境变化同样敏感,睾丸温度升高对精子活力、形态和受精能力都会产生有害影响。当睾丸受热的雄性精子被用来繁殖胚胎时,胚胎死亡率增加,发育通常会受阻。使用暴露在高温下的雄性精子进行体外受精时,精子穿透率、受精率和原核形成率都会下降,早期胚胎发育异常也会增加[18]。从阴囊隔离的公牛身上采集的精子进行体外受精后,胚胎发育率降低,这是因为形态异常的精子比例很高[19]。精子细胞离开睾丸后,也很容易受到环境变化的影响。研究表明,精子细胞在受精前暴露于热应激雌性生殖道中的高温环境条件,对精子功能的影响可以在一年中的温暖月份持续存在[20-21]。精子运动性能与公猪繁殖性能显著相关,运动性能的降低也意味着繁殖性能变差[22]。
本试验为探究RA对高温下体外猪精子活力的影响,根据实验室前期研究,试验选择首先将精子置于39 ℃培养箱中孵育不同时间,测定精子运动性能,发现在39 ℃条件下,随着孵育时间的延长,精子活力随之降低,不运动精子比例随之升高,孵育4 h时活力下降最多,最终选择3 h孵育时间。然后为筛选RA适宜添加浓度,在39 ℃条件下添加不同浓度RA孵育3 h,测定精子活力。我们选择了Perrotta等[15]和Malivindi等[17]试验中对人精子的处理剂量:10、50和100 nmol·L-1,并在此基础上增加了浓度1 000 nmol·L-1,以明确高剂量RA是否对精子有毒害作用。结果显示在10 ~ 100 nmol·L-1之间随着RA添加剂量的升高,精子活力逐渐改善,且100 nmol·L-1添加剂量效果最好。之前未有试验探究100 nmol·L-1以上RA对精子活力的影响,在本试验中发现当浓度增加到1 000 nmol·L-1时RA对精子活力的改善作用消失,但并无有害影响,说明在100 ~ 1 000 nmol·L-1之间可能存在更加适宜的浓度。本文研究结果表明,100 nmol·L-1RA能显著提高体外高温条件下的精子总活力、前进运动精子比例以及快速运动精子比例,显著降低不运动精子比例,表明精液稀释液中添加适宜剂量的RA可通过改变精子运动状态,来提高精液品质,而RA具体添加量还需进一步试验确定。
评估脂质过氧化对精子影响的一个简单指标是精子和精浆MDA的测定,MDA是一种稳定的脂质过氧化产物[23]。而评估精子抗氧化性能的指标一般有T-SOD、CAT和T-AOC等。SOD是一种高度特异性的超氧阴离子自由基清除酶,催化超氧化物歧化为氧和过氧化氢,其活性的变化可能导致自由基的产生不平衡。本试验结果表明,39 ℃热处理后精子MDA水平显著升高,T-SOD活力显著降低。RA处理后能显著降低热处理精子的MDA水平,显著提高精子T-SOD活力。Malivindi等[17]研究也表明,RA能降低精子的MDA水平,提高精子SOD和GST活力。
精子细胞可以独立调节自身的代谢[24],根据其能量需求自主调节能量底物的利用[25]。在体细胞中已观察到RA在脂质代谢中的作用,能调节成年动物的能量平衡和肥胖[26]。已有研究表明,RA能重新调整精子的代谢,以提高精子的存活率和获能能力[17]。诱导获能的物质具有降低甘油三酯含量的作用,同时伴随着与能量消耗有关的一些酶活性的增加[27]。获能的精子表现出更高的代谢率和总体能量消耗。因此,可以概括地说,在获能过程中,能量需求增加,总体能量消耗,与分解代谢有关。从这个角度出发,我们研究了RA对高温引起的精子运动能力改变的保护作用是否会涉及葡萄糖和脂质代谢的具体变化。胆固醇是哺乳动物细胞膜的重要组成部分,它在促进膜稳定性的同时保证了膜的流动性,在确保精子的正常代谢方面起了重要作用。有氧糖酵解是许多哺乳动物精子运动和获能的主要ATP来源[28]。糖酵解底物对于运动[29]、与获能相关的蛋白酪氨酸磷酸化和过度激活[30]以及受精[31]都是必不可少的。乳酸脱氢酶催化丙酮酸转化为乳酸,同时伴随NADH氧化为NAD+,这是糖酵解持续产生ATP所必须的。因此,丙酮酸含量也反应了糖代谢水平[32]。本试验结果表明,39 ℃热处理及RA处理对精子中丙酮酸、葡萄糖、甘油三酯和总胆固醇无显著影响。可能是处理时间还未引起代谢发生显著变化。
RA是精子发育和成熟所必需的维生素A的主要生物活性形式[33]。RA的生物学效应是通过特定的核受体RAR介导的,RARα是一个具有转录因子作用的核受体,它与视黄酸X受体形成异二聚体后,可以与许多基因启动子中的RA反应元件结合,控制基因表达,现已证明其可在支持细胞和生殖细胞中表达[34-35]。RA通过其受体在雄性生殖过程中发挥着重要作用。通过小鼠遗传学研究证明了RARα在睾丸和附睾中起关键作用,在这些研究中,RARα基因的破坏导致了许多精子发生和不育的缺陷[36-37]。另外,相关研究发现不同活力的人精子中RARα的蛋白表达水平不同,利用RA处理精子,可提高精子存活率和抗氧化力[15,17]。在本试验中,通过免疫荧光测定发现,RARα蛋白主要在猪精子的颈部和尾部主段表达,这为通过精液稀释液中添加RA提高精子活力提供理论支持。但本试验发现添加RA未明显改变精子富含线粒体部位的RARα蛋白的表达,说明RA并不是通过改变RARα蛋白的表达发挥作用,具体作用机制还需进一步探究。
4 结论
综上所述,39 ℃热处理会降低精子总活力、前进运动精子比例和快速运动精子比例,提高慢速运动和不运动精子比例,且随着处理时间的增长影响增加。当培养液中添加RA时,热处理精子的丙酮酸、葡萄糖、甘油三酯和总胆固醇含量无显著改变,但精子MDA含量显著降低,T-SOD活性显著提高,精子运动能力显著改善,表明RA能维持高温条件下精子抗氧化能力和精子活力。本试验中添加100 nmol·L-1RA效果最好,为RA作为精液稀释液中提高精子活力、保护精子免受氧化应激损伤的有效成分提供理论依据。

