我国16省份猪流行性腹泻病毒临床检测及基于S基因的遗传进化分析
赵文影,黄柏成,谢莉敏,卫璐璐,杨倩,张云静,高晓静,田克恭
(国家兽用药品工程技术研究中心,河南 洛阳 471003)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的高度接触性、传染性肠道疾病,主要临床表现为腹泻、呕吐、厌食和脱水等[1]。1976年Pensaert等[1]在英国和比利时猪场首次发现PEDV,19世纪80年代中国首次出现,在猪群中一直呈地方性流行,1994年Sun等[2]研制的CV777株灭活疫苗对猪群有很好的保护效果。直至2010年底,中国猪群中暴发大面积PED疫情,继而自2013年开始美国、加拿大、日本和哥伦比亚等地相继有高毒力PEDV变异株[3-4]引发疫情的报道。现有疫苗不能对猪群提供完全免疫保护。
PEDV是一种有囊膜的单股正链RNA病毒,属于α冠状病毒属。PEDV基因组全长约28 kb,从5′至3′依次为5′UTR-ORF1a-ORF1b-S-ORF3-E-M-N-3′UTR-PloyA[5]。PEDV S蛋白是糖基化蛋白,由受体结合亚基S1和膜融合亚基S2组成。S1结构域对于识别和结合细胞受体很重要[6-7],而S2结构域对病毒的组织趋向性和细胞感染能力具有一定的影响[8]。S蛋白可以激活宿主产生中和抗体,目前公认的中和抗体表位分别是COE(499~638aa)、SS2(748~755aa)、SS6(764~771aa)、2C10(1 368~1 374aa)[9]。此外,S基因容易发生突变,常以S基因作为分子流行病学研究对象,在一定程度上反映PEDV全基因变异情况。根据S基因的变异情况可以将PEDV毒株划分为6个亚群,分别是GⅠa亚群、GⅠb亚群、S INDEL亚群、GⅡa亚群、GⅡb亚群和重组亚群[10]。
本试验利用RT-PCR方法对732份腹泻样品进行PEDV核酸检测,选择PEDV阳性样品进行S基因扩增、测序,应用MEGA6.0和MegAlign软件对测序毒株S基因进行遗传变异分析,并运用软件对其编码的S蛋白进行氨基酸序列分析,为监测国内PEDV毒株遗传变异情况及研发有效疫苗提供技术储备和参考。
1 材料与方法
1.1 材料
1.1.1 主要试剂
2×TransTaq®-T PCR Super Mix (+dye)和EasyScript®First-Strand cDNA Synthesis Super Mix反转录试剂盒均购自北京全式金生物公司;Viral Nucleic Acid Extraction Kit II 核酸提取试剂盒购自台湾旭基生物公司,溴化乙锭溶液(EB)和50×TAE电泳缓冲液购自上海生工生物公司,DNA Marker和琼脂糖购自TaKaRa生物公司。
1.1.2 样品采集
2020—2021年从全国16个省市(自治区)采集腹泻病料732份,其中包含腹泻仔猪小肠组织和粪便拭子。样品采集时间、地点和数量详见表1。
1.2 方法
1.2.1 病料处理
选取有病变的小肠肠道组织,挤出肠内容物,并用载玻片反复刮取肠壁,取300 μL肠内容物加入含500 μL灭菌PBS的EP管内,颠倒混匀后,4 ℃离心5 min(12 000 r/min),之后取200 μL的上清液保存备用。向采集的粪便拭子中加入1 mL灭菌的PBS,震荡混匀后,4 ℃离心5 min(12 000 r/min),之后取200 μL的上清液保存备用。
1.2.2 引物设计
PEDV鉴定引物按照国家标准GB/T 34757—2017《猪流行性腹泻病毒RT-PCR检测方法》设计合成,上游引物:5′-TATGGCTTGCATCACTCTTA-3′,下游引物:5′-TTGACTGAACGACCAACACG-3′,目的片段大小为315 bp;PEDV S基因测序引物设计:通过比对GenBank中所有毒株的全基因组序列,设计3对测序引物用于S基因的扩增。引物设计示意图见图1,序列及扩增片段大小见表2。引物由苏州金唯智生物公司合成。

图1 PEDV S全基因测序引物示意图

表2 PEDV S全基因测序的引物信息
1.2.3 RNA模板提取
取处理后的病料,按照Viral Nucleic Acid Extraction Kit II试剂盒说明书进行RNA的提取。
1.2.4 cDNA合成
取抽提后的RNA,按照EasyScript®First-Strand cDNA Synthesis Super Mix反转录试剂盒说明书进行cDNA的合成。
1.2.5 PCR扩增
取1.2.4中合成的cDNA作为模板进行PCR的扩增,PCR反应体系和反应程序与2×TransTaq®-T PCR Super Mix (+dye)试剂说明书基本保持一致,鉴定引物和测序引物的退火温度均为55 ℃,72 ℃延伸1 min。PCR产物经1%琼脂糖凝胶电泳检测。
1.2.6 测序与分析
将3对引物扩增获得的PCR产物送至苏州金唯智生物公司测序。运用SeqMan软件对产物序列进行分析、拼接、剪切,获得各毒株完整的S基因序列。选择GenBank中代表性PEDV毒株S基因,毒株及序列号见表3。应用MEGA 6.0软件与测序毒株S基因序列进行比较分析并建立遗传进化树。用MegAlign软件对S基因进行核苷酸序列一致性分析(Clustal W法),同时推导S基因编码蛋白的氨基酸序列,分析比较PEDV不同毒株的遗传变异性。
表3 PEDV参考毒株序列信息
2 结果
2.1 临床病料PEDV特异性RT-PCR检测
对732份腹泻样本进行PEDV特异性RT-PCR扩增,结果489份样本出现315 bp的DNA条带,与预期条带一致,判定为PEDV阳性,阳性率为66.80%。不同省份PEDV阳性率见表4。

表4 不同省份临床样品PEDV阳性率
2.2 PEDV S基因RT-PCR扩增
对于489份PEDV阳性样本,根据采样时间、批次、地域的不同选择样本,同一地域同一时间采集的同一批次样本选取1份样本,共选择76份样本进行S基因扩增。应用3对引物分别获得长度约为1 770、1 610、1 556 bp的DNA条带,与预期条带一致(见图2)。

M. DL2000 DNA Marker;1~3. 代表引物对ORF1b-F+SR1、引物对SF2+SR2和引物对SF3+ORF3-R的RT-PCR产物。
2.3 PEDV S基因序列分析
将获得的上述PCR产物测序,并运用SeqMan软件对扩增的3段基因片段进行拼接与剪切,共获得76株完整PEDV毒株的S基因序列(详见表5)。其中,49株S基因序列全长为4 161 bp;20株全长为4 158 bp;5株(BJ20-2021株、JSYC23-2020株、ZJQZ15-2021株、FJFZA-2020株、SCLS3-2021株)全长为4 149 bp。推导出S基因分别编码1 386、1 385和1 382个氨基酸。此外,有2株S基因全长为4 170 bp(GXNN14-2021株)和4 155 bp(FJFZD-2020株),不同于其他毒株序列。不同毒株之间的S基因核苷酸序列一致性为93.9%~100%,S基因编码氨基酸序列一致性为93.7%~100%。

表5 PEDV测序毒株S基因序列信息
2.4 PEDV S基因遗传进化分析
参考GenBank收录的毒株序列的S基因,对获得的76个毒株序列进行系统发育树构建和分析。结果显示(图3),与国内外参考毒株相比,有5个测序毒株(BJ20-2021株、JSYC23-2020株、ZJQZ15-2021株、FJFZA-2020株、SCLS3-2021株)与S-INDEL型毒株序列处同一进化分支,属于S-INDEL型,其余71个测序毒株与GⅡb型毒株序列处同一大的进化分支,属于GⅡb型。这些毒株序列与2010年以后的流行株核苷酸一致性为96.8%~99.4%,亲缘关系较近,与早期分离的GⅠ型毒株核苷酸一致性为92.1%~95.0%,亲缘关系较远。
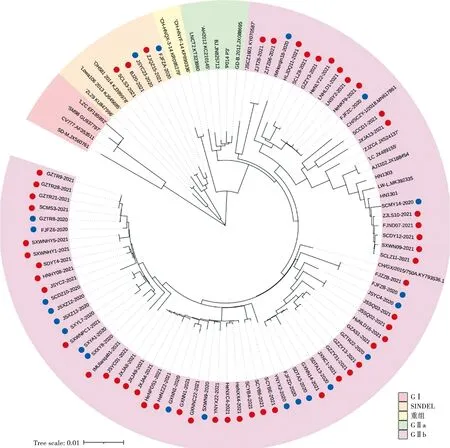
注:蓝色标记代表2020年获得的毒株序列;红色标记代表2021年获得的毒株序列。
整体来看,全国各地PEDV毒株流行趋势呈散在流行,其主要流行毒株为GⅡb型,其次是S-INDEL型。从同一地区、不同时间采集的样本来看,同一省份内的流行毒株S基因序列存在不同程度的变异情况。如贵州省铜仁市,从2020—2021年间共获得5株毒株序列,其中2020年的2株核苷酸序列(GZTR8-2020和GZTR22-2020)处不同的进化分支,其核苷酸序列一致性为98.4%;2021年3株核苷酸序列(GZTR9-2021、GZTR21-2021和GZTR28-2021)处同一进化分支,核苷酸序列一致性为100%。2020年的一株(GZTR22-2020)核苷酸序列与2021年贵州安顺市的毒株序列处同一进化分支,其核苷酸一致性为99.8%,而另一株(GZTR8-2020株)的核苷酸序列与2021年贵州铜仁市的3个毒株序列遗传距离较近,其核苷酸一致性为99.9%。另外,江苏省盐城市,在2020年获得2株核苷酸序列,2021年获得2株核苷酸序列,其中2020年获得的一株毒株(JSYC23-2020株)的核苷酸序列与S-INDEL型处同一进化分支,与S-INDEL型中的OH581株的核苷酸一致性为97.6%;另外3株(JSYC4-2020、JSYC2-2021和JSYC01-2021)核苷酸序列处于不同小分支,其核苷酸序列一致性为在98.5%~99.2%。详见图4。
2.5 PEDV S蛋白中和表位分析
根据S基因序列,通过软件推导76株PEDV S基因编码的氨基酸序列,并与CV777株进行比较进行。PEDV S蛋白中和表位COE(499~638aa)、SS2(748~755aa)、SS6(764~771aa)和2C10(1 368~1 374aa)。结果表明(见表6和图5),76株PEDV S蛋白的SS2(748~755aa)中和表位氨基酸序列非常保守;75株PEDV S蛋白的2C10(1 368~1 374aa)中和表位氨基酸序列保守,而另1株(FJND07-2021株)在该中和表位1 373位氨基酸存在突变(Y1373C);75株PEDV S蛋白的SS6(aa 764-771)中和表位氨基酸序列由SQYGQVKI突变为SQSGQVKI,1株(FJFZA-2020)由SQYGQVKI突变为SQSGQVKV;76株PEDV S蛋白中和表位COE(499~638aa)区域有8个氨基酸位点的一致性突变(A517S、V527I、S523G、T549S、G594S、A605E、L612F、T635V),而在521aa位点存在5种突变形式,67条氨基酸序列由L突变H,3条氨基酸序列由L突变Y,3条氨基酸序列由L突变P,2条氨基酸序列由L突变Q,1条氨基酸序列由L突变R。
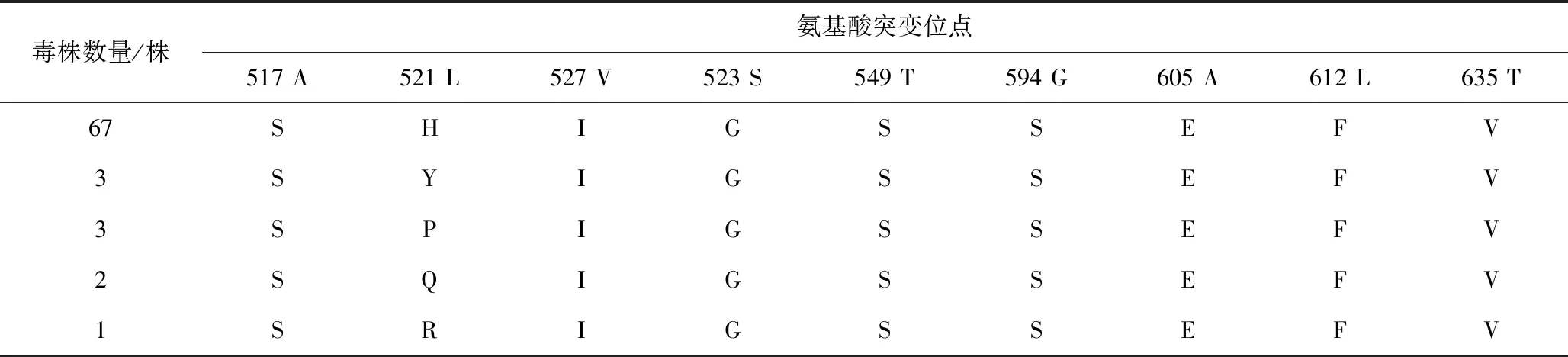
表6 PEDV S蛋白中和表位COE主要氨基酸位点突变
此外,将76株测序毒株与LW-L株(GⅡ型疫苗代表株)进行中和表位区域氨基酸序列的比较分析,结果显示:76株PEDV S蛋白中和表位SS6和SS2区域氨基酸序列非常保守;75株中和表位2C10区域非常保守,1株(FJND07-2021株)在该中和表位1373位氨基酸存在突变(Y1373C);76株PEDV S蛋白中和表位COE(499~638aa)中有1个氨基酸位点的一致性突变A517S,521aa位点存在4种突变形式,67条氨基酸序列保持一致,3条氨基酸序列由H突变Y,3条氨基酸序列由H突变P,2条氨基酸序列由H突变Q,1条氨基酸序列由H突变R。而523aa、527aa、549aa、594aa、605aa、612aa和635aa位点均未发生突变。
2.6 PEDV S蛋白氨基酸位点分析
对76株PEDV毒株S基因编码的氨基酸序列分析(图6),结果显示,与CV777株相比,71株在59~60位氨基酸之间存在4个氨基酸(QGVN)插入,在139~140位氨基酸之间存在1个氨基酸(N)的插入,在154~157位氨基酸处存在2个氨基酸的缺失;5株与S INDEL型以及CV777株表现出几处相同的遗传标记且在139位氨基酸处存在1个氨基酸的缺失;此外,FJFZD-2020株与LW-L株具有相同的遗传标记,在55~58位氨基酸之间存在2个氨基酸的缺失;GXNN14-2021株在375~376位氨基酸之间存在3个氨基酸(GGE)的插入;ZJLS10-2021株在1 264~1 265位氨基酸之间存在一个氨基酸(Ⅰ)的插入。GⅡ型流行毒株间比较发现,有20株GⅡ型田间株(S基因全长为4 158 bp,代表株为FJND07-2021)在1 193~1 194位氨基酸之间存在1个氨基酸的缺失。

注:“-”表示氨基酸缺失;“.”表示氨基酸相同;红色方框表示测序毒株与PEDV不同基因型代表株的差异。
与GⅡ型疫苗株AJ1102株、LW-L株相比,全长大小为4 149 bp的5株毒株氨基酸序列,在137~140位氨基酸之间存在2个氨基酸的缺失。
3 讨论
近年来,PEDV的持续流行对中国养猪业造成严重的经济损失。现有的措施如疫苗接种、生物安全,均无法有效阻止PEDV的传播。Zhang等[11]2016—2017年对国内6个省市的116份样品进行PEDV、猪冠状病毒(PDCoV)、猪传染性胃肠类病毒(TGEV)、猪柯布病毒(PKV)核酸检测,结果显示几种腹泻类病原的阳性率依次为52.6%、0.00%、0.00%、19.8%,PEDV阳性率最高。Su等[12]2015—2017年在国内22个省市开展PED流行病学调查结果显示,PEDV阳性率最高。本试验对2020—2021年采集的732份腹泻样品进行PEDV测定,也同时进行了猪轮状病毒(PRoV)、PDCoV、TGEV和猪急性腹泻综合征病毒(SADS-CoV)核酸检测,结果显示PEDV核酸阳性率最高,说明PEDV是影响猪群腹泻的主要病原,其次是PRoV和PDCoV。此外,本试验结果也从另一个方面提示PEDV毒株仍在高度变异,且PEDV商品化腹泻疫苗不能提供完全免疫保护。
PEDV S基因是主要的抗原变异基因,负责诱导机体产生中和抗体、与受体结合和细胞融合。S基因高度的遗传变异性,特别是S1结构域的N端区域,通常被认为是S基因遗传变异的重要分子特征[7,13-15]。S蛋白的缺失、插入或突变可能与病毒的致病性和组织嗜性有关[16]。对PEDV的S蛋白分析表明,其N端的氨基酸突变、插入和缺失可能导致GⅡ型毒株的毒力增加,也使得GⅠ疫苗株无法保护猪免受PEDV侵害[17-19]。
本研究扩增得到76株S基因序列,这些毒株之间S基因核苷酸序列一致性为93.9%~100%,S基因编码氨基酸序列一致性为93.7%~100%,其中71株为GⅡb型,5株为S-INDEL型,表明2020—2021年中国流行的PEDV毒株类型为GⅡb型。另外,对同一城市、不同时间流行毒株的S基因序列分析表明,2021年贵州铜仁毒株序列核苷酸一致性为100%,2020年贵州铜仁的2株毒株序列与2021年存在差异,提示这可能与病料的来源、地域、猪群的来源有关。与CV777株相比,获得的76个毒株中有71株PEDV S蛋白氨基酸序列N端存在4个氨基酸的插入和1个氨基酸的插入,以及2个氨基酸的缺失,这与文献[7-20]报道一致;与S-INDEL型相比,位于S-INDEL型分支的毒株氨基酸序列除与S-INDEL具有相同的遗传特征外,在S蛋白N端多处存在氨基酸突变且在139~140位氨基酸处有1个氨基酸的缺失,提示中国本土S-INDEL型在选择压力下可能发生变异。对PEDV S蛋白4个中和表位分析发现COE(499~638aa)区域易发生氨基酸突变,这可能是GⅠ型疫苗不能对机体提供免疫保护的原因。
这些氨基酸的变化可能对病毒的抗原性产生影响,导致免疫逃逸和免疫失败。除了文献报道的常见氨基酸缺失和氨基酸插入之外,本试验发现ZJLS10-2021株与其他亚群代表株相比,在1 264~1 265位氨基酸之间存在1个氨基酸(I)的插入。目前对于这些氨基酸突变对病毒抗原性和致病性的研究还未知。这些数据表明PEDV S基因仍在高度变异,仅针对某一毒株类型的疫苗无法对机体提供高效的免疫保护,目前研发新型有效疫苗用于猪PED的防控是当务之急。
4 结论
本研究检测2020—2021年采集的732份腹泻病料,PEDV核酸阳性率为66.80%;共获得76株PEDV S基因序列,序列分析表明71株属于GⅡb型,5株属于S-INDEL型;S蛋白氨基酸序列分析表明,与CV777疫苗株相比,这些毒株N端多处存在氨基酸突变、插入或缺失。本研究结果为进一步监测和分析引起我国猪群腹泻的原因,追踪溯源PEDV传播的途径和遗传变异规律提供了有力的数据支持,同时为猪腹泻病的防控和疫苗研发提供理论和技术参考。

