芝麻酚通过AMPK信号通路调控巨噬细胞极化减轻脂肪组织炎症
刘 瞩,程明慧,张劝劝,秦 虹
(中南大学湘雅公共卫生学院营养与食品卫生学教研室,湖南 长沙 410078)
随着生活水平的提高,肥胖患者数量日益增加。研究表明,慢性炎症是Ⅱ型糖尿病、高血脂及心血管疾病等多种肥胖相关代谢性疾病发病的关键因素[1]。脂肪组织作为与肥胖最密切相关的器官,是慢性炎症的主要来源。因此,开发减轻脂肪组织炎症的药物对防治肥胖及其相关代谢性疾病具有重要意义。
巨噬细胞是慢性炎症中浸润脂肪组织的主要免疫细胞,在脂肪组织炎症的发生发展中扮演核心角色[2]。巨噬细胞根据微环境不同可极化为促炎M1型和抗炎M2型。健康小鼠的脂肪组织巨噬细胞主要表现为M2型,而在高脂饮食诱导的肥胖小鼠脂肪组织中,巨噬细胞发生M1型向M2型的转化,M1型巨噬细胞基因大量表达[3]。M1型巨噬细胞是炎症因子的主要来源,促进炎症的发生发展;M2型巨噬细胞分泌抗炎因子,拮抗炎症反应[4]。调控巨噬细胞M1/M2型极化正成为治疗多种炎症相关代谢性疾病的新型策略[5]。腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)是一种酶复合体,在巨噬细胞极化和炎症发生发展中都发挥重要作用。有研究提示,激活AMPK信号通路不仅可抑制肥胖小鼠脂肪组织中巨噬细胞的浸润、减轻炎症反应,还可抑制巨噬细胞M1型极化[6-7]。因此,寻找可激活巨噬细胞AMPK的药物,将为防治炎症相关代谢性疾病提供新的策略。
芝麻酚(sesamol,SEM)是一种从芝麻中提取的具有一个酚环结构的小分子天然木脂素,具有广泛的药理作用,如可通过抑制小胶质细胞中离子钙结合衔接分子1的激活缓解小鼠神经炎症[8]、可通过抑制IKKα/NF-κB信号通路减轻肾脏炎症并阻止巨噬细胞浸润[9]等。因此,SEM在减轻脂肪组织关炎症方面可能也具有较高的药用价值,值得深入探索。本课题组前期研究证实,SEM可激活肝脏和骨骼肌中的AMPK蛋白[10-11],显著减轻肥胖相关病理反应。目前,SEM对肥胖相关脂肪组织炎症的影响及作用机制尚不清楚,我们推测SEM可能通过激活AMPK通路调控巨噬细胞极化减轻脂肪组织炎症。本研究首先利用高脂饮食(high fat diet,HFD)诱导肥胖小鼠模型,观察到SEM可减轻脂肪组织炎症反应,再体外采用脂多糖(lipopolysaccharide,LPS)建立炎症细胞模型,探讨SEM对巨噬细胞极化的具体调控机制,为SEM的抗炎作用提供理论依据和实验基础。

Fig 1 The chemical structure of sesamol
1 材料与方法
1.1 实验动物及细胞8周SPF级雄性C57BL/6J小鼠购于湖南斯莱克景达实验动物有限公司;RAW264.7细胞系购于中国科学院细胞库(TCM13)。
1.2 实验材料SEM(S3003,美国Sigma公司);普通小鼠饲料(D12450J,北京科澳协力饲料有限公司,含10%脂肪),高脂小鼠饲料(D12492J,北京科澳协力饲料有限公司,含60%脂肪);LPS(L2880,美国Sigma公司),compound C(HY-13418A,美国MCE公司),BCA试剂盒(南京建成公司),白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒(ml00285,上海酶联生物科技有限公司),白细胞介素-10(interleukin-10,IL-10)ELISA试剂盒(ml063159,上海酶联生物科技有限公司)、单核细胞趋化因子-1(monocyte chemotactic protein,MCP-1)ELISA试剂盒(ml037840,上海酶联生物科技有限公司)、肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)ELISA试剂盒(ml002095,上海酶联生物科技有限公司),兔抗p-AMPK(AF3423,Affinity)和AMPK(ER62660,杭州华安生物技术有限公司),核因子κB(nuclear factor kappa-B,NF-κB)(et1603-12,杭州华安生物技术有限公司),过氧化物酶体增殖物激活受体γ共激活剂-1α(peroxisome proliferator-activated receptor gamma coactivator -1alpha,PGC-1α)(A19674 ,ABclonal),CD11c(cluster of differentiation 11c,CD11c)(DF7583,Affinity)、CD206(cluster of differentiation 206,CD206)(DF4149,Affinity),GAPDH(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(ET1601-4,杭州华安生物技术有限公司)。
1.3 主要仪器Azure 600多功能荧光成像系统(美国Azure Biosystems),全波长酶标仪(美国 Thermo Fisher Scientific);超高速冷冻离心机(美国 Sci Logex)。
1.4 动物分组及干预将42只8周龄雄性C57BL/6J小鼠置于20~24 ℃,40%~60% 湿度,12 h光/暗交替循环的环境条件下喂养,自由进食和饮水。适应性喂养1周后随机将其中12只小鼠作为对照组(CON组),喂养普通小鼠饲料,其余小鼠喂养高脂小鼠饲料。13周后肥胖模型造模成功(以超过对照组小鼠平均体质量的20%作为成模标准),将小鼠随机分为高脂组(HFD组)和SEM干预组(SEM组),每组12只。CON组和HFD组每天给予 0.5%羧甲基纤维素钠灌胃,SEM组每天给予SEM(0.5%羧甲基纤维素钠混悬配制)灌胃,剂量为100 mg·kg-1,8周后,摘眼球取血,颈椎脱臼处死小鼠,剖取附睾脂肪组织样本于-80 ℃冰箱分装保存。实验方案通过中南大学湘雅公共卫生学院伦理委员会审批(批准文号:XYGW-2021-75)。
1.5 细胞培养将RAW264.7巨噬细胞接种于RPMI 1640培养基(含10%胎牛血清),置于37 ℃、5%CO2条件下培养。待细胞融合度近70%时采取如下处理:空白对照组(CON组,RPMI 1640培养基培养)、模型对照组(LPS组,100 μg·L-1LPS处理24 h)、SEM低剂量(LPS+6.25 μmol·L-1SEM组,100 μg·L-1LPS处理24 h,并用 6.25 μmol·L-1SEM干预)、SEM高剂量干预组(LPS+25 μmol·L-1SEM组,100 μg·L-1LPS处理24 h,并用25 μmol·L-1SEM干预)、AMPK抑制剂组(LPS+25 μmol·L-1SEM+CC组,预先用AMPK抑制剂compound C 5 μmol·L-1处理2 h,余同LPS+25 μmol·L-1SEM组)。
1.6 MTT法测定细胞毒性作用取对数生长期RAW264.7巨噬细胞,以每孔2×104个的密度接种于96孔板,培养24 h后弃上清,并分别设置空白调零组、正常对照组和给药组。给药组包括3组药物,第1组加入SEM(3.125~100 μmol·L-1),第2组加入LPS(12.5~400 μg·L-1),第3组加入适宜浓度LPS及SEM(3.125~100 μmol·L-1),每个浓度设置5个复孔,培养结束后每孔加入10 μL MTT溶液(5 g·L-1),于培养箱继续孵育4 h后,轻轻弃去上清,每孔加入150 μL二甲基亚砜,置于摇床上振荡使甲瓒结晶充分溶解,采用酶标仪于 490 nm波长处检测各孔吸光度值,并计算细胞存活率。

1.7 ELISA法检测趋化因子、炎症因子和抗炎因子表达将血液于室温凝固20 min,4 ℃ 3 000 r·min-1离心20 min,收集血清;将附睾脂肪组织(epididymal adipose tissue,eWAT)和 PBS以1 mg ∶9 μL(m组织∶VPBS)的比例制成脂肪组织匀浆,4 ℃ 3 000 r·min-1离心20 min,收集上清;收集RAW264.7巨噬细胞培养液,4 ℃ 3 000 r·min-1离心20 min,收集细胞上清。将上述样品按照MCP-1、IL-6、TNF-α、IL-10试剂盒说明书进行浓度测定。
1.8 Western blot检测相关蛋白表达以磷酸化蛋白酶抑制剂PMSF ∶RIPA裂解液=2 ∶1 ∶97的比例配置裂解液,裂解附睾脂肪组织和干预结束后的 RAW264.7巨噬细胞。采用BCA法检测蛋白浓度后进行蛋白变性。上样后电泳完成蛋白分离,将蛋白湿转于NC膜上,并用5%脱脂牛奶于室温下封闭1 h,敷一抗后于4 ℃ 冰箱过夜,洗膜后敷二抗于37 ℃ 孵育1 h,经ECL化学发光并用显影仪进行显影,应用ImageJ软件分析附睾脂肪组织中CD11c及RAW264.7巨噬细胞中的AMPK、p-AMPK、PGC-1α、NF-κB、CD11c、CD206蛋白的相对表达量,用GraphPad Prism 8.0作图。

2 结果
2.1 SEM减轻肥胖小鼠炎症反应炎症反应中,常伴随大量炎症因子的产生。因此,我们应用ELISA法检测各组小鼠血清及附睾脂肪组织中的炎症因子IL-6、TNF-α和抗炎因子IL-10的分泌水平。如Fig 2所示,与 CON组相比,HFD组血清和附睾脂肪组织中的炎症因子IL-6和TNF-α分泌均明显上升,抗炎因子IL-10明显下降;而与HFD组相比,SEM组中的IL-6、TNF-α分泌水平明显降低,IL-10分泌却有明显增多。这表明,SEM能够减轻肥胖小鼠炎症反应。

Fig 2 Inflammation of obese mice alleviated
2.2 SEM抑制肥胖小鼠脂肪组织巨噬细胞M1型极化巨噬细胞作为脂肪组织中占比最多的免疫细胞,与脂肪组织炎症的发生发展有着密切关系。为了明确SEM的抗炎机制,我们检测了其对趋化因子MCP-1分泌水平、脂肪组织巨噬细胞中M1型极化标志物CD11c蛋白表达的影响。如Fig 3A所示,与CON组相比,HFD组中的小鼠血清和附睾脂肪组织中巨噬细胞趋化因子 MCP-1升高,而SEM干预后,MCP-1明显下降。MCP-1的分泌与M1型巨噬细胞的激活密切相关,因此,我们检测了脂肪组织中M1型巨噬细胞标志物CD11c的含量。如Fig 3B所示,与CON组相比,HFD组中的CD11c蛋白含量明显增加;与HFD组相比,SEM组的CD11c蛋白明显降低。这提示,SEM通过抑制脂肪组织中巨噬细胞M1型极化发挥抗炎作用。
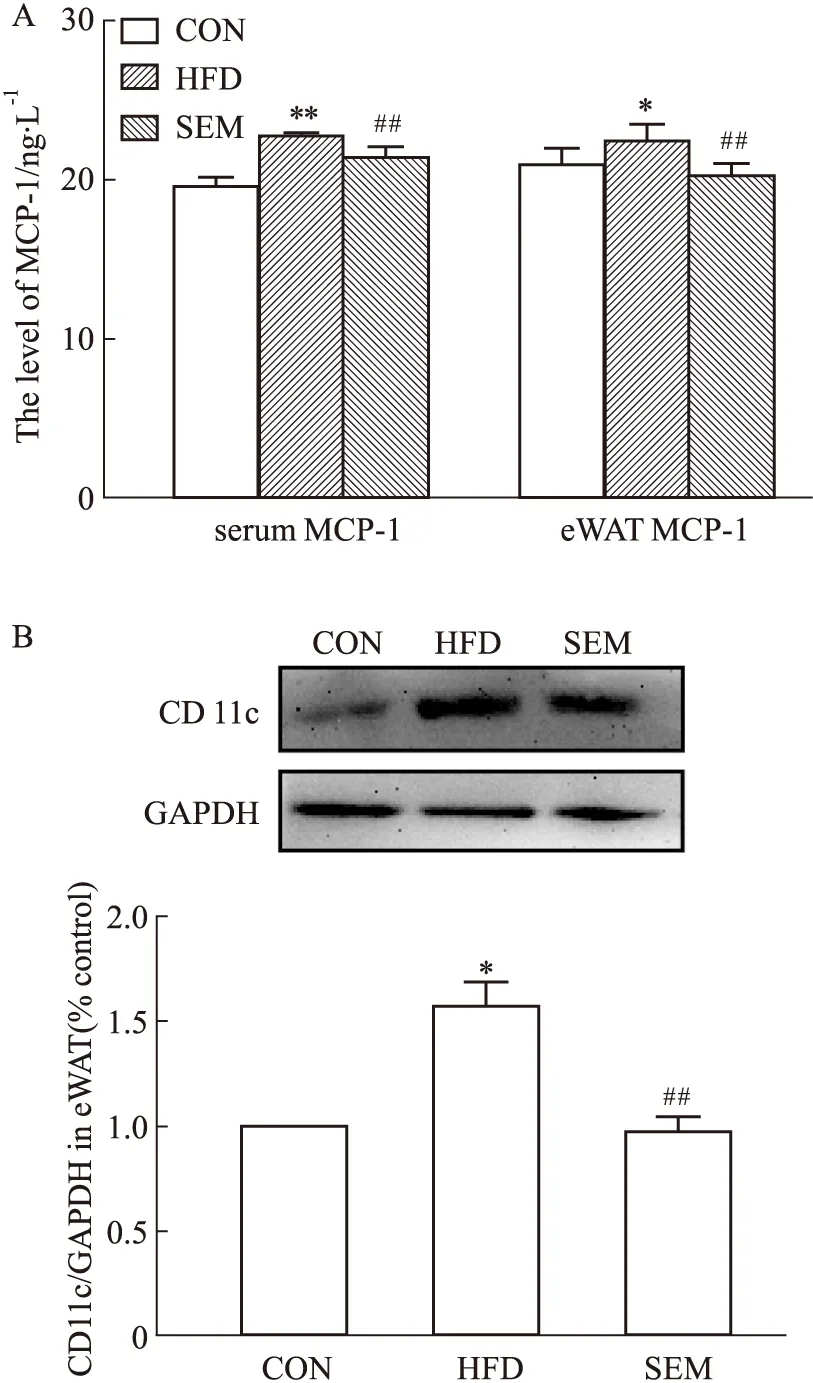
Fig 3 M1 polarization of adipose tissue macrophages
2.3 SEM及LPS对RAW264.7巨噬细胞的毒性作用为了验证推测,我们利用RAW264.7巨噬细胞进一步探索SEM抗炎作用的机制。首先,我们检测了SEM、LPS对RAW264.7巨噬细胞的细胞毒性作用。MTT结果如Fig 4A所示,SEM以不同浓度作用RAW264.7巨噬细胞24 h后,在3.125~50 μmol·L-1时不影响RAW264.7巨噬细胞活性。如Fig 4B所示,用不同浓度LPS作用于RAW264.7巨噬细胞24 h后,细胞活力与对照组相比均无显著性差异,我们选择100 μg·L-1LPS 进行后续实验。接下来,我们检测SEM与100 μg·L-1LPS同时孵育时对RAW264.7巨噬细胞的细胞毒性作用,如Fig 4C所示,SEM浓度小于50 μmol·L-1时,RAW264.7巨噬细胞活性与对照组相比差异无统计学意义。因此,后续实验采用100 μg·L-1LPS及6.25 μmol·L-1、25 μmol·L-1SEM进行。
2.4 SEM可激活巨噬细胞AMPK信号通路AMPK参与调控巨噬细胞炎症反应及极化,我们之前的研究证明,SEM可调节肝脏和骨骼肌中的AMPK,因此推测SEM可能通过激活巨噬细胞AMPK调控巨噬细胞极化从而发挥抗炎作用。我们利用LPS刺激的RAW264.7巨噬细胞诱导出炎症细胞模型,检测细胞中AMPK、p-AMPK的蛋白含量。如Fig 5A所示 ,LPS抑制了RAW264.7细胞中p-AMPK的表达,而SEM可明显减轻这种抑制,说明SEM可能对巨噬细胞AMPK信号通路有激活作用。接下来,我们检测了 AMPK下游通路蛋白NF-κB和PGC-1α的蛋白含量,并利用AMPK抑制剂 compound C进行验证。结果如Fig 5B所示,与空白对照组(CON组)相比,炎症模型组(LPS组)细胞中AMPK下游蛋白PGC-1α蛋白量下调,NF-κB明显上调;而较LPS组而言,6.25 μmol·L-1和 25 μmol·L-1的SEM干预均能使 NF-κB 蛋白量降低,并且 25 μmol·L-1SEM还能促进 PGC-1α 明显升高;在给予 AMPK 抑制剂 compound C后,SEM对巨噬细胞 AMPK信号通路相关蛋白的调控作用明显减弱。结果表明,SEM对巨噬细胞 AMPK信号通路具有激活作用。
2.5 SEM调控巨噬细胞极化与AMPK信号通路相关为了探究SEM调控巨噬细胞极化的效果和机制,我们检测了M1型巨噬细胞极化标志物CD11c和M2型巨噬细胞极化标志物CD206蛋白含量。如Fig 6A所示,与Control组相比,LPS组CD11c有明显升高、CD206明显下降;与LPS组相比,SEM剂量依赖性降低巨噬细胞中的CD11c,提高 CD206蛋白量;而给予AMPK抑制剂后,SEM的上述作用被逆转。这说明SEM能够抑制巨噬细胞的M1型极化、促进M2型极化,并且AMPK信号通路在这个过程中发挥了重要作用。接下来,我们采用ELISA法检测M1型巨噬细胞分泌的促炎因子IL-6、TNF-α和M2型巨噬细胞分泌的抗炎因子IL-10的水平。结果如Fig 6B所示,LPS作用巨噬细胞后,IL-6和TNF-α水平上升、IL-10水平下降;在给予不同剂量的SEM后,IL-6和TNF-α均下降,其中 25 μmol·L-1SEM的作用效果更好,并且能使IL-10有显著上升;而AMPK抑制剂逆转了SEM的作用效果。这进一步说明SEM可通过激活AMPK信号通路,调控巨噬细胞M1/M2型极化,减轻炎症反应。
3 讨论
肥胖所伴随的慢性炎症是Ⅱ型糖尿病、高血压、高血脂等代谢性疾病发病的关键因素。脂肪组织是与肥胖症密切相关的器官,脂肪组织炎症在肥胖相关代谢性疾病的发生发展中起着十分重要的作用。
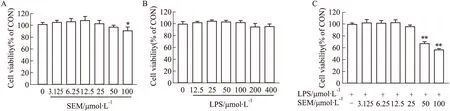
Fig 4 Effects of sesamol and LPS on cell viability of RAW264.7
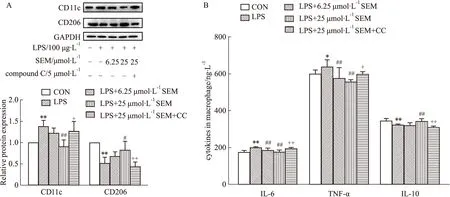
Fig 6 Macrophage polarization regulated by sesamol through AMPK signaling
本研究发现,SEM可通过调节巨噬细胞极化降低肥胖小鼠脂肪组织炎症水平,其分子机制可能是AMPK信号通路的激活。
巨噬细胞作为脂肪组织中占比最大的免疫细胞,在脂肪组织炎症反应中扮演关键角色。巨噬细胞可因微环境改变而转换为M1和M2两种亚型,M1型巨噬细胞高表达CD11c,释放大量炎症因子加重炎症反应,如IL-6、TNF-α;M2型巨噬细胞高表达CD206,可分泌抗炎因子抑制炎症发展,如IL-10[4]。检测这些特异性标志物是鉴别M1和M2巨噬细胞的常用方法。我们的研究结果发现,SEM减轻了HFD小鼠的炎症状态,主要反映在SEM干预后,小鼠血清和附睾脂肪组织中炎症因子IL-6、TNF-α的降低以及抗炎因子IL-10的增加,这可能与SEM对巨噬细胞M1/M2型的调控相关。健康状态下,脂肪组织中巨噬细胞主要表现为M2型,而肥胖患者和肥胖小鼠脂肪组织中的巨噬细胞主要呈M1型[12],活化的 M1巨噬细胞可分泌促炎因子激活炎症级联反应,形成正反馈通路,增强炎症反应。我们经过对脂肪组织中M1型巨噬细胞标志蛋白CD11c的测定,证实SEM抑制了脂肪组织巨噬细胞的M1型极化。此外,活化的 M1型巨噬细胞还可分泌趋化因子(如MCP-1)募集更多血液中的单核细胞浸润脂肪组织炎症部位[2],进入正反馈通路,放大炎症反应,加重组织损伤。因此,巨噬细胞浸润的减少,也是M1型巨噬细胞极化减少的标志之一。本研究中,我们发现,SEM明显降低血清与附睾脂肪组织中的MCP-1表达,进一步说明SEM抑制了肥胖小鼠脂肪组织中巨噬细胞的浸润、减少了M1型极化,并减轻了炎症级联反应。这与Hsu等[13]的研究结果相似,他们通过大鼠应激性溃疡模型证明了SEM减轻胃溃疡的机制之一是抑制巨噬细胞浸润胃黏膜组织。因此,我们通过建立高脂诱导的肥胖小鼠模型,观察SEM对小鼠血清、附睾脂肪组织中炎症相关因子、趋化因子及脂肪组织中M1型巨噬细胞标志物的影响,认为SEM可能调控巨噬细胞极化,减轻脂肪组织炎症。
AMPK是一种能量感应丝氨酸/苏氨酸蛋白激酶,近期有研究表明,AMPK信号通路的激活是促进巨噬细胞M1型向M2型极化和缓解炎症的关键因素[6,14]。我们先前的研究证明,SEM可激活肝脏和骨骼肌中的AMPK[10-11],因此,推测SEM可能通过激活AMPK信号通路来调控巨噬细胞极化从而发挥抗炎效应。本实验观察到,SEM增强了炎症状态下巨噬细胞p-AMPK的表达,激活了AMPK蛋白。有研究提示,AMPK发挥调控巨噬细胞极化作用的机制可能是通过上调PGC-1α的表达、降低NF-κB的表达[15-16]。PGC-1α是一种转录共激活因子,可降低炎症因子的产生,同时它也是线粒体功能的主要调节因子,可通过激活线粒体功能增强巨噬细胞氧化磷酸化,促进巨噬细胞向M2型极化[17]。NF-κB也被证实是一种十分重要的炎症反应通路蛋白,是M1型巨噬细胞激活过程的关键转录因子之一,降低NF-κB可抑制M1 型巨噬细胞极化[18]。通过本研究我们发现,SEM可以增加巨噬细胞中PGC-1α蛋白、减少NF-κB蛋白表达,而AMPK的特异性抑制剂能够逆转SEM的这些作用。这进一步验证了SEM对巨噬细胞AMPK 信号通路的激活作用。并且,炎症状态下的巨噬细胞被施与AMPK抑制剂后,SEM降低CD11c、 IL-6、TNF-α,增加CD206、IL-10水平等作用均被逆转。因此,我们的实验结果证明了SEM可以通过激活AMPK信号通路,调节巨噬细胞M1/M2极化以发挥抗炎作用。
综上所述,本研究利用肥胖小鼠模型和炎症细胞模型,发现SEM减轻脂肪组织炎症反应与其对巨噬细胞极化的调控密切相关,其分子机制可能是激活了AMPK信号通路。本研究可为SEM在减轻肥胖相关炎症的临床应用上提供理论基础,为SEM作为抗炎药物的研发提供帮助。

