复方苦参注射液对乙肝相关肝细胞癌患者化疗效果及T细胞免疫的影响
吕新远,戴兵,刘驰
南阳市中心医院普通外科肝脏病区,南阳 473000
我国肝细胞癌(hepatocellular carcinoma,HCC)约占原发性肝癌的90%,其中约80%以上HCC主要由乙型肝炎病毒(hepatitis B virus,HBV)感染所致[1]。多数HCC患者在疾病进展到中晚期时,才会出现肝区疼痛、肝大、腹水等典型症状,此时已无法进行外科手术治疗,只能采用非手术治疗[2]。随着血管介入放射学的发展,介入治疗技术以其微创、快速、安全和有效等优势,在心脑血管、外周血管、肿瘤等领域取得了飞速发展。经导管动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)术是介入放射学最重要的基本技术之一,更是肝癌非手术治疗的首选方法,但长期使用化疗药物可能出现药物不良反应,影响患者预后[3]。中医药在防治放化疗后的不良反应方面积累了丰富的临床经验,部分学者认为化疗药物药性多峻烈,易困脾伤胃,脾失健运,胃失和降,运化失职[4]。在治疗癌症的过程中,中医药在不同阶段可起到促进康复、抗复发转移、增效减毒及提高生活质量等作用,现已被广泛应用于临床[5]。复方苦参注射液可清热利湿、凉血解毒、散结止痛,该药所含的苦参碱成份具有提高免疫功能的作用[6]。既往多项研究[7-8]报道,复方苦参注射液应用于肿瘤的辅助治疗,可显著提高患者的治疗效果。因此推测复方苦参注射液可能通过改善肿瘤患者的免疫功能,提高化疗效果。本研究旨在探讨复方苦参注射液对HBV相关HCC患者化疗效果及T细胞免疫功能的影响,以期为临床治疗HBV相关HCC提供更多的决策依据,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年1月~2021年12月期间于该院确诊的106例HBV相关HCC患者作为研究对象,采用随机数字表法分为对照组与观察组,每组53例。对照组:男性28例,女性25例;年龄29~77岁,平均年龄(56.21±10.64)岁;CNLC分期:Ⅱ期者13例,Ⅲ期者24例,Ⅳ期者16例;卡诺夫斯凯计分(Kanofsky performance score,KPS)评分58~88分,平均KPS评分(70.94±7.01)分。观察组:男性27例,女性26例;年龄34~75岁,平均年龄(58.28±8.89)岁;CNLC分期:Ⅱ期者14例,Ⅲ期者23例,Ⅳ期者16例;KPS评分57~84分,平均KPS评分(72.72±6.55)分。两组一般资料比较无统计学差异(P>0.05),具有可比性。本研究通过医院伦理委员会审核批准,所有患者及家属愿意配合完成本研究,并签署知情同意书。
纳入标准:①符合《原发性肝癌诊疗规范》(2017年版)[9]中HCC相关诊断标准,经影像学、病理检查确诊为HCC,且CNLC分期为Ⅱ~Ⅳ期者。②经实验室检查、病理学及影像学诊断为HBV感染者。③无法进行根治性手术治疗者。④符合TACE术适应症,且无相关禁忌症者。⑤经医生评估生存时间>3个月者。⑥年龄>18岁者。
排除标准:①存在严重心脑血管疾病者。②存在凝血功能障碍者。③存在免疫系统疾病者。④存在严重感染者。⑤对造影剂及局部麻醉药物存在严重过敏者。⑥入组前1周使用过其他类似药物治疗者。⑥未能配合完成随访者。
1.2 研究方法
所有纳入HBV相关HCC患者呈仰卧位,消毒铺巾后,对股动脉穿刺点注入盐酸利多卡因注射液(四川国瑞药业有限责任公司,国药准字H20055048,规格:10ml∶0.2g)3mg/kg进行局部麻醉,先行股动脉穿刺,置入导管于腹腔干造影见:脾动脉及肝总动脉显影,肝右叶的肿瘤造影剂浓染。将导管引至肝总动脉近端,置入微导管及微导丝,将微导管引至右肝动脉的肿瘤供血动脉内,造影证实。缓慢注射化疗药物奥沙利铂注射液[齐鲁制药(海南)有限公司,国药准字H20203218,规格:40ml∶0.2g]100mg/m2,再次造影见:供血动脉栓塞良好,未见该动脉供应肿瘤。再将导管超选至供应瘤体的肝动脉分支,用碘化油注射液(烟台鲁银药业有限公司,国药准字H37022398,规格:10ml)10~20ml加化疗药物行TACE术化疗,直至所有供血动脉栓塞完毕。于右肝动脉最后造影:未见肿瘤染色。手术结束,拔除导管,腹股沟加压包扎。每次介入治疗间隔3~4周,连续进行2次介入治疗。观察组同时静脉滴注复方苦参注射液(山西振东制药股份有限公司,国药准字Z14021231,规格:每支装5ml)20ml/次,用氯化钠注射液(辰欣药业股份有限公司,国药准字H20056758,规格:50ml∶0.45g)200ml稀释后使用,qd。在介入术前2~3天起,持续给药复方苦参注射液10天(全身用药总量200ml为1个疗程),所有患者持续2个疗程。
1.3 观察指标
1.3.1 临床疗效
治疗2个疗程后,所有入组HBV相关HCC患者参照实体瘤免疫相关疗效评价标准(immune response evaluation criteria in solid tumors,iRECIST)[10]进行临床疗效评价:①完全缓解(complete response,CR):非淋巴结病变完全消融,淋巴结短轴<10mm,无新病灶。②部分缓解(partial response,PR):肿瘤负荷减少≥30%。③疾病进展(progressive disease,PD):存在新的可测量/不可测量病变,或相对于最低点,肿瘤负荷增加≥20%。④疾病稳定(stable disease,SD):不符合CR/PR/PD标准者。客观缓解率(objective response rate,ORR,%)=(CR+PR)例数/每组总例数×100%;疾病控制率(disease control rate,DCR,%)=(CR+PR+SD)例数/每组总例数×100%。
1.3.2 Child-Pugh肝功能分级
将患者5个指标(一般状况、腹水、血清胆红素、血清白蛋白浓度及凝血酶原时间)分别记1分、2分和3分,并将5个指标计分进行相加,总和5~15分。参照《内科疾病诊断标准》(第2版)[11]中相关标准评价患者Child-Pugh肝功能分级:5~6分为A级,7~9分为B级,≥10分为C级;分值越高,表示患者的肝功能越差。
1.3.3 肝癌标志物
分别于入院后第1天及治疗2个疗程后第1天采集两组HBV相关HCC患者空腹静脉血4ml,均分为2份,1份使用7060型全自动生化分析仪[日立(中国)有限公司]检测α-L-岩藻糖苷酶(α-L-fucosidase,AFU)水平;1份使用Avanti JXN-26型高速冷冻离心机(贝克曼库尔特有限公司,r=10cm),以3000r/min于4℃离心10min后,取血清。采用化学免疫法测定两组患者血清甲胎蛋白(alpha fetoprotein,AFP)水平,试剂盒购自武汉华美生物工程有限公司。
1.3.4 免疫功能指标
分别于入院第1天及治疗2个疗程后第1天两组HBV相关HCC患者空腹静脉血2ml,使用FACSCantoⅡ分析型流式细胞仪(美国BD公司)检测患者外周血T细胞亚群CD3+细胞、CD4+细胞、CD8+细胞水平,并计算CD4+/CD8+比值。
1.3.5 不良反应发生情况
观察并记录两组HBV相关HCC患者介入治疗后不良反应(发热、头痛、恶心、呕吐、白细胞下降等)的发生情况。
1.4 统计学方法
应用SPSS 22.0软件进行数据的统计分析。计量资料以±s表示,行t检验;计数资料以n(%)表示,行χ2检验;等级资料行秩和检验。P<0.05为具有统计学差异。
2 结果
2.1 临床疗效
治疗2个疗程后,两组患者ORR比较无统计学差异(P>0.05);观察组患者DCR(86.79%)高于对照组(69.81%,P<0.05)(表1)。
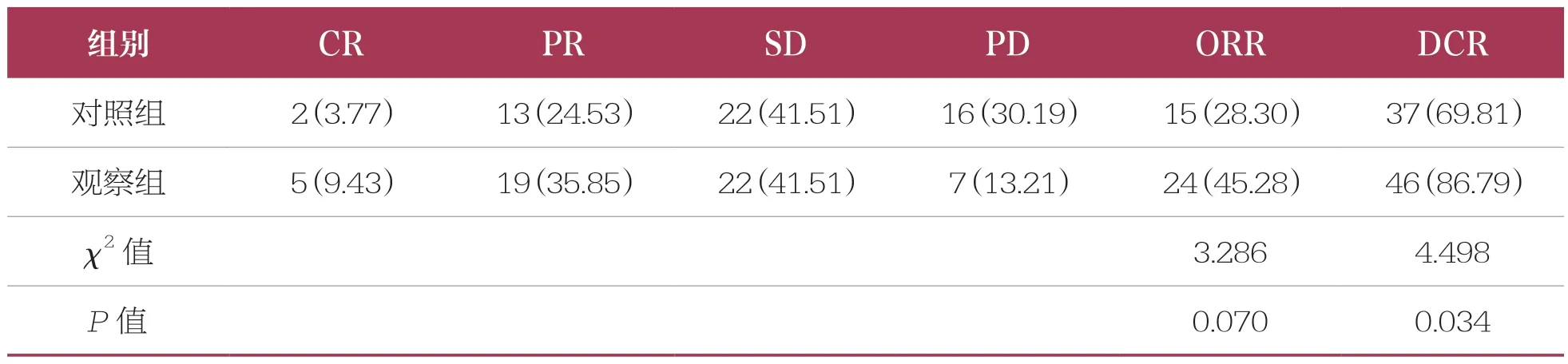
表1 两组临床疗效比较 n=53,n(%)
2.2 Child-Pugh肝功能分级
治疗前,两组Child-Pugh肝功能A级、B级比例比较无统计学差异(P>0.05);治疗后,观察组Child-Pugh肝功能分级优于对照组(P<0.05)(表2)。

表2 两组Child-Pugh肝功能分级比较 n=53,n(%)
2.3 肝癌标志物
治疗前,两组AFU、AFP水平比较均无统计学差异(P>0.05);治疗后,两组AFU、AFP均降低(P<0.05),且观察组低于对照组(P<0.05)(表3)。
表3 两组肝癌标志物比较 n=53,±s
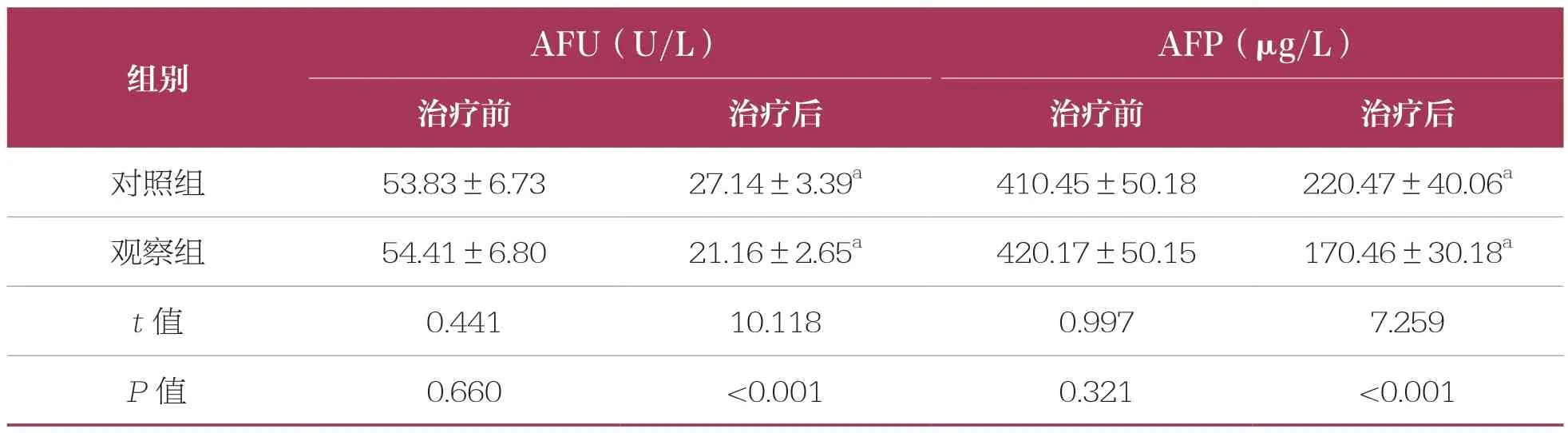
表3 两组肝癌标志物比较 n=53,±s
AFU:α-L-岩藻糖苷酶;AFP:甲胎蛋白;与同组治疗前比较,a:P<0.05。下同
AFU(U/L) AFP(μg/L)治疗前 治疗后 治疗前 治疗后对照组 53.83±6.73 27.14±3.39a 410.45±50.18 220.47±40.06a观察组 54.41±6.80 21.16±2.65a 420.17±50.15 170.46±30.18a t值 0.441 10.118 0.997 7.259 P值 0.660 <0.001 0.321 <0.001组别
2.4 免疫功能指标
治疗前,两组T细胞免疫功能指标比较均无统计学差异(P>0.05);治疗后,两组CD3+、CD4+水平及CD4+/CD8+比值均降低(P<0.05),CD8+水平升高(P<0.05)。但观察组CD3+、CD4+水平及CD4+/CD8+比值高于对照组(P<0.05),CD8+水平低于对照组(P<0.05)(表4)。
表4 两组T细胞免疫功能比较 n=53,±s

表4 两组T细胞免疫功能比较 n=53,±s
CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 59.22±9.22组别51.46±1.46a 38.66±4.58 30.02±0.02a 30.31±0.31 38.58±4.07a 1.26±0.16 0.78±0.18a观察组 58.38±8.38 0.97±0.23a t值 0.588 2.391 0.874 3.698 0.232 5.265 0.312 4.736 P值 0.558 0.019 0.384 <0.001 0.817 <0.001 0.756 <0.001 55.23±5.23a 37.89±4.49 33.15±3.15a 30.12±0.12 34.24±4.41a 1.27±0.17
2.5 不良反应发生情况
对照组患者介入治疗术后出现发热、头痛、恶心及呕吐各2例,白细胞下降6例;观察组患者介入治疗术后出现发热、恶心及呕吐各2例。观察组不良反应发生率(11.32%)低于对照组(26.42%,χ2=3.944,P=0.047)。
3 讨论
全球范围内,肝癌的发病率呈持续上升趋势,其在恶性肿瘤死亡风险排名中居前5位。HBV感染是全球性的公共卫生问题,全球有超过2.5亿的HBV感染者,20%以上的HCC患者发病原因都与HBV相关[12]。由于HCC发病隐匿,病情进展较快,往往确诊时已发展至中晚期,多数患者已无法耐受手术治疗,只能选择化疗方式延长生存时间。TACE属于一种微创介入化疗手段,在临床上不仅可用于治疗肝脏出血,也可用于治疗HCC。既往研究[13]报道,TACE治疗HCC具有较好的近期疗效。但同时也有研究[14]报道,TACE治疗后,多数患者出现发热、肝区疼痛等栓塞后综合征问题,不利于患者预后。近年来,中西医结合在中晚期恶性肿瘤的临床研究取得了一定的成果,并在延缓疾病进展、减轻化疗不良反应等方面具有显著效果[15]。复方苦参注射液是临床常用的抗肿瘤类中药注射剂,主要成份为苦参和白土苓。苦参性寒、味苦,具有清热燥湿的功效;白土苓性平,味甘、淡,具有解毒、除湿、通利关节的功效。研究表明,复方苦参注射液对乙型肝炎和肝癌具有一定的治疗作用[16-17]。本研究结果发现,观察组患者DCR(86.79%)高于对照组(69.81%,P<0.05),提示复方苦参注射液联合TACE辅助治疗HBV相关HCC,可有效提高患者的化疗效果。
既往研究[18]报道,TACE可能会造成肝损伤。本研究结果发现,经治疗后,观察组Child-Pugh肝功能分级优于对照组(P<0.05),提示复方苦参注射液联合TACE辅助治疗HBV相关HCC,可缓解TACE造成的肝损伤,对肝脏具有一定的保护作用。分析其原因可能为苦参的主要药理成份苦参碱具有降酶护肝、抗肝纤维化等药理作用[19]。
由于肝癌患者外周血AFU水平明显升高,因此其被认为是肝癌的肿瘤标记物[20]。AFP是一种糖蛋白,肝癌细胞可大量分泌AFP,因此也被认为是肝癌的肿瘤标记物[21]。本研究结果发现,经治疗后,观察组AFU、AFP水平低于对照组(P<0.05),提示复方苦参注射液可与化疗药物产生协同作用,更好地控制肿瘤患者的病情进展,但其可能的作用机制尚未明确,后期仍需进行深入研究以进一步分析其作用机制。
肝癌患者体内T细胞免疫功能被抑制,从而使患者发生免疫功能障碍[22]。CD3+淋巴细胞代表全T淋巴细胞,其包括CD4+和CD8+;CD4+水平降低表明机体免疫功能低下,CD8+水平升高表明机体免疫功能低下。既往研究[23]报道,复方苦参注射液辅助治疗,可有效改善晚期肿瘤患者的免疫功能。本研究中,经治疗后,两组CD3+、CD4+水平及CD4+/CD8+比值均降低(P<0.05),CD8+水平升高(P<0.05),但观察组CD3+、CD4+水平及CD4+/CD8+比值高于对照组(P<0.05),CD8+水平低于对照组(P<0.05)。此外,本研究结果显示,观察组不良反应发生率(11.32%)低于对照组(26.42%,χ2=3.944,P=0.047)。以上结果提示复方苦参注射液联合TACE辅助治疗HBV相关HCC,可有效缓解化疗导致的免疫功能损伤,减少不良反应的发生风险,分析可能与复方苦参注射液的主要药理成份可提高机体免疫力有关[24-25]。
综上所述,复方苦参注射液辅助TACE治疗HBV相关HCC,可提高患者化疗效果,调节患者T细胞免疫功能,降低不良反应的发生率。然而,本研究仍存在一定的局限性,如纳入样本量较少,且为单中心研究,可能会存在一定的数据偏倚,后期仍需进一步采用多中心、大样本试验进行深入探究。

