瑞戈非尼通过CSF1-R 信号通路调节肿瘤相关巨噬细胞增强PD-1 抗体在结直肠癌中疗效的研究
苏燕燕 杨 翀 张宗祥 叶 宇 应佳可
结直肠癌(colorectal cancer,CRC)是全球最常见的癌症之一,约占全球新癌症病例的10%,病死率约为50%,严重威胁人类健康[1]。近年来,免疫检查点抑制剂治疗恶性肿瘤在临床上展现出了不错的疗效和巨大的前景。靶向程序性细胞死亡蛋白1(programmed death-1,PD-1)的免疫检查点抑制剂已被用于具有DNA 错配修复缺陷及高水平的微卫星不稳定性的CRC 患者,但肿瘤中存在的多种免疫抑制严重限制了其治疗效果[2]。联合应用具有免疫抑制微环境调节功能的药物有望提高免疫检查点抑制剂在CRC 中的疗效。瑞戈非尼(Regorafenib,Reg)作为CRC 多激酶小分子抑制剂,具有和PD-1 抗体(PD-1 antibody,anti-PD-1)联合应用的可能性,但其疗效以及作用机制鲜有报道。因此,本研究主要探讨Reg 对anti-PD-1 在CRC 中疗效的影响及机制,现报道如下。
1 材料与方法
1.1 动物与细胞 SPF 级雄性BALB/c 小鼠(8 周龄)24 只,体质量(27±3)g,实验动物生产许可证号:SCXK(浙)2019-0002,实验动物使用许可证号:SYXK(浙)2019-0011。在温度(24±2)℃,湿度(55±5)%,12 h 光照系统下进行饲养,自由进食和饮水。本研究动物实验已通过浙江省实验动物中心实验动物福利伦理委员会批准,伦理批号:ZJCLAIACUC-20010174。
小鼠结肠癌细胞CT26(批号:CL-0071)购自普诺赛生命科技有限公司(武汉),使用RPMI-1640 培养基(10% FBS、1%P/S)进行培养,细胞置于37 ℃、5% CO2浓度的恒温培养箱中进行培养。
1.2 试 剂 Reg(批号HY-10331)、抗小鼠PD-1抗体(批号HY-132192)购自MedChemExpress(New Jersey)公司,巨噬细胞集落刺激因子1 受体(CSF1-R)抗体(批号ab254357)购自艾博抗(上海)贸易有限公司,磷酸化巨噬细胞集落刺激因子1 受体(p-CSF1-R) 抗体(批号3155S) 购自Cell Signaling Technology(Boston)公司,成熟小鼠巨噬细胞标志物F4/80(批号MF48000)、巨噬细胞甘露糖受体CD206(批号17-2061-82)、重组人分化抗原80 CD80(批号12-0801-82)抗体购自Thermo Fisher Scientific(Massachusetts)公司、本实验所需引物都由生工生物工程(上海)股份有限公司合成,引物序列详见表1。Evo M -MLV RT Premix for qPCR(批号AG11706)购于艾科瑞生物科技(淄博)有限公司,HieffqPCR SYBRGreen Master Mix(No Rox)(批号11201ES08)购于翊圣生物科技(上海)有限公司。
1.3 结肠癌移植瘤模型构建及分组 取对数生长期的CT26 小鼠结肠癌细胞,制成1×107/mL 单细胞悬液,取0.2 mL 细胞悬液接种于BALB/c 小鼠右侧腋下,7 d 后观察小鼠腋下成瘤情况,注射部位出现质感坚韧的球形团块即为成瘤成功。将成瘤后的小鼠采用随机数字表法分为4 组:CT26 组、CT26+Reg组、CT26+anti-PD-1 组和CT26+Reg+anti-PD-1 组,每组6 只。CT26+Reg 组:每只小鼠给予10 mg/(kg·d)Reg,灌胃,持续2 周;CT26+anti-PD-1 组:每只小鼠给200 μg 抗小鼠PD-1 抗体,腹腔给药,每周1 次;CT26+Reg+anti-PD-1 组:每只小鼠给10 mg/(kg·d)Reg,灌胃,持续2 周,同时给200 μg 抗小鼠PD-1 抗体,腹腔给药,每周1 次;CT26 组根据小鼠体质量,分别每天灌胃等量生理盐水、每周1 次腹腔注射等量生理盐水。2 周后脱颈处死小鼠,解剖取皮下瘤,称重后进行后续实验。用卡尺测量瘤径,按公式a×b2/2(a 为肿瘤的长径,b 为肿瘤的短径),计算瘤体平均体积(mm3)。
1.4 免疫组织化学检测 取肿瘤组织石蜡切片,60 ℃恒温烤箱中烤片60 min,梯度脱蜡后蒸馏水浸泡5 min,PBS 清洗3 次;用3%过氧化氢室温孵育10 min,消除内源性过氧化物酶的活性。使用柠檬酸缓冲液进行热修复。使用1% BSA 室温封闭30 min;p-CSF1-R 一抗4 ℃孵育过夜。洗涤后加入通用型二抗,37 ℃孵育1 h;DAB 显色,同时镜下观察,自来水浸泡10~15 min。苏木素复染,同时显微镜下观察样品细胞核着色变化。将苏木素复染后的组织切片置于1%盐酸乙醇分化液分化3~5 s,自来水冲洗20 min后脱水透明,梯度脱水后封片,风干后显微镜下观察染色结果。
1.5 流式细胞术分选 取肿瘤组织,用剪刀剪碎后加入组织消化液中(胶原酶Ⅳ(0.0025 g)、脱氧核糖核酸酶I DNaseI(1 mg)溶解于50 mL 1640 培养基),于37 ℃摇床中震荡1 h。完成后,使用70 μm 滤网过滤,收集单细胞悬液。300×g 离心5 min 后收集细胞沉淀。固定通透后进行流式细胞术分析。使用F4/80、CD206、CD86 抗体标记肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)并区分M1、M2 表型。
1.6 巨噬细胞诱导极化 提取的BMDMs 细胞分为M1 组、M1+Reg 组、M2 组、M2+Reg 组进行培养,干预方法[4]为:用Reg 预处理1 h,然后分别用IFN-γ+脂多糖(lipopolysaccharides,LPS)诱导M1 型巨噬细胞,白介素-4(interleukin-4,IL-4)诱导M2 型巨噬细胞,诱导24 h。
1.7 实时荧光定量多聚核苷酸链式反应(qRTPCR) 利用Trizol 试剂提取巨噬细胞RNA,-80 ℃保存。使用Takara 逆转录试剂盒将上述提取的RNA逆转录为cDNA,而后用荧光DNA 结合染料(SYBR Green Master)配置实时荧光定量PCR 体系,应用Realtime PCR 仪进行对目的基因实时定量检测。
1.8 小鼠骨髓来源巨噬细胞(BMDMs)的提取 取小鼠完整的股骨和胫骨,浸入含有1%青/链霉素的DMEM 培养基中,用剪刀剪断股骨、胫骨的两端,并用吸满骨髓来源巨噬细胞培养基的1 mL 注射器冲出骨髓,并收集在小皿中反复吹吸直至将骨髓吹散,制备骨髓源性细胞(bone marrow derived cells,BMs)。将BMs 用巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)(20 ng/mL)诱导形成BMDMs。
1.9 蛋白质免疫印迹法(Western Blot) 使用RIPA裂解液提取肿瘤组织或巨噬细胞总蛋白,用聚丙烯酰胺凝胶电泳分离等量蛋白质,电泳后的凝胶转移到聚偏二氟乙烯膜上,然后在室温下用含有Tween-20 的Tris 缓冲盐水(TBST)中的5%脱脂奶粉封闭2 h。然后将膜与单克隆抗体4 ℃孵育过夜,用TBST 洗涤后,将膜与辣根过氧化物酶偶联二抗一起孵育。使用增强的化学发光试剂盒使免疫印迹可视化。
1.10 统计学方法 应用Graphpad prism 8.0 软件进行统计分析,符合正态分布数据表示为平均值(average,AVG)±标准差(Standard deviation,SD),两组之间比较采用t 检验,使用双向ANOVA 分析不同组间数据差异,P<0.05 被认为具有统计学意义。
2 结 果
2.1 Reg 对anti-PD-1 在CRC 中的影响 接种CT26 细胞于BALB/c 小鼠,建立结直肠癌移植瘤模型,并进行药物治疗,给药后观察荷瘤小鼠移植瘤的生长情况,并记录荷瘤小鼠移植瘤的体积、质量。结果显示,与CT26 组移植瘤小鼠比较,药物处理使得肿瘤体积和质量均显著减小(见图1)。与单独使用Reg 或者anti-PD-1 比较,Reg 和anti-PD-1 联合用药使移植瘤的体积和质量进一步减小(见表2)。
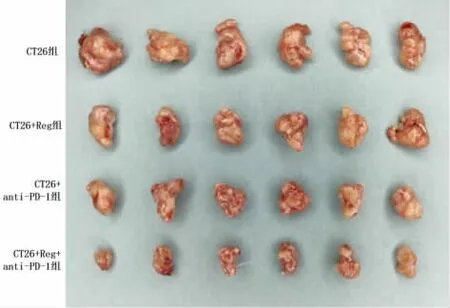
图1 小鼠CRC 移植瘤模型构建后各组肿瘤组织图
表2 四组小鼠肿瘤体积和肿瘤质量比较(±s)

表2 四组小鼠肿瘤体积和肿瘤质量比较(±s)
注:CT26 为小鼠结肠癌细胞;CT26+Reg 组每只小鼠给10 mg/(kg·d),灌胃,持续2 周;CT26+anti-PD-1 组每只小鼠给200 μg 抗小鼠PD-1抗体,腹腔给药,每周1 次;CT26+Reg+anti-PD-1 组每只小鼠给10 mg/(kg·d),灌胃,持续2 周,同时给200 μg 抗小鼠PD-1 抗体,腹腔给药,每周1 次;CT26 组根据小鼠体质量,分别每天灌胃等量生理盐水、每周1 次腹腔注射等量生理盐水;与CT26 组比较,aP<0.05;与CT26+Reg 组和CT26+anti-PD-1 组比较,bP<0.05
组别CT26 组CT26+Reg 组CT26+anti-PD-1 组CT26+Reg+anti-PD-1 组鼠数6 6 6 6肿瘤体积(mm3)1451.00±43.10 1174.33±56.84a 1221.00±42.42a 949.50±15.92b肿瘤质量(g)3.04±0.06 2.32±0.08a 2.40±0.10a 1.73±0.08b
2.2 Reg 对瘤内CSF1-R 信号通路的影响 为了研究Reg 对瘤内CSF1-R 信号通路的影响,提取肿瘤组织蛋白,Western Blot 检测肿瘤组织中CSF1-R 信号通路相关蛋白p-CSF1-R 和CSF1-R 的表达,结果显示,相较于CT26 组,CT26+Reg 组瘤内p-CSF1-R蛋白表达水平降低;相较于单独用药组,CT26+Reg+anti-PD-1 组p-CSF1-R 水平显著降低,而各组间CSF1-R 水平无显著性差异(见图2A)。对肿瘤组织切片进行免疫组织化学染色(p-CSF1-R),结果表明,Reg 处理使得p-CSF1-R 表达显著下调,而与anti-PD-1 联合用药后,p-CSF1-R 表达水平进一步下调(见图2B)。
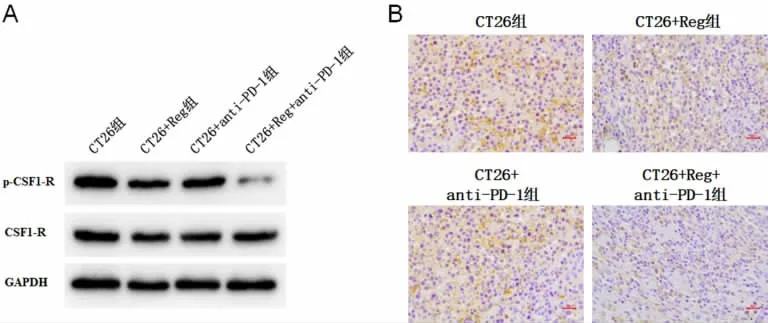
图2 Reg 对瘤内CSF1-R 信号通路的影响
2.3 Reg 对瘤内巨噬细胞的影响 为了研究Reg 对瘤内M1、M2 型巨噬细胞的影响,取部分肿瘤组织单细胞悬液进行流式检测,使用F4/80、CD206、CD80抗体标记TAMs 并区分M1、M2 表型。结果表明,Reg处理,M2 型巨噬细胞(F4/80、CD206 阳性)比例显著下降,M1 型巨噬细胞(F4/80、CD80 阳性)比例显著增加(见图3),并且与anti-PD-1 联合用药后,这种变化更显著(见表3)。

图3 Reg 对瘤内M1、M2 型巨噬细胞的影响
表3 四组M1、M2 型巨噬细胞百分比(流式细胞术)比较(%,±s)

表3 四组M1、M2 型巨噬细胞百分比(流式细胞术)比较(%,±s)
注:CT26+Reg 组每只小鼠给10 mg/(kg·d),灌胃,持续2 周;CT26+anti-PD-1 组每只小鼠给200 μg 抗小鼠PD-1 抗体,腹腔给药,每周1 次;CT26+Reg+anti-PD-1 组每只小鼠给10 mg/(kg·d),灌胃,持续2周,同时给200μg 抗小鼠PD-1 抗体,腹腔给药,每周1 次;CT26 组根据小鼠体质量,每天灌胃等量生理盐水、每周1 次腹腔注射等量生理盐水;流式细胞术检测M1、M2 型巨噬细胞比例,与CT26 组比较,aP<0.05;与CT26+Reg 组和CT26+anti-PD-1 组比较,bP<0.05
组别CT26 组CT26+Reg 组CT26+anti-PD-1 组CT26+Reg+anti-PD-1 组孔数6 6 6 6 M1 型巨噬细胞5.50±0.96 12.50±1.71a 8.00±0.82a 19.00±2.00b M2 型巨噬细胞35.33±2.21 21.33±2.36a 28.67±1.89a 13.67±1.80b
2.4 Reg 对肿瘤相关巨噬细胞极化的影响 提取的BMDMs 细胞分为M1 组、M1+Reg 组、M2 组、M2+Reg组进行培养,提取细胞RNA,进行qRT-PCR 检测。结果表明,Reg 处理后,下调了M2 型巨噬细胞极化(Arg1,CD206,CD163)(见表4),增加了M1 型巨噬细胞极化(IL-23,IL-12,CD86)(见表5),表明Reg能调节TAMs 极化方向。
表4 两组M2 型巨噬细胞极化指标检测(mRNA)比较(±s)
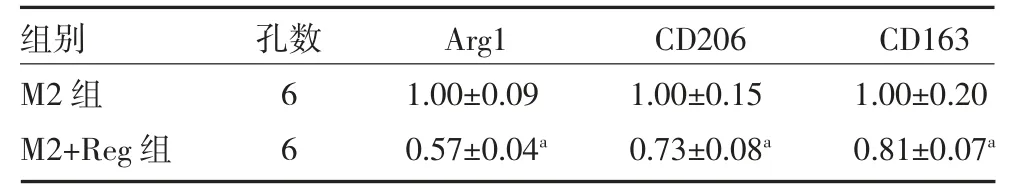
表4 两组M2 型巨噬细胞极化指标检测(mRNA)比较(±s)
注:Arg1 为精氨酸酶1;CD206 为巨噬细胞甘露糖受体;CD163 为受体蛋白;与M2 组比较,aP<0.05
组别M2 组M2+Reg 组孔数6 6 Arg1 1.00±0.09 0.57±0.04a CD206 1.00±0.15 0.73±0.08a CD163 1.00±0.20 0.81±0.07a
表5 两组M1 型巨噬细胞极化指标检测(mRNA)比较(±s)
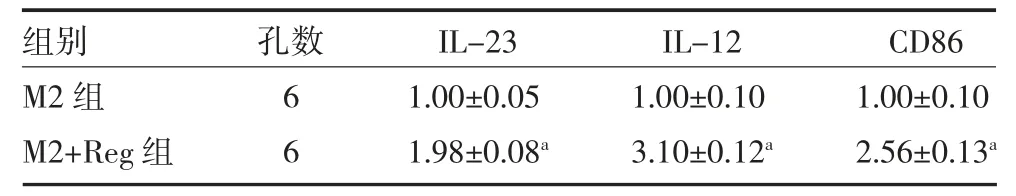
表5 两组M1 型巨噬细胞极化指标检测(mRNA)比较(±s)
注:IL-23 为白细胞介素-23;IL-12 为白细胞介素-12;CD86 为白细胞分化抗原86;与M1 组比较,aP<0.05
组别M2 组M2+Reg 组孔数6 6 IL-23 1.00±0.05 1.98±0.08a IL-12 1.00±0.10 3.10±0.12a CD86 1.00±0.10 2.56±0.13a
2.5 Reg 与CSF1-R 信号通路对肿瘤相关巨噬细胞极化的影响 将诱导极化得到的M2 型巨噬细胞分为M2 组、M2+Reg 组进行培养,提取细胞总蛋白,通过Western blot 检测Reg 对M2 型巨噬细胞表面CSF1-R 信号通路相关蛋白表达的影响。结果表明,Reg 处理使M2 型巨噬细胞表面CSF1-R 磷酸化水平显著下调(见图5),提示Reg 通过抑制p-CSF1-R表达,调控CSF1-R 通路进而调节TAMs 极化。
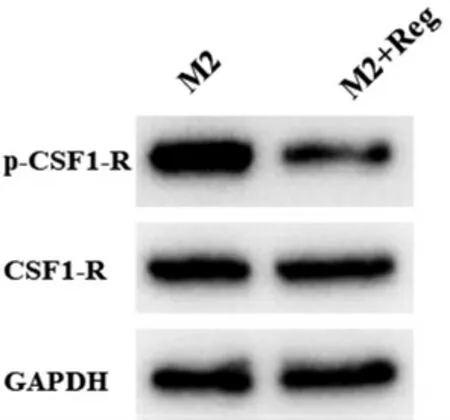
图5 Reg 通过CSF1-R 信号通路调节TAMs 极化
3 讨 论
靶向PD-1 的治疗性抗体在CRC 治疗中取得了重大突破。然而,仅有少部分微卫星稳定(microsatellite stabilization,MSS)患者的抗PD-1 免疫治疗有效果,大多数MSS 病例不响应基于抗PD-1 的免疫疗法。因此联合治疗将成为克服这一限制的理想战略[5]。生物医药技术的发展使人类对癌细胞和免疫系统之间复杂的相互作用有了更好的认识,导致新的免疫疗法的产生。Reg 是应用于晚期转移性的CRC 的小分子抑制剂,能够靶向细胞中参与细胞正常功能和病理过程的多种激酶,抑制肿瘤发生、肿瘤血管生成及肿瘤转移[6]。作为一种多目标激酶抑制剂,Reg 可通过改善肿瘤微环境,用于治疗转移性CRC[7],提示Reg 具有和anti-PD-1 联合应用的希望。本研究结果证实,在CT26 移植瘤小鼠中,Reg 和anti-PD-1 单独用药都能对CRC 产生疗效,但Reg 和anti-PD-1 联合用药后对CRC 产生的疗效更为显著,这反映在药物治疗后移植瘤的体积和质量都显著降低。
TAMs 是肿瘤免疫微环境中重要的组成部分,也是肿瘤抗免疫应答中的主要参与者,能够促进瘤内血管新生,肿瘤细胞的局部浸润和远处转移,并且与多种肿瘤的预后相关[8-9]。M2 型巨噬细胞在肿瘤组织中的生长分化高度依赖巨噬细胞集落刺激因子-1/巨噬细胞集落刺激因子-1 受体(colony-stimulating factor 1,CSF1/CSF1 receptor,CSF1-R)信号通路。通过阻断CSF1-R 信号能够选择性抑制肿瘤组织中M2 型巨噬细胞,而对M1 型巨噬细胞影响较小[10]。通过CSF1-R 信号阻断有望通过抑制M2 型肿瘤相关巨噬细胞改善肿瘤免疫抑制微环境,进而提高免疫检查点抑制剂在恶性肿瘤中的疗效[11]。本研究结果显示,Reg 能影响瘤内CSF1-R 信号通路,Reg 和anti-PD-1 联合用药后显著下调瘤内p-CSF1-R 的表达,并且Reg 处理能有效减少小鼠CRC 移植瘤内M2 型巨噬细胞的比例。
研究表明,有多种方法能影响anti-PD-1 在CRC 中的疗效,如低剂量地西他滨可通过重新调节肿瘤微环境,增强anti-PD-1 在CRC 中的作用[11];具核梭杆菌能增强anti-PD-1 对CRC 小鼠的抗肿瘤作用,并延长了生存期,将具核梭杆菌与免疫治疗相结合,可增强anti-PD-1 的治疗效果[12];白介素17A 可通过p65/NRF1/miR-15b-5p 轴增加anti-PD-1 的表达,提高anti-PD-1 治疗在CRC 小鼠模型中的疗效[13]。而在本研究中,Reg 可通过有效抑制巨噬细胞中CSF1-R 的磷酸化水平,对TAMs 极化产生影响,下调M2 型巨噬细胞极化,调节肿瘤微环境,同时证实了Reg 能够有效增强anti-PD-1 在荷瘤小鼠体内的抗肿瘤活性,协同抑制小鼠皮下瘤的生长。
综上,本研究通过CRC 移植瘤小鼠模型发现,Reg 可通过CSF1-R 信号通路调控TAMs,增强anti-PD-1 在CRC 中的疗效。本研究明确了Reg 对TAMs的作用效果及信号分子机制,验证了联合应用anti-PD-1 和Reg 在CRC 小鼠模型中的治疗效果及协同机制,为其临床应用提供了理论参考。

