浙贝-甘草药对调控NF-κB 信号通路抑制非小细胞肺癌的机制研究
周夏成 刘远财 杨佳颖 张爱琴
肺癌又称原发性支气管肺癌,是一种源自支气管黏膜或腺体的恶性肿瘤,属中医学“肺岩”“息贲”“肺积”等范畴。截至2020 年,肺癌新发病例约209万,死亡人数约180 万,占癌症死亡总人数的18.4%,大约85%的肺癌为非小细胞肺癌(non-small cell lung cancer,NSCLC)[1-2]。当前NSCLC 的治疗方式依然是以手术、化疗、放疗、靶向治疗及免疫治疗等在内的综合治疗为主,而中医药抗肿瘤具有多层次、多环节、多靶点、整体调节的特点,联合现代治疗肺癌方法,在延长患者生存期,提高生活质量,减轻毒副反应等方面,发挥了重要作用[3-4]。浙贝母-甘草药对选自吴良村教授治疗NSCLC 经典方新加沙参麦冬汤[5]。浙贝母[6]味苦性寒,归肺、心经,具有清热化痰、降气止咳、散结消肿之效。甘草味甘性平,归十二经,具有补中益气、清热解毒、润肺袪痰之效,两药配伍,共奏清肺化痰、消结散核之效,是临床治疗NSCLC 的常用药对,但具体作用机制尚不清晰。本研究拟根据浙贝-甘草药对的网络药理学富集结果,从动物、细胞和分子水平研究浙贝-甘草药对对NSCLC细胞增殖的影响,探索浙贝-甘草药对治疗NSCLC的具体作用机制,现报道如下。
1 材 料
1.1 小鼠与细胞株 1~8 周龄,体质量18~20 g 雄性C57BL/6J 野生型小鼠30 只,购买于浙江鹰旸医药研发有限公司,实验动物使用许可证号:SYXK(浙)2021-0033,均饲养于室温20~25 ℃,相对湿度50%~70%的清洁动物房内,动物自由取食、饮水,自动控制光照/黑暗交替(12 h/12 h)。本研究经动物实验伦理审核通过(批准编号:202205-0602)。
LLC 小鼠Lewis 肺癌细胞,购自赛百慷(上海)生物技术股份有限公司(批号iCell-m027)。
1.2 药 物 浙贝母15 g、甘草6 g 购于浙江省肿瘤医院(批号20211006)。
1.3 主要试剂与仪器 细胞组织快速裂解液(RIPA)(批号090121211229)、苯甲基磺酰氟(PMSF)(批号20220212)均购自碧云天;蛋白酶抑制剂(批号50321)购自康为世纪;二奎啉甲酸法(BCA)蛋白定量试剂盒(批号20220218)、预染蛋白marker(批号326G022) 均购自Solarbio;30%acylamide (批号H108KA8405)、1.5M Tris pH8.8(批号22011373)、1.0M Tris pH6.8(批号21230507)均购自Biosharp;10%过硫酸铵(批号H616BA1001)购自BBI Life Sciences;聚偏二氟乙烯膜(PVDF)(批号R1NB74016)购自millipore;苏木素-伊红染色套装(HE 染液)(批号20220305)购自Runnerbio;核因子-κB1(NF-κB1)抗体(批号12540-7)购自CST;Toll 样受体4(TLR-4)抗体(批号16c5074)、NF-κB p65(RelA)抗体(批号 25h4677)、Goat Anti Mouse IgG HL Alexa Fluor647(批号GR2553287-3)均购自Affinity;牛血清蛋白(BSA)(批号220107)、三(羟甲基)氨基甲烷(Tris-base)(批号WXBD176V)、乙二胺四乙酸(EDTA)(批号P2050518)均购自Sigma。低温高速离心机(型号:Micro17R)购自Thermo;电泳仪(型号:EPS300)、电泳槽(型号:VE 180C)、转膜仪(型号:VE186)均购自天能;化学发光仪(型号:610020-9Q)购自勤翔;组织摊片机(型号:KD-P)购自科迪,脱色摇床(型号:TSY-B)、涡旋混合器(型号:MX-F)、掌上离心机(型号:D1008E)均购自Servicebio。
2 方 法
2.1 网络药理学分析
2.1.1 浙贝-甘草药对活性成分筛选 本研究根据口服生物利用度(oral bioavailability,OB)以及类药性(drug-likeliss,DL)[7]筛选出药代动力学性质良好的活性成分。
2.1.2 药物靶点预测 将活性成分导入SwissTargetPrediction 数据库,设置属性为“Homo sapiens”,取可能性分值大于0.1,预测化合物发挥药效的潜在作用靶点。运用Cytoscape3.8.2 把结果进行可视化展示,构建活性成分-靶点网络图。
2.1.3 NSCLC 相关疾病靶点筛选 利用GeneCards和DiSGeNET 数据库,设置搜索词为“Non-small cell lung cance”或“NSCLC”进行检索,获取NSCLC 相关靶点。
2.1.4 蛋白质-蛋白质互作网络(protein-protein interaction network,PPI) 将浙贝-甘草药对潜在作用靶点与NSCLC 相关疾病靶点交集,并上传到STRING 数据库,物种选择“Homo sapiens”,互作分数选择(interaction score)≥0.9,得到PPI 信息并绘制网络图。把结果导入Cytoscape3.8.2 软件,对交集靶点进行PPI 网络构建并进行拓扑分析,将度值(Degree)≥2 倍中值的节点确定为关键靶点[8]。
2.1.5 基因本体(gene ontology,GO)功能富集分析将关键靶点上传至DAVID 数据库,进行GO 富集分析,包括生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组分(cellular component,CC),物种选择“Home sapiens”,设定阈值(P)<0.01。
2.1.6 京都基因与基因组百科全书(KEGG)通路富集分析 将关键靶点上传至DAVID 数据库,设定阈值(P)<0.01,进行京都基因与KEGG 富集分析。
2.2 体内实验
2.2.1 实验分组与造模 取20 只小鼠用Lewis 肺癌细胞制备小鼠皮下成瘤模型,并按随机数字表法分为浙贝-甘草药对等效剂量组与模型组各10 只,另取10 只未造模小鼠为对照组进行研究。
2.2.2 药物干预 当瘤体体积达到500 mm3左右后灌胃给药,每天0.2 mL/只,连续4 周。浙贝-甘草药对等效剂量组的药物浓度为临床常用浓度(每50 kg体质量浙贝母15 g,甘草6 g),模型组与对照组采用等量生理盐水。
2.2.3 瘤径测量 给药后,剥离瘤体称重,用游标卡尺测量肿瘤组织的长径与短径,计算体积(体积=长径×短径)。
2.2.4 HE 染色 将剥离下来的瘤体制作成切片,行苏木素染色、伊红染色,再行脱水封片,在镜检下行图像采集分析。根据光镜下肿瘤细胞坏死面积给以HE 染色评分:0 级:正常,为0 分;1 级:少量肿瘤细胞损伤,肿瘤坏死面积≤25%,为1 分;2 级:明显肿瘤细胞损伤,肿瘤坏死面积<25%~50%,为2 分;3级:明显肿瘤细胞损伤,肿瘤坏死面积<50%~75%,为3 分;4 级:大量肿瘤细胞损伤,肿瘤坏死面积>75%,为4 分[9]。
2.2.5 免疫组化检测 将组织切片脱蜡,修复,后用H2O2处理,再行血清封闭,进行一抗、二抗反应后二氨基联苯胺(DAB)显色。苏木素复染后脱水封片,行镜检和图像采集分析。
2.2.6 Western blot 检测 各组肿瘤组织经处理后,用RIPA 裂解液抽提细胞总蛋白,BCA 法测定蛋白浓度。聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白并转膜,用三羟甲基氨基甲烷缓冲盐水与补间(TBST)洗膜3 次。再将PVDF 膜放入孵育盒中,进行封闭。结束后进行一抗及二抗反应。加入电化学发光试剂后,于凝胶成像系统中显影并观察记录。
2.2.7 统计学方法 应用SPSS 26.0 统计软件进行数据分析,多组间计量资料若符合正态分布且符合方差齐性检验,用One-way-ANOAY 单因素方差分析,进一步组间两两比较采用Turkey 检验;若符合正态分布但方差不齐,则采用Dunnett’s T3 检验或独立样本t 检验;若不符合正态分布,则采用Kruskal-Wallis H检验。所有数据以均数±标准差(±s) 表示,P<0.05 为差异有统计学意义。
3 结 果
3.1 网络药理学结果
3.1.1 浙贝-甘草药对的活性成分 根据OB≥30%及类药性DL≥0.18 进行筛选,经去重后,共筛选出97个活性成分,包括槲皮素(Quercetin)、β-谷甾醇(Beta-Sitosterol)、谷甾醇(Sitosterol)、山奈酚(Kaempferol)、甘草醇(Glycyrol)、柚皮素(Naringenin)等。
3.1.2 浙贝-甘草药对的潜在靶点 通过TCMSP 数据库、SwissTargetPrediction、PharmMapper 预测上述有效活性成分的靶点,经过去重合并,共1026 个药物靶点。利用Cytoscape3.8.2 软件将结果可视化处理,并构建活性成分-靶点网络图。见图1。
图1 活性成分-靶点网络图
3.1.3 NSCLC 相关疾病靶点及PPI 网络 去重合并后共有6495 个NSCLC 相关疾病靶点。将浙贝-甘草潜在作用靶点与NSCLC 疾病靶点交集,共有690 个交集靶点。将其导入STRING 11.0 数据库,获得靶点联系网络图,导入Cytoscape3.8.2 后,拓扑分析得到关键靶点88 个。将关键靶点与对应的化合物联系,导入Cytoscape3.8.2 分析,得到浙贝-甘草药对治疗NSCLC 的关键成分,并根据Degree 值进行排序,颜色越深代表Degree 值越高。见图2~4 及表1。

表1 药物关键成分表

图2 交集靶点PPI 互作网络

图3 药物关键靶点
3.1.4 GO 富集分析 GO 富集分析结果发现,浙贝-甘草药对主要是通过细胞溶胶(Cytosol)、细胞质(Cytoplasm)、细胞核(Nucleus)、质膜(Plasma Membrane)等细胞组分参与信号转导(Promoter)、蛋白质磷酸化(Signal Transduction)、凋亡过程的负调控(Protein Phosphorylation)、基因表达的正调节(Negative Regulation of Apoptotic Process)、细胞增殖的正调节(Positive Regulation of Gene Expression)等生物学过程,发挥了蛋白质结合(Protein Binding)、ATP 结合(ATP Binding)、酶结合(Enzyme Binding)、蛋白激酶活性(Protein Kinase Activity)等分子功能,从而起到干预NSCLC 的作用。见图5。
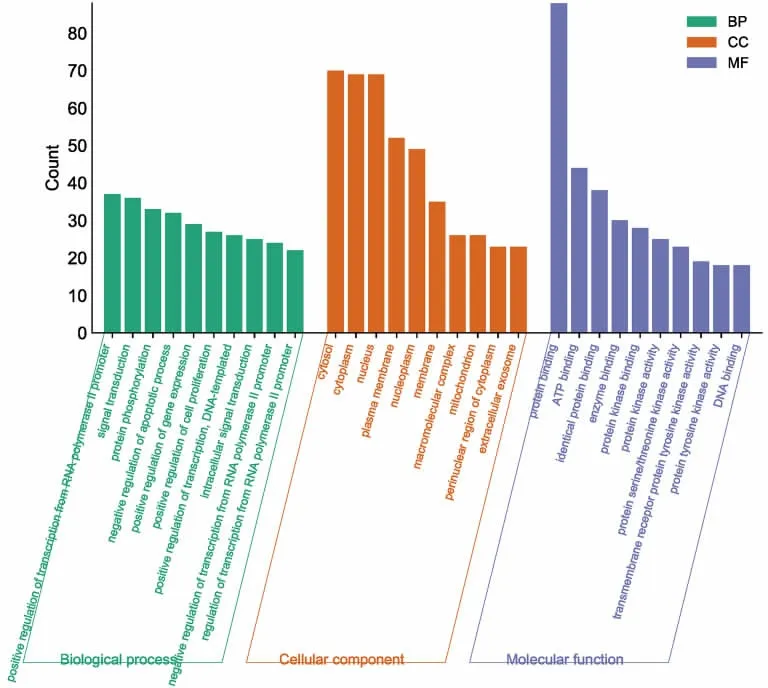
图5 DAVID 数据库中GO 富集分析图
3.1.5 KEGG 富集分析 通过DAVID 数据库共获得2215 条富集通路,按照P<0.01 条件,得到159 条与NSCLC 相关的通路,根据Count 数选取排在前40的通路,利用气泡图进行可视化。X 轴是Enrichment,Y 轴是通路名称,气泡图的大小代表Count 数目,颜色代表Fdr 值。富集结果分析得知,浙贝-甘草药对干预NSCLC 可能与鸟苷酸环化酶-蛋白激酶G(cGMP PKG)信号通路、TGF-β 信号通路、p53 信号通路、NF-κB 信号通路等相关。见图6。
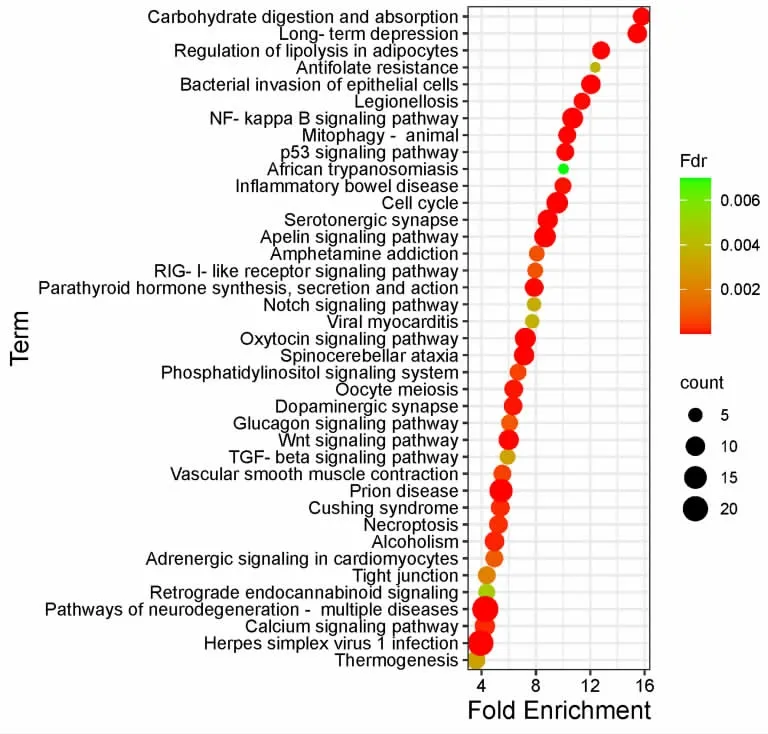
图6 DAVID 数据库中KEGG 富集分析图
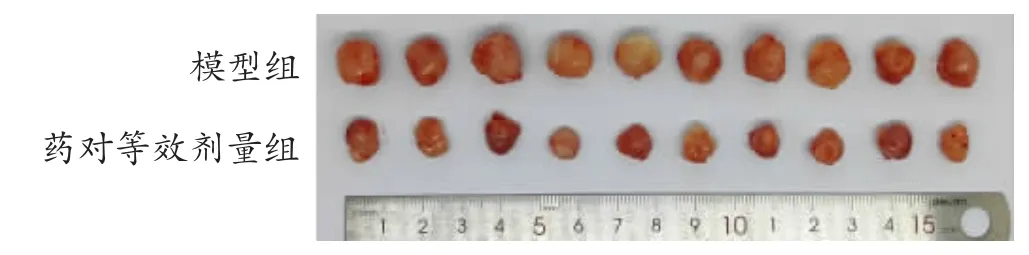
图7 小鼠肿瘤图
3.2 体内实验
3.2.1 浙贝-甘草药对对小鼠皮下移植瘤瘤重、瘤体积的影响 药对等效剂量组瘤重、瘤体积比模型组显著减少(P<0.01),见表2 和7 图。
表2 各组小鼠瘤重、瘤体积变化情况(±s)
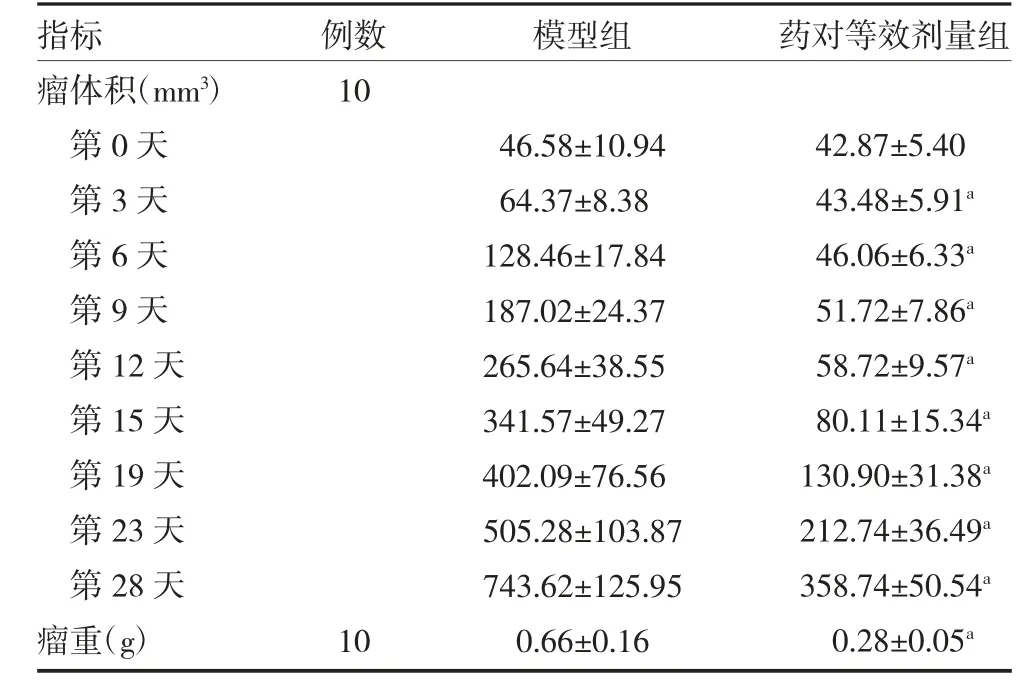
表2 各组小鼠瘤重、瘤体积变化情况(±s)
注:与模型组比较,aP<0.01
指标瘤体积(mm3)第0 天第3 天第6 天第9 天第12 天第15 天第19 天第23 天第28 天瘤重(g)例数10模型组药对等效剂量组10 46.58±10.94 64.37±8.38 128.46±17.84 187.02±24.37 265.64±38.55 341.57±49.27 402.09±76.56 505.28±103.87 743.62±125.95 0.66±0.16 42.87±5.40 43.48±5.91a 46.06±6.33a 51.72±7.86a 58.72±9.57a 80.11±15.34a 130.90±31.38a 212.74±36.49a 358.74±50.54a 0.28±0.05a
3.2.3 浙贝-甘草药对对肿瘤细胞损伤坏死的影响浙贝甘草药对等效剂量组肿瘤组织中细胞损伤坏死较模型组增加(见图8),HE 半定量评分较模型组升高[(3.20±0.45)分比(0.20±0.45)分,P<0.01)]。
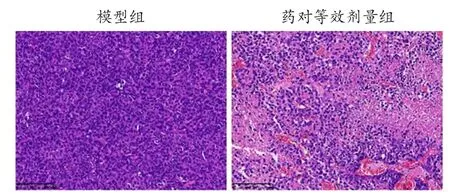
图8 小鼠肿瘤组织病理学改变(HE 染色,200×)
3.2.4 浙贝-甘草药对对NF-κB 通路相关蛋白表达量的影响 免疫组化实验发现,药对等效剂量组瘤体组织中TLR-4、NF-κB 1、RelA 的蛋白表达量均显著降低(P<0.01)。见图9 及表3。Western blot 检测结果发现,浙贝甘草药对等效剂量组小鼠肿瘤组织中TLR-4、NF-κB1、RelA 蛋白表达水平降低(P<0.01)。见图10 及表4。
表3 瘤体组织中TLR-4、NF-κB 1、RelA 的蛋白表达量(±s)
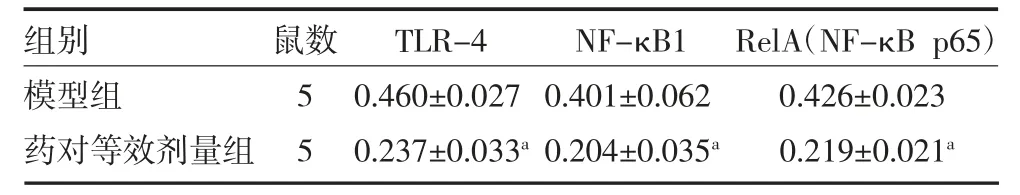
表3 瘤体组织中TLR-4、NF-κB 1、RelA 的蛋白表达量(±s)
注:TLR-4 为Toll 样受体4 蛋白;NF-κB1 为细胞核因子-κB1 蛋白;RelA(NF-κB p65)为细胞核因子-κB p65 蛋白;与模型组比较,aP<0.05
组别模型组药对等效剂量组鼠数5 5 TLR-4 0.460±0.027 0.237±0.033a NF-κB1 0.401±0.062 0.204±0.035a RelA(NF-κB p65)0.426±0.023 0.219±0.021a

表4 小鼠肿瘤组织中TLR-4、NF-κB 1、RelA 蛋白表达情况
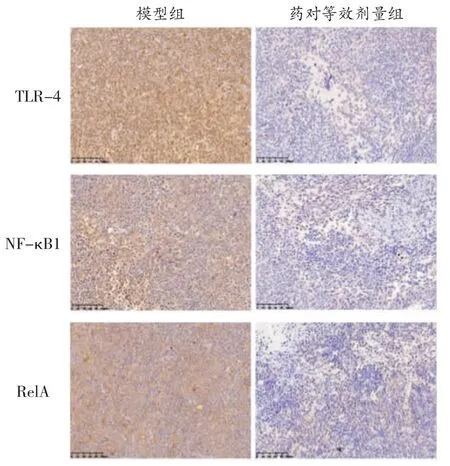
图9 各组Lewis 细胞中TLR4、NF-κB1、RelA 的蛋白表达情况(免疫组化染色,200×)
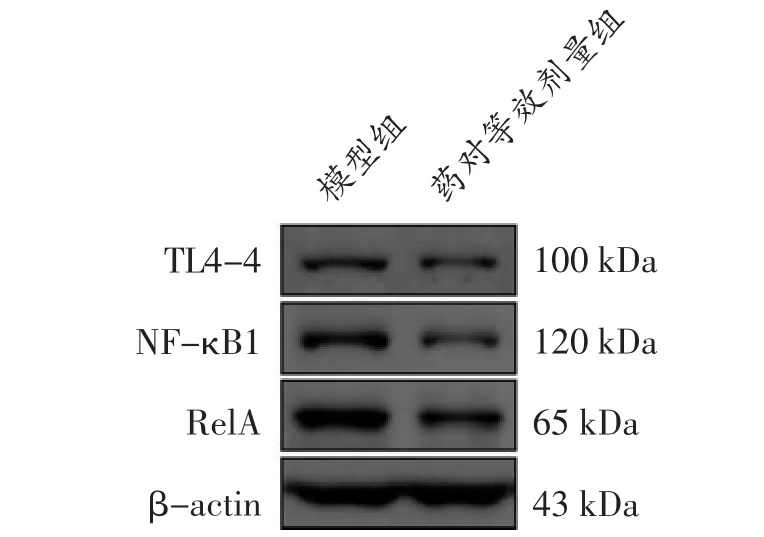
图10 小鼠肿瘤组织中TLR-4、NF-κB1、RelA 蛋白表达条带图
4 讨 论
现代医学对于浙贝母及甘草有诸多研究。唐晓勇[10]发现,从浙贝母中提取的浙贝母碱可逆转人肺腺癌耐顺铂株(A549/DDP)细胞株的多药耐药,其机理与促进细胞凋亡、下调肺耐药(L-RP)蛋白表达、抑制切除修复交叉互补基因1(ERCC1)mRNA 表达,从而降低DNA 的修复能力有关。李泽宇等[11]通过数据挖掘分析发现,甘草现代药理在抗炎、心脑血管保护、神经保护、抗病毒、抗肿瘤方面的应用十分广泛。甘草提取物甘草查尔酮(LCB)能抑制人NSCLC 细胞HCC827 的生长并诱导其细胞凋亡[12]。
浙贝-甘草药对的有效成分中,槲皮素作为一种广泛存在于植物界、具有多种生物学活性的黄酮类化合物,已被发现具有抗氧化、抗炎、抗肿瘤及免疫调节作用[13-14]。山奈酚属于黄酮类化合物,研究发现,山奈酚可以调控和B 淋巴细胞瘤-2 基因(Bcl-2)及Bcl-2 相关X 蛋白(Bax)表达,诱导NSCLC 细胞凋亡,还可以抑制NSCLC 细胞上皮细胞-间充质转化过程[15-16]。柚皮素是一种天然的黄酮类化合物,具有抗氧化、抗炎、免疫调节、抗肿瘤等多种药理作用[17]。
在浙贝-甘草药对治疗NSCLC 的关键靶点中,编码p53 的基因(TP53)是公认的抑癌基因,TP53 蛋白有调节多种细胞功能,如DNA 合成和修复、细胞周期阻滞、衰老和凋亡[18]。酪氨酸激酶(SRC)是人类历史上第一个被发现的原癌基因,它能激活丝裂原活化蛋白激酶(MAPK),信号转导及转录激活(STAT),磷酸肌醇三磷酸激酶-丝氨酸-苏氨酸蛋白激酶(PI3K/Akt)和表皮生长因子受体(EGFR)等多条信号通路,其中STAT3 可通过介导炎症介质的细胞外信号调控肿瘤细胞、免疫细胞等生物学行为,促进肿瘤发生及相关炎症的形成。结合GO 富集分析和KEGG 富集分析结果,浙贝-甘草药对可能通过调控NF-κB 信号通路,影响细胞增殖、凋亡,最终达到干预NSCLC 的作用。而NF-κB 信号通路上富集到的关键靶点有TLR-4、NF-κB1、RelA 等,细胞及动物实验的结果提示,浙贝-甘草药对可能通过干预上述靶蛋白的表达起到抑制肿瘤细胞增殖、促进肿瘤细胞凋亡的作用。NF-κB 信号通路是指哺乳动物核转录因子(transcription factors,TFs)NF-κB 家族,其与多种恶性肿瘤的发生、侵袭和转移有着密切关系[19]。NF-κB 信号通路在多种NSCLC 组织中通常呈组成性活化,这种异常活化通过干扰细胞凋亡与细胞正常周期,在NSCLC 的恶化增殖中发挥重要作用[20]。NF-κB 因子自身和相关调控蛋白酶与NSCLC 抗凋亡及细胞周期调控高度关联,其促进NSCLC 发展的主要机制是通过调控细胞抗凋亡和细胞周期相关基因的表达促进细胞增殖,抑制细胞凋亡[21]。NF-κB1(NF-κB p50)及RelA(NF-κB p65)是NF-κB 家族的两个亚单位,研究表明,通过影响RelA 的表达可以抑制NF-κB 信号通路介导的细胞存活、增殖、肿瘤细胞浸润转移和炎症反应[22]。Toll 样受体(TLRs)是存在于细胞表面传递信号通路表达的受体蛋白,其对病原体衍生的分子具有识别作用,继而产生复杂免疫效应,调节组织细胞免疫和炎症创伤的全过程[23]。在TLRs 家族中,介导炎症的TLR-4 不仅广泛表达于NK 细胞、巨噬细胞等免疫原性细胞,发挥启动免疫应答反应、激活大量炎症介质等作用,也表达于肝细胞癌、结肠癌、乳腺癌、肺癌等多种恶性肿瘤,起到激活多种肿瘤的生物学行为的效应[24]。TLR-4 通过与其配体结合,可激活NF-κB 途径。研究发现,TLR-4 与NF-κB 在NSCLC 中的表达明显增加,表达程度与NSCLC 的分化程度密切相关[25]。
体内实验显示,浙贝-甘草药对可以降低肿瘤组织的增长速率、造成肿瘤组织的细胞损伤坏死。Western blot 检测及免疫组化检测结果显示,浙贝-甘草组可以明显下调TLR-4、NF-κB1、RelA 蛋白表达。
综上所述,本研究提示浙贝-甘草药对作为一组具有抗癌作用的中药药对,可通过抑制NF-κB 信号通路相关蛋白TLR-4、NF-κB1、RelA,抑制肿瘤细胞增殖、促进肿瘤细胞凋亡,为探索浙贝-甘草药对抗肿瘤的机制提供一定的研究基础。

