基于高通量测序分析不同发酵方式下黄精泡菜中微生物多样性
焦佳音,李嘉瑜,樊淑淼,王磊,郑芸霏,李明婉,李瑜,李连珍,洪利亚,4*
(1.河南农业大学 农学院,河南 郑州 450046;2.河南农业大学 林学院,河南 郑州 450046;3.河南农业大学 食品科学技术学院,河南 郑州 450046;4.北京大学 药学院,北京 100191)
黄精(Polygonatum sibiricum)为百合科黄精属多年生草本植物,口味甘甜,营养丰富,含有多糖、黄酮类、氨基酸和矿物质等成分[1-3],具有抗氧化、抗衰老、降血糖及改善记忆力等功效[4-6]。黄精作为药食同源的食材,市场上已开发出黄精茶[7]、黄精果酒[8]、黄精酸奶[9]、黄精饼干[10]等多种产品,市场占有率较高且深受消费者喜爱,黄精深加工及综合利用已成为研究热点。
泡菜是我国传统发酵制品,富含多种纤维素、氨基酸和微量元素,能促进肠道蠕动、提高人体免疫力[11]。泡菜发酵是一个多菌种发酵过程,不同发酵方式菌群结构存在差别[12]。母水发酵是四川泡菜的特色工艺,在泡菜中加入母水可增强泡菜中微生物群落的稳定性并保持其原有风味[13]。接种发酵同样常用于泡菜制作,采用人工接种特定发酵剂进行发酵,具有缩短泡菜发酵周期、减少杂菌污染和降低亚硝酸盐含量等优势[14]。目前已有将中药材或者药食同源材料制作泡菜的研究,如山药[15]、黄芪[16]、桔梗[17]等,但关于黄精泡菜还鲜有报道,本研究采用母水发酵和接种发酵腌制黄精泡菜,通过感官评分、pH 值、总酸含量及亚硝酸盐含量测定,并利用高通量测序技术分析两种发酵方式中微生物多样性的差异,以期为黄精泡菜产业化生产提供理论依据和技术参考。
1 材料与方法
1.1 材料与试剂
黄精:登封市土鑫种植专业合作社,经河南农业大学洪利亚博士鉴定为百合科黄精属植物黄精;白酒:泸州老窖股份有限公司;盐:中盐河南盐业物流配送有限公司;泡菜发酵菌:广东顺德尚川生物科技有限公司;四川泡菜母水:江油蜀味山珍贸易有限公司;姜、花椒、小米辣、大蒜、冰糖:市售。
氢氧化钠:上海麦克林生化有限公司;硫酸锌、正辛醇、硝酸钾、酚酞指示剂:国药集团化学试剂有限公司;95%乙醇:上海泰坦科技有限公司;亚铁氰化钾、N-1-萘乙二胺盐酸盐、无水对氨基苯磺酸:天津市光复精细化工研究所;乙酸锌:汕头市西陇化工厂;TGuide S96 磁珠法土壤/粪便基因组DNA 提取试剂盒:天根生化科技(北京)有限公司;DNA 聚合酶:北京全式金生物技术有限公司;DNA 精确扩增试剂盒:美国Axygen 公司;DNA 文库制备试剂盒:美国Illumina公司。以上化学试剂均为分析纯。
1.2 仪器与设备
250A 生化培养箱:宁波普朗特仪器有限公司;HH数显恒温水浴锅:郑州生元仪器有限公司;KQ-400DE型数控超声波清洗器:昆山市超声仪器有限公司;MR1029 破壁料理机:广东新宝电器股份有限公司;721紫外可见分光光度计:上海康华生化仪器制造有限公司;PHS-3E 精密pH 计:上海仪电科学仪器股份有限公司;Synergy HTX 酶标仪:基因有限公司;OSE-MC8瞬时离心机:天根生化科技(北京)有限公司;Veriti96梯度基因扩增仪:美国应用生物系统公司;H1650-w医用离心机:湖南湘仪实验室仪器开发有限公司;BE-1100 四维旋转混匀仪:海门市其林贝尔仪器制造有限公司。
1.3 试验方法
1.3.1 工艺流程
原料准备、初加工→沥干水分→器具灭菌→调盐浓度→接种→装坛→白酒密封→25 ℃恒温发酵→成品。
1.3.2 操作要点
选取无发霉腐烂、水分充足、根茎幼嫩的一年生黄精为原料,去除表皮和杂质,洗净后切至1 cm×1 cm×1 cm 小块,置于7%盐水中充分浸泡去除麻舌感,清洗去除盐味后沥水备用。按黄精∶凉开水=1 ∶2 的质量比装入泡菜坛,再添加3.0%盐和4.0%冰糖搅拌均匀,按黄精质量0.1%添加菌粉或7.0%添加母水发酵液,并依次加入适量姜、大蒜、小米辣、花椒和白酒,密封后25 ℃恒温发酵7 d。发酵至第1、3、5、7 天时进行采样以测定相关指标,母水发酵样品标记为M1、M3、M5、M7,接种发酵样品标记为J1、J3、J5、J7。
1.3.3 评价与测定
1.3.3.1 感官评价
由食品专业人员20 名(男10 名,女10 名)组成感官评价小组对黄精泡菜进行感官评价,分别从色泽、香味、风味、质地进行评分,满分100 分,感官评分标准见表1。

表1 感官评价标准Table 1 Sensory evaluation criteria
1.3.3.2 理化指标测定
总酸含量参照GB 12456—2021《食品安全国家标准食品中总酸的测定》中酸碱指示剂滴定法进行测定;pH 值参照GB 5009.237—2016《食品安全国家标准食品pH 值的测定》中pH 计法进行测定;亚硝酸盐含量参照GB 5009.33—2016《食品安全国家标准食品中亚硝酸盐与硝酸盐的测定》中盐酸萘乙二胺法进行测定,以亚硝酸钠为标准品绘制标准曲线所得线性回归方程为y=0.030 3x+0.002 1(R2=0.999 2),根据标准曲线计算样品中亚硝酸盐含量。
1.3.3.3 总DNA 提取和聚合酶链式反应扩增
总DNA 提取按照TGuide S96 磁珠法土壤/粪便DNA 提取试剂盒的说明书方法进行测定,使用1.8%琼脂糖凝胶电泳检测DNA,引物引用:338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')。扩增体系(10 μL):基因组DNA 5~50 ng,Vn F(10 μmol/L)0.3 μL,Vn R(10 μmol/L)0.3 μL,KOD FX Neo Buffer 5 μL,dNTP(2 mmol/L)2 μL,KOD FX Neo 0.2 μL,ddH2O 补充至10 μL;扩增参数:95 ℃5 min,95 ℃30 s,50 ℃30 s,72 ℃40 s,72 ℃7 min,4 ℃保持25~30 次循环。
1.3.3.4 测序数据处理与分析
微生物多样性是基于Illumina Novaseq 测序平台,利用双末端测序的方法,构建小片段文库进行测序。原始数据采用Trimmomatic v0.33 软件进行过滤,Cutadapt 1.9.1 软件进行引物序列的识别与去除,得到不包含引物序列的Clean Reads。Usearch v10 软件通过overlap对每个样品的Clean Reads 进行拼接,然后根据不同区域的长度范围对拼接后数据进行长度过滤。随后使用UCHIME v4.2 软件鉴定并去除嵌合体序列,得到最终有效数据。使用Usearch 软件对Reads 在97.0%的相似度水平下进行聚类、获得分类操作单元(operational taxonomic units,OTUs);利用QIIME 软件生成不同分类水平上的物种丰度表,再利用R 语言工具绘制成样品各分类学水平下的群落结构图;使用QIIME2 软件,对样品Alpha 多样性指数进行评估;使用QIIME 软件进行Beta 多样性分析。
2 结果与分析
2.1 发酵方式对黄精泡菜pH 值的影响
pH 值作为指标参数有效表现出发酵环境和泡菜的成熟状态[18]。发酵方式对黄精泡菜pH 值的影响见图1。

图1 发酵方式对黄精泡菜pH 值的影响Fig.1 Effects of fermentation methods on pH value of P.sibiricum pickles
由图1 可知,发酵时间为1~3 d 时,两种发酵方式下黄精泡菜pH 值均呈现快速下降的趋势,第3 天pH值达到3.0,处于稳定状态,表明两种发酵方式黄精泡菜在第3 天开始成熟。
2.2 发酵方式对黄精泡菜总酸含量的影响
发酵方式对黄精泡菜总酸含量的影响见图2。
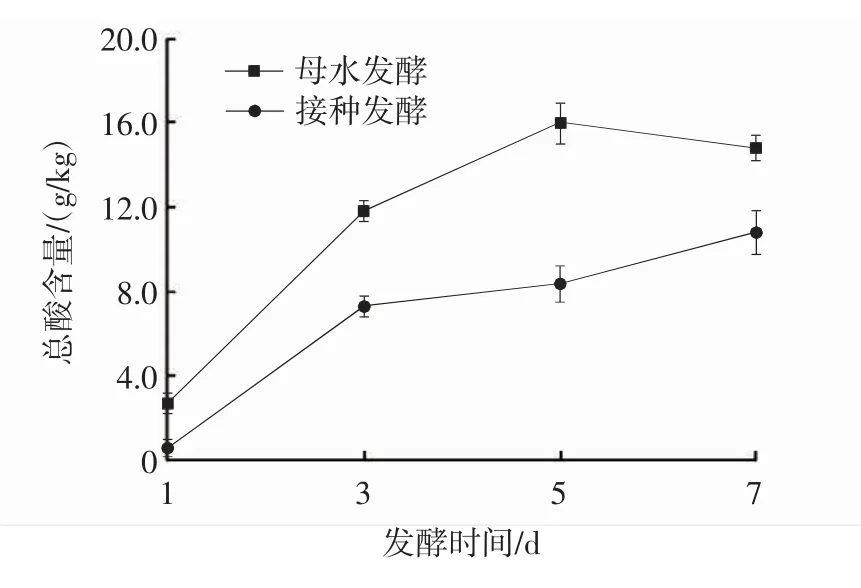
图2 发酵方式对黄精泡菜总酸含量的影响Fig.2 Effects of fermentation methods on total acid content of P.sibiricum pickles
由图2 可知,黄精泡菜发酵过程中接种发酵总酸含量始终低于母水发酵,两种发酵方式黄精泡菜初期总酸含量均较低,可能是发酵初期微生物处于适应期;发酵时间为1~3 d 时,两种发酵方式黄精泡菜总酸含量增长较快,接种发酵第3 天总酸含量为7.3 g/kg,母水发酵总酸含量为11.9 g/kg;接种发酵3~7 d 时,总酸含量增长速度降低,第7 天总酸含量为10.8 g/kg;母水发酵3~7 d 时,总酸含量呈先上升后下降的趋势,推测由于母水发酵在发酵后期有机酸和H+进一步积累,乳酸代谢途径因乳酸的积累产生反馈抑制作用[19]。研究表明总酸含量在6.0~8.0 g/kg 时的口感较佳[20],母水发酵1~3 d 达到最佳酸度范围,而接种发酵3~5 d 才到达最佳酸度范围。
2.3 发酵方式对黄精泡菜亚硝酸盐含量的影响
发酵方式对黄精泡菜亚硝酸盐含量的影响见图3。

图3 发酵方式对黄精泡菜亚硝酸盐含量的影响Fig.3 Effects of fermentation methods on nitrite in P.sibiricum pickles
泡菜发酵过程中硝酸盐在硝酸还原酶作用下还原成亚硝酸盐,亚硝酸盐达到一定量会致使食用人群细胞发生癌变[21-22],GB 2762—2022《食品安全国家标准食品中污染物限量》规定中要求泡菜亚硝酸盐含量不得高于20 mg/kg。由图3 可知,两种发酵方式黄精泡菜亚硝酸盐含量不超过1.7 mg/kg,远低于20 mg/kg 的标准限量,接种发酵亚硝酸盐含量最高仅为0.5 mg/kg,满足黄精泡菜食用安全。
2.4 发酵方式对黄精泡菜感官评分的影响
发酵方式对黄精泡菜感官评分的影响见图4。

图4 发酵方式对黄精泡菜感官评价的影响Fig.4 Effects of fermentation methods on sensory quality of P.sibiricum pickles
由图4 可知,两种发酵方式黄精泡菜感官评分随发酵时间的延长呈现先上升后下降的趋势。两种发酵方式下黄精泡菜第1 天的成熟度偏低,导致香味和风味较弱;母水发酵第3 天时,感官评分最高,接种发酵第5 天时,感官评分最高,此时两种发酵黄精泡菜气味纯正,质地脆嫩,形态完整,汁液清亮,整体口感最好;发酵第7 天两种黄精泡菜质地变软、口感偏酸且脆度降低。综上所述,两种发酵方式黄精泡菜口感良好,适用于工业化黄精泡菜生产。
2.5 高通量测序结果及分析
2.5.1 微生物Alpha 多样性
不同发酵方式和发酵时间下黄精泡菜中微生物Alpha 多样性见表2。

表2 Alpha 多样性指数统计Table 2 Alpha diversity indexes
由表2 可知,利用高通量测序对两种发酵方式黄精泡菜进行分析,共得到587 147 条序列。按照97.0%相似性对非重复序列进行分类操作单元聚类,得到OTUs 的代表系列,选出与OTUs 代表序列相似性在97.0%以上的序列,共划分得到162 个OTUs 分类。两种发酵方式黄精泡菜的测序覆盖率均接近1,表明本次测序结果能代表样品中微生物的真实情况;ACE 指数和Chao1指数相近,说明微生物群落丰富度相近。从Shannon 指数和Simpson 指数来看,母水发酵组数值均大于接种发酵组,说明母水发酵组样品微生物多样性较高;接种发酵第3 天Shannon 指数最大,第7 天最低;母水发酵Shannon 指数第1 天最高,第3 天最低,说明两种发酵方式微生物群落结构复杂,发生持续性变化。
2.5.2 微生物群落结构动态变化分析
2.5.2.1 门水平生物群落结构分析
不同发酵方式和发酵时间下黄精泡菜中微生物在门水平上分布见图5。

图5 门水平物种分布Fig.5 Microbial distribution at the phylum level
由图5 可知,不同发酵方式和发酵时间下黄精泡菜微生物群落共包含10 个门,其中厚壁菌门(Firmicutes,80.8%~98.6%)为绝对优势菌门,其次优势菌是变形菌门(Proteobacteria,0.8%~17.1%),Liang 等[23]研究发现泡菜中优势菌门也是厚壁菌门和变形菌门,与本试验结果一致。在接种发酵过程中,厚壁菌门相对丰度整体上呈上升趋势,是接种发酵中的优势门,第1 天相对丰度为86.4%,第7 天占比上升为91.1%;变形菌门相对丰度呈先升高后降低的趋势,第3 天相对丰度最高,为17.1%,第7 天降低到7.9%,推测由于发酵初期乳酸积累量少,随着发酵的进行乳酸积累,pH 值降低增加抑制变形菌门等杂菌的生长。在母水发酵中,厚壁菌门始终占比98.0%左右,主导整个发酵时期,而变形菌门等杂菌占比为1.0~2.0%。
2.5.2.2 属水平生物群落结构分析
不同发酵方式和发酵时间下黄精泡菜中微生物在属水平上分布见图6。对黄精泡菜中微生物相对丰度较高的前10 个优势属进行分析。

图6 属水平物种分布Fig.6 Microbial distribution at the genus level
由图6 可知,在接种发酵中,植物乳杆菌属(Lactiplantibacillus)是优势属,随发酵的进行整体上呈上升趋势,第1 天占比84.6%,第7 天上升至89.2%;拉恩氏菌属(Rahnella1)、肠杆菌属(Enterobacter)、沙雷氏菌(Serratia)等的占比逐渐下降,最终占比维持在1.0%~2.0%。接种发酵植物乳杆菌属占比较多,其他属占比不到20.0%,这可能与接种发酵使用的菌粉有关。在母水发酵中,随着发酵进行植物乳杆菌属占比减少,从第1 天占比50.1%下降至第7 天15.6%;迟缓乳杆菌属(Lentilactobacillus)第1 天占比为26.6%,第5 天上升至54.6%,此后波动较小;乳酸杆菌属(Lactobacillus)随着发酵进行占比上升,第7 天为15.1%,而嗜戊糖乳杆菌属(Secundilactobacillus)占比略微降低,从第1 天10.5%下降至7.3%。母水发酵中植物乳杆菌属、迟缓乳杆菌属、乳酸杆菌属、嗜戊糖乳杆菌属等均属于厚壁菌门中的乳杆菌属,表明乳杆菌在泡菜发酵过程中起到主要作用[24]。相比较于接种发酵,母水发酵过程中微生物属的种类占比变化较大,这是由于母水本身微生物组成比较复杂,随发酵进行变化较大。
2.5.3 微生物群落差异性分析
不同发酵方式和发酵时间下黄精泡菜中微生物群落主成分分析(principal component analysis,PCA)结果见图7。
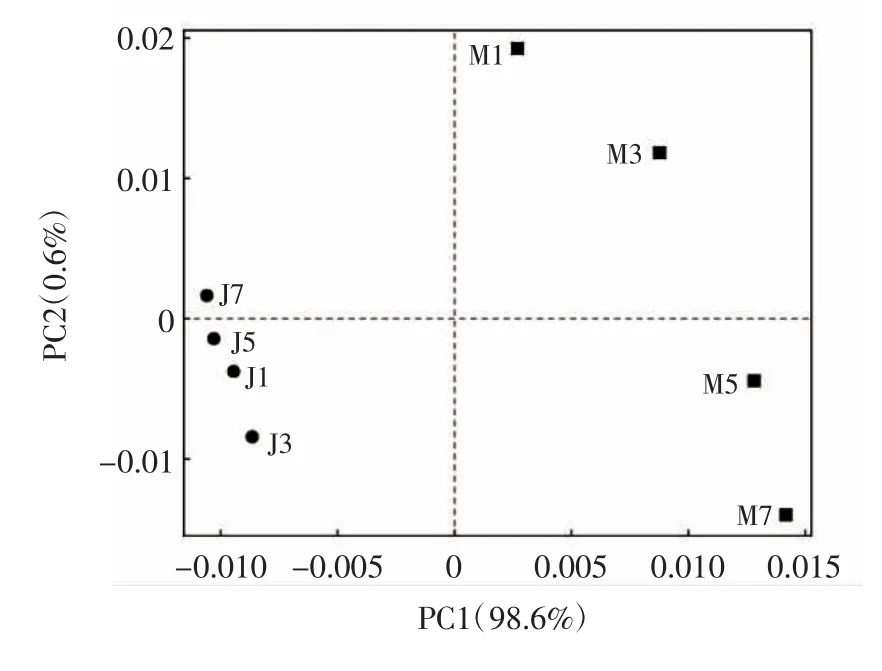
图7 PCA 分析图Fig.7 Principal component analysis plot
由图7 可知,第一主成分和第二主成分的贡献率分别为98.6%和0.6%。两种发酵方式黄精泡菜微生物群落距离较远,说明两种黄精泡菜微生物群落结构差异较大。接种发酵4 个样品离得比较近,说明随发酵的进行微生物群落结构变化较小,而母水发酵4 个样品分散度较高,说明随发酵的进行微生物群落结构变化较大。
3 结论
本文探究黄精泡菜发酵过程中pH 值、总酸含量及亚硝酸盐含量的变化,并利用高通量测序技术分析发酵方式不同导致的微生物多样性差异。两种黄精泡菜第3 天pH 值稳定在3.0,母水发酵总酸含量为11.9 g/kg,接种发酵总酸含量为7.3 g/kg,母水发酵第3 天和接种发酵第5 天成熟度最好,黄精泡菜酸脆爽口、形状完整、汁液清亮。母水发酵亚硝酸盐含量小于1.7 mg/kg,接种发酵亚硝酸盐含量小于0.5 mg/kg,均远低于20 mg/kg的标准限量。在微生物群落结构上,门水平上两种发酵方式厚壁菌门构成主要类群,其次是变形菌门;属水平上,接种发酵优势属是植物乳杆菌属,而母水发酵是植物乳杆菌属、迟缓乳杆菌属、乳酸杆菌属和嗜戊糖乳杆菌。Alpha 多样性指数表明两种发酵方式微生物群落丰富度相近,母水发酵微生物多样性高于接种发酵;PCA 分析表明,两种发酵方式黄精泡菜微生物群落结构差异较大,与母水发酵相比接种发酵群落结构变化较小。本研究丰富市场上泡菜种类的同时,为黄精药食同源产品的开发利用提供参考。

