构树花多糖提取工艺优化及其抗氧化活性
段雪伟,张敏君,王燕,杨慧文,刘冰,由天辉*
(1.广东药科大学 护理学院,广东 广州 510006;2.广东药科大学 药学院,广东 广州 510006)
构树[Broussonetia papyrifera(L.)Vent],别名褚桃,为桑科构属落叶乔木,分布于我国华北、华中、华南、西南、西北等地区[1]。研究表明构树皮和叶中含有丰富的黄酮和生物碱类成分,具有抗炎抑菌[2]、抗病毒[3]、抗肿瘤[4]等功效,构树花提取物可以抗衰老,对皮肤炎症也有较好的作用[5]。构树花分为雄花和雌花,雌花授粉形成果实,雄花脱落被大量丢弃。构树雄花富含多糖类物质,有食用的传统,安全性较高,且构树雄花花序繁茂,数量可观、来源广泛,具有潜在的开发价值。
多糖是一种广泛分布于自然界中的高分子聚合物,是构成动植物细胞的重要组成部分,并参与细胞的代谢及生理调节[6]。植物多糖是一种特殊的生物活性物质,具有无毒、无害、安全性高等优点,备受国内外学者青睐,大量研究表明植物多糖具有抗氧化[7]、抗炎[8]、调节免疫[9]、降血脂[10]等生理功效。目前,提取植物多糖的方法包括热水浸提法、超声辅助提取法、微波辅助提取法和酶法等,其中超声辅助提取法的原理是利用超声波的空化作用,增大植物细胞壁的通透性,加速多糖的析出,达到减少提取时间、提高多糖得率的目的[11]。
目前,国内外对构树花研究还鲜少报道,构树花资源没有被充分利用,因此本文以构树雄花为研究对象,通过超声辅助提取其活性多糖,在单因素试验的基础上,采用响应面法对提取工艺条件进行优化,并分析构树花多糖的体外抗氧化活性,旨在为深入挖掘构树花的综合利用价值提供试验依据,并对开发具有生物活性的多糖提供参考。
1 材料与方法
1.1 材料与试剂
构树花:采自安徽省亳州市,经广东药科大学中药学院程轩轩教授鉴定为桑科构属植物构树的雄花序;2,2'-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2'-azinobis -(3 -ethylbenzthiazoline -6 -sulphonate),ABTS]、抗坏血酸:美国Sigma 公司;苯酚、浓硫酸、无水乙醇、葡萄糖、亚硫酸钾、水杨酸、FeSO4、H2O2、邻苯三酚、盐酸:天津市东丽区天大化学试剂厂。以上化学试剂均为分析纯。
1.2 仪器
KQ-3200 DB 超声波清洗机:昆山市超声仪器有限公司;JC-TP 1204 型万分之一电子天平:青岛精诚仪器仪表有限公司;XWK-V108S 酶标仪:东莞西瓦卡精密量仪有限公司;YRE-5299 真空旋转蒸发仪器:河南佰年仪器有限公司。
1.3 方法
1.3.1 构树花多糖提取工艺
将构树花烘干、粉碎后过60 目筛,准确称取构树花粉末2.00 g,按照料液比1 ∶30(g/mL)、超声功率80 W、提取温度65 ℃、提取时间80 min、提取2 次,合并提取液,过滤、浓缩、定容至50 mL,加入3 倍体积的无水乙醇,4 ℃静置24 h,收集沉淀,冷冻干燥得构树花多糖。配制成5 mg/mL 的构树花多糖溶液,备用。
1.3.2 单因素试验
考察料液比[1 ∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶50(g/mL)]、超声功率(60、80、100、120、140 W)、提取温度(60、65、70、75、80 ℃)、提取时间(20、40、60、80、100 min)、提取次数(1、2、3、4、5)和乙醇浓度(65%、70%、75%、80%、85%)对构树花多糖得率的影响。考察某一因素时其他因素固定条件为料液比1 ∶30(g/mL)、超声功率80 W、提取温度65 ℃、提取时间80 min、提取2 次、乙醇浓度75%。
1.3.3 响应面试验设计
在单因素试验基础上,根据Box-Behnken 设计原理[12],以构树花多糖得率为响应值,选取4 个对响应值影响较大的因素(料液比、超声功率、提取温度、提取时间)为自变量,进行响应面分析。响应面试验因素水平见表1。

表1 Box-Behnken 试验设计因素水平Table 1 Factors and levels of Box-Behnken design
1.3.4 构树花多糖含量的测定方法
1.3.4.1 葡萄糖标准曲线的绘制
参考Chen 等[13]的方法,采用苯酚-浓硫酸法测定多糖含量,以葡萄糖溶液作为标准溶液,葡萄糖浓度为横坐标,对应的吸光度为纵坐标,得到回归方程为Y=2.018 7X+0.022 4(R2=0.992 4)。
1.3.4.2 多糖含量的测定
精密吸取一定体积的5 mg/mL 构树花多糖溶液,根据标准曲线得到多糖含量,再按公式(1)计算出构树花多糖得率(W,%)。
式中:C 为样品溶液中构树花多糖质量浓度,mg/mL;V 为测定液总体积,mL;D 为样品溶液稀释倍数;M 为构树花粉末原料质量,g。
1.3.5 构树花多糖体外抗氧化活性测定
1.3.5.1 构树花多糖对ABTS+自由基的清除作用
参考Huang 等[14]的方法,配制ABTS 溶液。向1 mL构树花多糖溶液(质量浓度为0.2~2.0 mg/mL)加入6 mL ABTS 溶液,在30 ℃水浴中充分避光反应6 min,于734 nm 处检测不同浓度构树花多糖吸光度Ax,以纯水代替ABTS 溶液测吸光度Ay,以纯水代替构树花多糖溶液测吸光度A0。以同浓度抗坏血酸作为对照,按公式(2)计算ABTS+自由基清除率(E,%)。
1.3.5.2 构树花多糖对羟自由基的清除作用
参考Zan 等[15]的方法,采用水杨酸法测定构树花多糖对羟自由基的清除能力。向2 mL 构树花多糖溶液(质量浓度为0.2~2.0 mg/mL) 内分别加入2 mL FeSO4溶液、2 mL 水杨酸溶液混匀后静置10 min,再加2 mL H2O2溶液后置于37 ℃水浴锅内反应0.5 h,510 nm 处测吸光度Ax,用纯水代替H2O2溶液测吸光度Ay,用纯水代替构树花多糖溶液测吸光度A0。以同浓度抗坏血酸作为对照,按公式(3)计算羟自由基清除率(F,%)。
1.3.5.3 构树花多糖对超氧阴离子自由基的清除作用
参考Chen 等[16]的方法测定构树花多糖对超氧阴离子自由基的清除能力。向2 mL 构树花多糖溶液(质量浓度为0.4~4.0 mg/mL) 中加入4.5 mL Tris-HCl 溶液,置于25 ℃水浴锅内充分反应20 min,再加0.4 mL邻苯三酚溶液,静置5 min 后加0.1 mL HCl 停止反应,在325 nm 处检测溶液吸光度Ax,以纯水代替邻苯三酚测得吸光度Ay,以纯水代替构树花多糖溶液测吸光度A0。以同浓度抗坏血酸作为对照,按公式(4)计算超氧阴离子自由基清除率(G,%)。
1.4 数据处理
所有试验均重复3 次,单因素试验数据运用Graph-Pad Prism 8 进行分析,响应面试验采用Design-Expert 8.6 软件进行分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 料液比对多糖得率的影响
料液比对构树花多糖得率的影响见图1。

图1 料液比对构树花多糖得率的影响Fig.1 Effect of solid-to-liquid ratio on the yield of polysaccharides from Broussonetia papyrifera flowers
由图1 可知,随溶剂体积增大,多糖得率先是逐渐上升,当料液比为1 ∶40(g/mL)时,多糖得率达5.49%,而后逐渐下降。这可能是因为当所用溶剂较少时,溶液浓度较大,多糖溶出不完全,得率较低,增大溶剂体积可以增加构树花与纯水的接触面积,利于多糖析出;继续增大纯水用量,可能会导致蛋白质等非多糖物质溶出,从而影响多糖含量,此外,溶剂体积的增加会延长后期高温浓缩时间,造成多糖分子结构破坏,也会降低多糖得率[17]。因此,选择料液比为1 ∶30、1 ∶40、1 ∶50(g/mL)进行后续试验。
2.1.2 超声功率对多糖得率的影响
超声功率对构树花多糖得率的影响见图2。

图2 超声功率对构树花多糖得率的影响Fig.2 Effect of ultrasonic power on yield of polysaccharides from Broussonetia papyrifera flowers
由图2 可知,超声功率较低时,构树花多糖得率随超声功率增大呈现明显增势,并在功率为100 W 时得率达到峰值5.78%。因为超声波有助于破坏植物细胞结构,促进多糖释放;当超声波功率较大时,多糖糖苷键会被超声波破坏,使多糖降解率大于多糖的析出率[18],降低多糖得率。因此,选择超声功率为80、100、120 W进行后续试验。
2.1.3 提取温度对多糖得率的影响
提取温度对构树花多糖得率的影响见图3。

图3 提取温度对构树花多糖得率的影响Fig.3 Effect of extraction temperature on yield of polysaccharides from Broussonetia papyrifera flowers
由图3 可知,在温度低于70 ℃时,多糖得率随提取温度升高而增加,当温度为70 ℃时,多糖得率最高,达到6.06%。升高温度可以可加速构树花中多糖的运动,有利于多糖的析出;提取温度超过70 ℃时,多糖结构会被高温破坏[19]。因此,选择提取温度为65、70、75 ℃进行后续试验。
2.1.4 提取时间对多糖得率的影响
提取时间对构树花多糖得率的影响见图4。
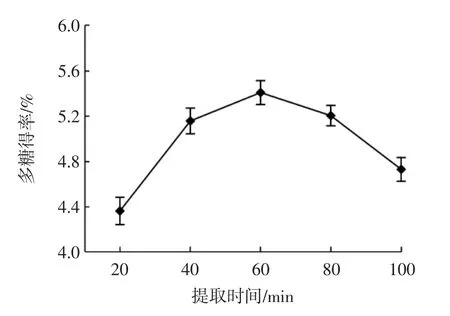
图4 提取时间对构树花多糖得率的影响Fig.4 Effect of extraction time on yield of polysaccharides from Broussonetia papyrifera flowers
由图4 可知,提取低于60 min 时,多糖得率随着提取时间的延长而升高,提取60 min 时,多糖得率最高,达到5.41%;因为提取时间太短时,多糖无法充分析出,超过60 min 时,大部分多糖已被提取出来,继续提取,多糖中的杂质析出使多糖得率下降[20]。因此,选择提取时间为40、60、80 min 进行后续试验。
2.1.5 提取次数对多糖得率的影响
提取次数对构树花多糖得率的影响见图5。

图5 提取次数对构树花多糖得率的影响Fig.5 Effect of extraction times on yield of polysaccharides from Broussonetia papyrifera flowers
由图5 可知,提取2 次时,多糖得率达到5.21%,提取3~5 次时,随着次数增加构树花多糖得率反而减少。可能是因为提取2 次时,大部分多糖已经被提取出来[21],多次提取也会增加后期浓缩时间。因此,将最佳提取次数确定为2 次。
2.1.6 乙醇浓度对多糖得率的影响
乙醇浓度对构树花多糖得率的影响见图6。

图6 乙醇浓度对构树花多糖得率的影响Fig.6 Effect of ethanol concentration on yield of polysaccharides from Broussonetia papyrifera flowers
由图6 可知,乙醇浓度低于75%时,多糖得率随乙醇浓度增加而升高,乙醇浓度为75%时,多糖得率为5.21%,随后趋于平缓。乙醇浓度为75%时,此时大部分多糖已经溶出[22],继续增加乙醇浓度,无法提高多糖得率,又会造成试剂的浪费。因此,将最佳乙醇浓度确定为75%。
2.2 响应面设计结果与分析
利用响应面软件Design Expert 8.6 进行四因素三水平的试验,设计方案见表2,回归模型方差分析见表3。
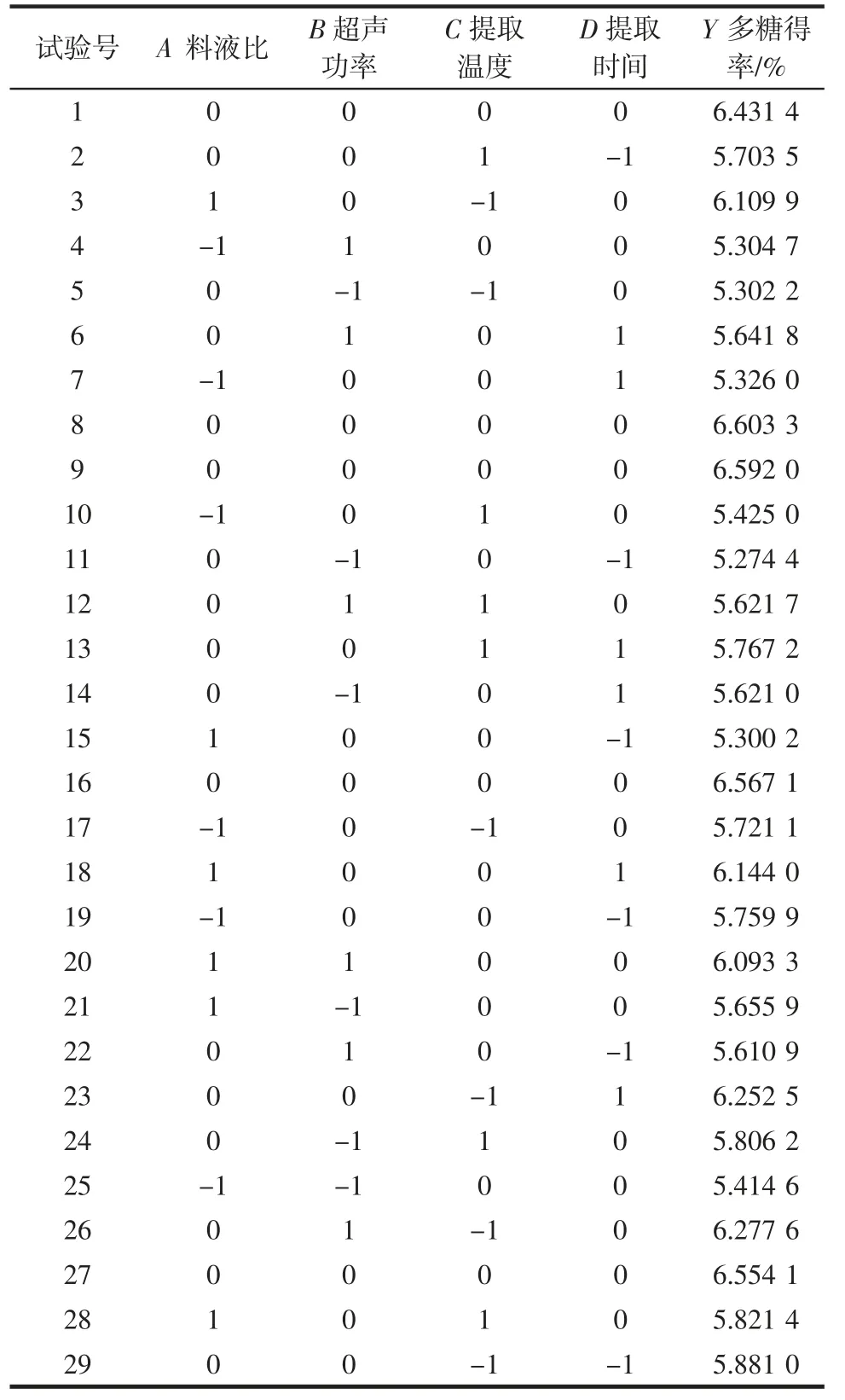
表2 响应面试验设计及试验结果Table 2 Experimental design and results of response surface methodology
2.2.1 模型方程建立与显著性检验
以构树花多糖得率(Y)为考察响应指标,建立其与料液比、超声功率、提取温度、提取时间4 个因素的回归模型,得到二次回归方程为Y=6.55+0.181 1A+0.123B-0.116 6C+0.101 9D+0.136 8AB+0.001 9AC+0.314 9AD-0.29BC-0.078 9BD-0.077CD-0.466 8A2-0.523 3B2-0.265 1C2-0.441D2。
由表3 可以看出,该回归模型P<0.000 1,具有高度显著性,模型总决定系数R2=0.962 6,R2Adj=0.925 2,表明有92.52%的试验值可用该模型预测,试验误差较小,能准确反映4 个因素对构树花多糖得率的影响。此外A、B、C、D、A2、B2、C2、D2、AD、BC 项的P<0.01,影响极显著;AB 项的P<0.05,具有显著性影响,而AC、BD、CD 的P>0.05,对指标无显著影响。比较F 值得出各因素对构树花多糖得率的影响大小为料液比>超声功率>提取温度>提取时间。
2.2.2 响应面分析
各个因素及其相互作用对构树花多糖得率的影响的3D 响应面如图7 所示。

图7 各因素交互作用对构树花多糖得率的影响Fig.7 Response surface plot of the effect of each factor on yield of polysaccharides from Broussonetia papyrifera flowers
两因素之间的交互作用是否显著可以从等高线形状看出,等高线为椭圆形,说明两因素交互作用对构树花多糖得率影响显著[23]。从图7 可以看出,AB、AD、BC 的等高线为椭圆形,说明构树花多糖得率受料液比和超声功率、料液比和提取时间、超声功率和提取温度的影响显著,与上述方差分析结果一致。
2.2.3 验证试验
通过分析回归模型可知,采用超声波辅助提取构树花多糖的最佳条件:料液比1 ∶43.123(g/mL),超声功率104.967 W,提取温度68.055 ℃,提取时间64.807 min,此最优条件下构树花多糖得率的预测值为6.63%。为验证结果可靠性,结合实际提取试验可行性,调整最终构树花多糖提取条件:料液比1 ∶43(g/mL),超声功率105 W,提取温度68 ℃,提取65 min,重复试验5 次,此最优提取工艺条件下,构树花多糖得率为6.66%,与预测结果接近,证明该试验模拟准确、有效,适用于构树花多糖的提取。
2.3 体外抗氧化活性结果与分析
2.3.1 构树花多糖对ABTS+自由基的清除能力
构树花多糖和抗坏血酸对ABTS+自由基的清除作用见图8。

图8 构树花多糖和抗坏血酸对ABTS+自由基的清除作用Fig.8 Scavenging effects of polysaccharides from Broussonetia papyrifera flowers and ascorbic acid on ABTS+ free radicals
如图8 所示,在试验配制的多糖浓度范围内,构树花多糖对ABTS+自由基表现出非常强的清除能力,且ABTS+自由基清除率与多糖浓度呈剂量效应关系。当构树花多糖浓度为2.0 mg/mL 时,清除率可达94.83%,此时构树花多糖的ABTS+自由基清除能力与抗坏血酸的最大清除能力接近,经线性拟合得出构树花多糖对ABTS+自由基清除率的半抑制浓度(IC50)为0.47 mg/mL,说明构树花多糖对ABTS+自由基表现出极好的清除能力。
2.3.2 构树花多糖对羟自由基的清除能力
构树花多糖和抗坏血酸对羟自由基的清除作用见图9。

图9 构树花多糖和抗坏血酸对羟自由基的清除作用Fig.9 Scavenging effects of polysaccharides from Broussonetia papyrifera flowers and ascorbic acid on hydroxyl radicals
如图9 所示,构树花多糖对羟自由基清除能力随多糖浓度升高而提高,当构树花多糖浓度升至2.0 mg/mL时,清除率达到88.3%,经线性拟合得出构树花多糖对羟自由基的IC50值为0.76 mg/mL,具有较强的羟自由基清除能力。
2.3.3 构树花多糖对超氧阴离子自由基的清除能力
构树花多糖和抗坏血酸对超氧阴离子自由基的清除作用见图10。

图10 构树花多糖和抗坏血酸对超氧阴离子自由基的清除作用Fig.10 Scavenging effects of polysaccharides from Broussonetia papyrifera flowers and ascorbic acid on superoxide anion radicals
如图10 所示,构树花多糖对超氧阴离子自由基清除能力与多糖浓度呈正比,浓度为4.0 mg/mL 时,清除率达到83.9%,经线性拟合得出构树花多糖对超氧阴离子自由基的IC50为2.47 mg/mL,在试验浓度范围内,相比较抗坏血酸,虽然构树花多糖对超氧阴离子自由基的清除率较弱,但仍表现出一定的清除能力。
3 结论
本试验优化了超声波提取构树花多糖的条件,通过对料液比、超声功率、提取温度、提取时间4 个因素的考察与响应面分析,得到构树花多糖的最优提取条件:当料液比1 ∶43(g/mL)时,在超声功率105 W 和提取温度68 ℃条件下,提取65 min,构树花多糖得率为6.66%。此外,对提取的构树花多糖进行了体外抗氧化活性分析,结果显示,构树花多糖对ABTS+自由基、羟自由基和超氧阴离子自由基的IC50值分别为0.47、0.76 mg/mL 和2.47 mg/mL,其结果弱于抗坏血酸。
综上所述,采用超声辅助提取法可有效提高构树花多糖的得率,所得构树花多糖体外抗氧化活性较强,可作为天然抗氧化剂应用于医疗或化妆品等领域,该结果可为提高构树花的利用价值提供参考。

