耐碳青霉烯类肺炎克雷伯菌对喹诺酮类药物的耐药特性及机制研究
宋曼雅,刘长鑫,张 侃,马 林,王 博,郭 桦,丁俊谕,赵慧珺,周治同,管希周
1解放军医学院,北京 100853;2 解放军总医院第八医学中心呼吸与危重症医学部,北京 100091
肺炎克雷伯菌是医院常见病原体,可引起血流、泌尿道、肺部等多个部位的感染,其中耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae,CRKP) 的出现给全球的公共卫生带来严重威胁。产碳青霉烯酶是CRKP对碳青霉烯类药物耐药的最重要机制,主要包括肺炎克雷伯菌碳青霉烯酶(Klebsiella pneumoniae carbapenemases,KPC)、新德里金属-β-内酰胺酶(New Delhi metallo-β-lactamase,NDM)、苯唑西林酶(oxacillinase 48 type enzyme,OXA-48)[1-2]。产碳青霉烯酶肺炎克雷伯菌通常携带对多种抗菌药物的耐药基因(喹诺酮类、氨基糖苷类、β-内酰胺类),从而对多种类型的抗菌药物产生耐药性[3]。喹诺酮类药物具有广谱抗菌活性,在临床上应用比较广泛,也用于治疗对碳青霉烯类不敏感的肺炎克雷伯菌感染,由于其广泛应用,耐药性不断增加[4]。环丙沙星为第三代喹诺酮类药物,在临床上应用近30 年后,WHO 将其评价为最佳抗生素之一[5]。莫西沙星和西他沙星为第四代的喹诺酮类药物,莫西沙星为呼吸喹诺酮类药物,其在肺组织中药物浓度较高,对部分病原体抗菌活性更强。西他沙星2019 年于我国上市,对其他喹诺酮类药物耐药的菌株仍具有相对较高的活性[6-7]。喹诺酮类药物是合成抗菌药物,作用机制主要是抑制细菌的DNA 促旋酶和拓扑异构酶Ⅳ[8]。喹诺酮的耐药机制包括喹诺酮耐药决定区(quinolone resistance determining region,QRDR) 的突变,获得质粒介导的喹诺酮耐药(plasmid mediated quinolone resistance,PMQR)基因,以及外排泵的过表达等[5]。全基因组测序(whole gene seqencing,WGS)对于了解病原体的耐药特点,流行特征等具有显著优势[9]。本实验通过药敏试验研究CRKP 对喹诺酮类药物的耐药特性,通过PCR 及全基因组测序研究CRKP 对喹诺酮类药物的耐药机制,探明其分子病原学特征,为治疗该菌导致的感染提供实验依据。
材料与方法
1 菌株来源 收集解放军总医院2015 -2018 年临床分离CRKP 29 株,无同一患者分离的重复菌株,标本来源均为血液。其中blaKPC阳性CRKP菌株21 株,blaOXA-48阳性CRKP 菌株5 株,blaNDM阳性CRKP 菌株3 株,菌株均经VITEK 系统进行鉴定,至少对碳青霉烯类药物中的一种耐药。本研究经解放军总医院伦理委员会批准,批件号:S2021-689-01。
2 主要仪器及试剂 包括梅里埃VITEK MS 全自动快速微生物质谱检测仪,梅里埃VITEK 2 Compact 全自动药敏分析仪,NanoDrop2000 超微量分光光度计,美国伯乐BIO-RAD 公司荧光定量PCR 仪;西他沙星购自美国GLPGIO 公司,莫西沙星、环丙沙星、替加环素、黏菌素购自美国Med ChemExpress 公司,依拉环素购自上海麦克林生化科技有限公司,外排泵抑制剂1-(1-萘甲基)哌嗪(NMP) 购自上海毕得医药科技股份有限公司。美国因美纳公司HiSeqTM、TruSeqTMDNA Sample Prep Kit。
3 细菌鉴定及药敏试验 采用梅里埃VITEK MS质谱仪和梅里埃VITEK 2 Compact 全自动药敏分析仪分别进行菌株鉴定及常规药敏测定。用微量肉汤稀释法分别测定西他沙星、环丙沙星、莫西沙星对CRKP 的最低抑菌浓度(minimal inhibitory concentratio,MIC)值。莫西沙星、环丙沙星的折点根据CLSI M100(第20 版)描述的标准对药敏结果进行判定[10];西他沙星的折点参照文献中的标准。MIC≤1 μg/mL 为敏感,MIC≥4 μg/mL 为耐药[11];药敏试验的质控菌株为大肠埃希菌ATCC 25922。
4 联合药敏试验 根据棋盘法设计原理和微量肉汤稀释法操作要求进行联合药敏试验,西他沙星的参考折点同前,黏菌素根据CLSI M100(第20 版)描述的标准对药敏结果进行判定[10]。替加环素参考欧洲抗微生物药敏试验委员会(EUCAST) 推荐标准对药敏结果进行判读,替加环素MIC≤2 μg/mL为敏感,MIC≥8 μg/mL 为耐药[12]。依拉环素尚无药敏折点判定标准,参照替加环素判断标准进行判定。联合抑菌指数(fractional inhibitory concentration index,FIC) 计算:FIC=联合后甲药MIC/联合前甲药MIC+联合后乙药 MIC/联合前乙药MIC。FIC≤0.5 为两药存在协同作用,0.5<FIC<1为两药存在部分协同作用,1 为两药存在相加作用,l<FIC≤4 为两药无相关作用,FIC>4 为两药有拮抗作用。对于出现协同或相加的联合药敏试验结果,均重复2 次试验,取2 次相同的结果[13]。
5 外排泵抑制剂对西他沙星MIC 值影响分析采用微量肉汤稀释法,在西他沙星中添加固定浓度的外排泵抑制剂NMP(1-甲基-2 吡咯烷酮),使西他沙星的最终浓度为0.062 5~ 128 mg/L,NMP的最终浓度为75 mg/L,比较添加NMP 后对西他沙星MIC 值的影响。
6 QRDR 突变的鉴定 根据细菌DNA 提取试剂盒的说明书提取细菌DNA,引物(表1)根据参考文献[14]进行设计,运用荧光定量PCR 仪扩增目的基因gyrA 和parC。将检测为阳性的DNA 扩增产物送至上海生物工程有限公司进行Sanger 测序,测序结果通过BLAST 在美国国家生物技术信息中心数据库中(national center for biotechnology information,NCBI)进行比对分析。
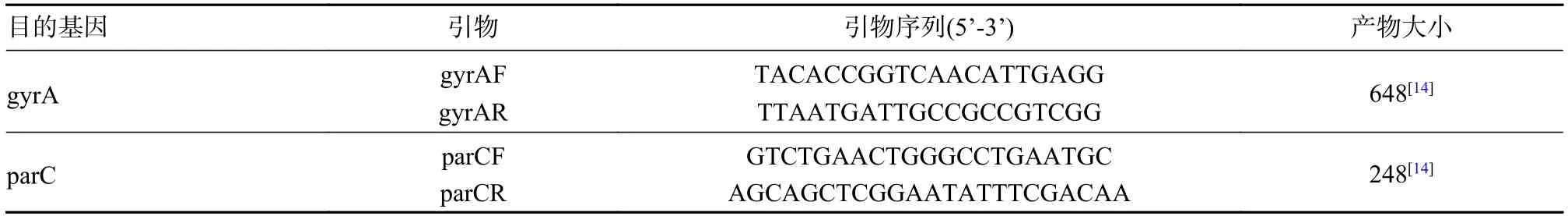
表1 GyrA 和ParC 基因的引物序列及产物大小Tab.1 Primer sequences and product sizes for GyrA and ParC genes
7 全基因组测序菌株DNA 提取、测序、组装 根据说明书使用NEBNext®UltraTMD-NA Library Prep Kit 提取试剂盒提取菌株DNA,提取出的DNA 在Nanodrop2000 超微量分光光度计上检测浓度,用Quantus Fluorometer 检测试剂盒对DNA 的浓度进行定量。提取的DNA 在illumina HisSeqTM平台上进行测序,总测序读长为300 bp。构建文库采用TruSeqTMDNA Sample Prep Kit,根据说明书进行操作。通过Abricate V1.0.1 检测,将全基因组测序结果提交至CARD、Resfinder 等数据库进行耐药基因、MLST 分型、外排泵基因的注释分析。
8 统计学分析 采用SPSS 26.0 统计学软件对数据进行分析。P<0.05 为差异有统计学意义。
结果
1 CRKP 耐药率29株CRKP菌株对西他沙星、莫西沙星、环丙沙星的耐药率分别为90%、93%、93%,西他沙星MIC50值是莫西沙星的4 倍,环丙沙星的8 倍,西他沙星MIC90值是莫西沙星的2 倍,环丙沙星的4 倍,见表2。西他沙星对blaKPC、blaNDM、blaOXA-48阳性的CRKP 的敏感度分别为4.7%、66.6%、0;耐药率分别为95.3%、33.4%、100%;莫西沙星、环丙沙星对blaKPC、blaNDM、blaOXA-48阳性的CRKP 的敏感度分别为0、66.6%、0,耐药率分别为100%、33.4%、100%,见表3。

表2 CRKP 对喹诺酮类药物的耐药率和敏感度Tab.2 Susceptibility of CRKP to antimicrobial agents
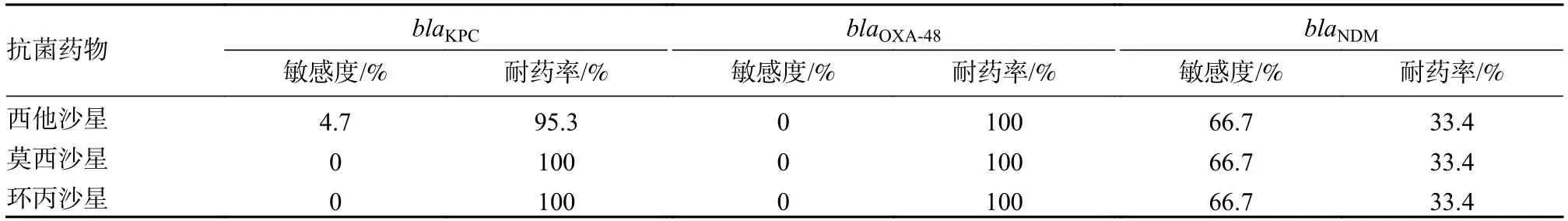
表3 不同基因型CRKP 对喹诺酮类药物的耐药率和敏感度Tab.3 The resistance and susceptibility rates of different CRKP genotypes to quinolones
2 西他沙星联合黏菌素、替加环素、依拉环素对CRKP 的体外活性 西他沙星联合黏菌素协同率为10%,部分协同率为17%,相加作用为17%,无关作用为30%,未发现拮抗作用。西他沙星的MIC50值为单药时的4 倍,MIC90为单药时的2 倍,黏菌素MIC50值为单药时的2 倍。西他沙星联合替加环素部分协同率为3%,相加作用为3%,无关作用为87%。西他沙星联合依拉环素协同率为3%,部分协同率为14%,相加作用为3%,无关作用为80%,未发现拮抗作用。依拉环素MIC50值为单药时的6.7 倍,MIC90与单药应用时的相同。见表4。
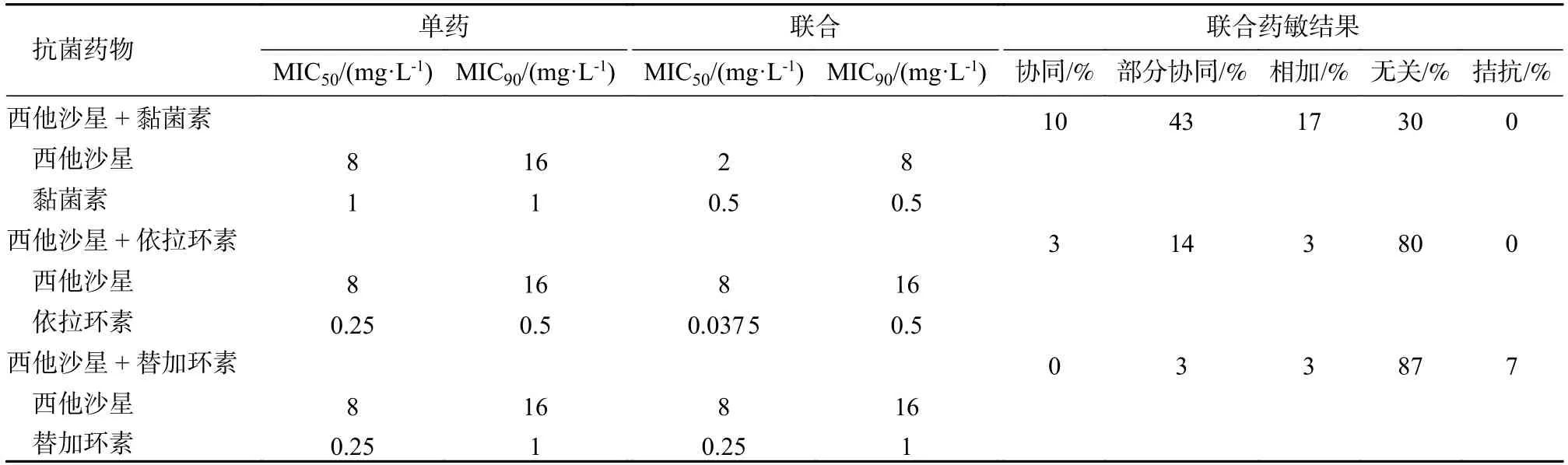
表4 西他沙星联合其他药物对CRKP 的体外抗菌活性Tab.4 In vitro antimicrobial activity of sitafloxacin in combination with other antimicrobial agents against CRKP
3 29株CRKP 中QRDR 突变率blaKPC、blaNDM、blaOXA-48阳性菌株突变率分别为95%、0、100%。blaKPC阳性的CRKP 菌株21 株中20 株(95%)存在GyrA突变,其中19株为(Ser83→Ile)和(Asp87→Gly)突变,1 株为(Ser83→Phe)和(Asp87→Ala)突变,8 株(38%) 为ParC(Ser83→Ile) 突变,1 株未发现任何突变。blaOXA-48阳性的CRKP 菌株5 株(100%)均存在突变(Ser83→Phe)和(Asp87→Asn),3 株(60%) 存在ParC(Ser83→Ile) 突变。blaNDM阳性的CRKP 菌株3 株均未发现突变。29 株CRKP总共有86% CRKP 菌株在gyrA 中存在至少2 个以及parC 中的第3 个突变。3 种不同基因型CRKP菌株gyrA 亚基氨基酸的取代类型存在一定差异,比较不同氨基酸取代的菌株之间MIC 值差异,均无统计学意义(P>0.05)。见表5。
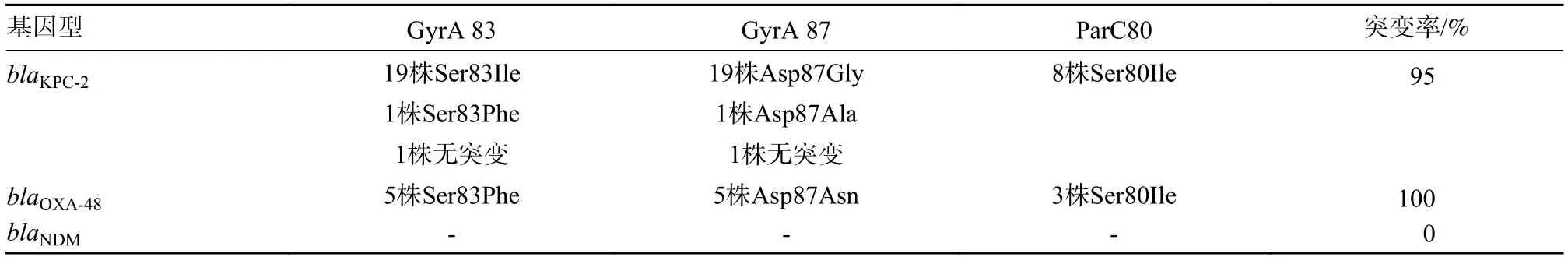
表5 不同基因型CRKP 中QRDR 突变情况Tab.5 QRDR mutations in different CRKP genotypes
4 质粒介导的喹诺酮耐药基因携带情况 29 株CRKP 中21 株blaKPC-2阳性,1 个菌株blaNDM-5阳性,2 个菌株blaNDM-1阳性,5 个菌株blaOXA-48阳性。PMQR 基因的携带情况:29 株CRKP 菌株中有24 株发现携带PMQR 基因,总检出率为83%,共携带4 种PMQR 基因,分别为qnrB4、qnrB17、oqxAB、aac(6’)-lb-cr,qnrB4 的检出率为10.3%,qnrB17 检出率为6.8%,oqxAB 检出率为79.3%,aac(6’)-lb-cr 检出率为3.4%;gyrA 和parC 的QRDR突变和PMQR 基因共存率为69.0%。见表6。

表6 PMQR 基因的阳性率Tab.6 Prevalence of PMQR gene carriage
5 外排泵的携带情况 在这些菌株中检测到多种类型的外排泵基因:外排泵家族类型包括RND(耐药结瘤和细胞分裂)家族外排泵、MFS(主要促进者超家族)、MATE(多药和毒性化合物挤出)、ABC(ATP 结合盒) 超家族;其中RND 家族外排泵AcrAB-TolC 在所有菌株中均检测到,oqxAB的检出率为79.3%。外排泵抑制剂使西他沙星对CRKP 的敏感度由10% 上升至83%,耐药率由90%降至7%。见表7。

表7 RND 家族外排泵阳性率Tab.7 Positive rate of RND family efflux pumps
6 多位点序列分型29株菌株共检测到8 种ST 分型,其中blaKPC阳性菌株有4 种类型,分别为ST11、ST15、ST86、ST2237,ST11 型占比最大,85.7%的blaKPC阳性菌株属于ST11 型;5 株blaoxa-48阳性菌株均属于ST383 型;3 株blaNDM阳性菌株分别为ST23、ST55、ST65 型。见表8。

表8 不同基因型CRKP 的ST 分型Tab.8 ST typing of CRKP of different genotypes
讨论
产KPC 酶、NDM 酶、OXA-48 酶CRKP 在全世界流行,给全球公共卫生带来巨大挑战[15]。喹诺酮类药物抗菌谱广,对革兰阳性或阴性细菌均有活性,是目前应用最广泛的药物之一[16]。肺炎克雷伯菌对氟喹诺酮类药物的耐药性及耐药机制的模式在不同的国家存在一定差异[4]。在本研究中,解放军总医院CRKP 对喹诺酮类药物的耐药率均在90%以上,CRKP 对新一代的喹诺酮类药物西他沙星的耐药率与莫西沙星、环丙沙星差异不大,考虑不同喹诺酮药物之间存在交叉耐药性。但西他沙星对CRKP 的活性强于莫西沙星及环丙沙星。产NDM 酶CRKP 对喹诺酮类药物敏感性较好,但本研究中产NDM 酶CRKP 数量较少,还需扩大样本量来进一步验证。联合药敏试验结果显示,西他沙星联合黏菌素、依拉环素、替加环素对CRKP 均有协同或部分协同等抗菌作用。其中以与黏菌素的联合作用最为显著。呈现协同部分协同或相加作用的菌株为70%,呈无关作用的菌株仅为30%。两药联用时,西他沙星与黏菌素的活性均较前提高。西他沙星的logP 值表明西他沙星是疏水性药物,黏菌素对细胞膜的完整性的破坏增强了疏水剂的敏感性可能是黏菌素增强西他沙星敏感性的作用机制[17]。
通过进一步研究CRKP 对喹诺酮类药物的耐药机制,我们发现86.2% 的菌株QRDR 存在突变,这比Zeng 等[18]的研究中5% 的CRKP 突变率要高,与Zhan 等[4]的研究中78.5% 的CRKP突变率相近。而本研究中对不同基因型的CRKP突变率做了统计,发现blaKPC-2、blaOXA-48阳性的菌株QRDR 突变率较高,而blaNDM阳性的菌株QRDR 区均未发现突变。这可能是blaNDM阳性的菌株对喹诺酮类药物敏感性较好的主要原因。但本研究中blaNDM阳性菌株的数量较少,还需扩大样本量做进一步的验证。突变的菌株累积突变位点均为2 个及以上,至少在gyrA 亚基上存在83位和87 位的两个突变,伴或不伴parC 亚基80 位的突变。不同基因型的CRKP 的QRDR 突变类型存在差异,考虑为同一基因型的菌株之间通过克隆扩增进行了垂直传播导致的。比较两者对喹诺酮类药物耐药性的区别,未发现显著差异。QRDR存在突变的菌株对于环丙沙星、莫西沙星介导的大多为高水平的耐药(MIC≥16 mg/L),对西他沙星介导的大多是中等水平的耐药(MIC≤8 mg/L),可见西他沙星对QRDR 突变菌株的抑制能力要强于环丙沙星、莫西沙星,未存在突变的菌株对喹诺酮类药物敏感性较好,可见QRDR 突变是CRKP 对喹诺酮类药物主要耐药机制之一。
PMQR 质粒介导的耐药基因被认为赋予了菌株对喹诺酮类药物低水平的耐药[19]。本研究中主要检出4 种PMQR 基因,qnrB4、qnrB17、oqxAB、aac(6’)-lb-cr,其中外排泵基因oqxAB 的携带率最高,是PMQR 中主要的耐药基因。病原体多药耐药性和外排泵的过表达具有重要相关性。造成多药耐药性的RND 家族外排泵是最具特征性的,其过表达是革兰阴性菌产生多药耐药的主要原因之一[20]。全基因组测序结果表明,解放军总医院CRKP 菌株广泛携带RND 家族外排泵AcrAB-TolC 及oqxAB。添加外排泵抑制剂后,西他沙星对CRKP 的敏感度由10%升至83%,耐药率由90%降至7%。可见外排泵的过表达是CRKP对喹诺酮类药物重要耐药机制。
29 株肺炎克雷伯菌分别属于8 种不同ST 分型。85.7%的blaKPC阳性菌株属于ST11 型,ST11型CRKP 菌株是解放军总医院优势传播耐药菌株。
综上所述,本研究发现解放军总医院blaKPC-2、blaOXA-48阳性CRKP 的QRDR 突变率较高,blaNDM阳性CRKP 的QRDR 未发现突变,外排泵抑制剂可大大降低CRKP 对喹诺酮类药物的耐药性,QRDR 的突变及外排泵的过表达是CRKP 对喹诺酮类药物的主要耐药机制。解放军总医院的优势克隆菌株为ST11 型CRKP。本研究存在的局限性为blaOXA-48、blaNDM阳性CRKP 菌株数量较少,可能无法反映该类菌株的特点。
作者贡献宋曼雅:总体构思,调查研究,撰写初稿;刘长鑫、张侃、马琳:方法设计,监督指导;王博、郭桦、丁俊谕:审读;赵慧珺、周治同:项目管理;管希周:总体构思,监督指导,审读和修订。
利益冲突所有作者声明无利益冲突。
数据共享声明本论文相关数据可依据合理理由从作者处获取,Email:17865650806@163.com。

