circSLCO1B3在三阴乳腺癌脑转移中的作用及其调控机制
张颖,宋彩露,刘凌蕊,唐海林,赖洁兰
中山大学肿瘤防治中心,广东广州 510060
乳腺癌是全世界发病率最高的女性恶性肿瘤,根据世界卫生组织国际癌症研究机构2020 年全球癌症负担数据,2020 年估计全球新增乳腺癌230 万例,已经超过肺癌成为全球第一大癌症[1]。三阴乳腺癌(TNBC)临床表现恶性程度高,侵袭性强,病理学分级较高,容易发生远处转移。在所有乳腺癌分子亚型中,TNBC 患者脑转移发生率最高,其发生发展的分子机制一直是科学研究的热点问题[2]。环状RNA(circRNA)是一类非编码RNA,在调节基因表达和肿瘤的发生发展中发挥着至关重要的作用[3]。研究发现,circRNA 在TNBC 生长与肺转移中具有重要的调控作用。例如,circKIF4A 和circEPSTI1 在TNBC 中显著上调,且其高表达与TNBC 的不良预后呈正相关。敲低circKIF4A 和circEPSTI1 可显著抑制TNBC 的增殖和迁移[4-5]。本课题组经预实验发现,circSLCO1B3(SLCO1B3 来源的 hsa_circ_0025580)在TNBC 脑转移细胞系中显著低表达。本研究拟探究circSLCO1B3 对TNBC 脑转移的作用及其可能的调控机制,为TNBC 脑转移靶向治疗药物的寻找提供新的研究思路。
1 材料与方法
1.1 试剂及仪器 RPMI1640、DMEM/F12 培养基、马血清、表皮生长因子、氢化可的松、胰岛素、胎牛血清、1%双抗(102 U/mL 青霉素及0.1 g/L 链霉素)(Gibco,美国)、Lipo 3000、RIPA 蛋白裂解液及PMSF抑制剂、抗体PTEN 及GAPDH(Affinity,美国),过表达circSLCO1B3 的慢病毒质粒(circSLCO1B3-OE)及其对照(circCTR-OE)、敲低circSLCO1B3的慢病毒质粒(sh-circSLCO1B3)及其对照(sh-circCTR)、miR-155模拟物(miR-155 mimics)及其对照(miR-CTR)、Nase R酶、细胞核/胞质细胞组分提取试剂盒(上海碧云天生物技术有限公司,中国)、TaqMan逆转录及荧光定量PCR 试剂盒(TaKaRa,日本),0.8 nm Transwell 小室及基质胶(BD,美国),Nanodrop 2000 紫外可见分光光度计(Thermo,美国),OLYMPUS BX51 正置显微镜(奥林巴斯,日本)。
1.2 细胞来源及培养 ATCC来源的人正常乳腺上皮细胞MCF-10A,人非TNBC 细胞系MCF-7、T47D、BT474、SKBR-3、BT20、BT483、HCC1569,人TNBC细胞系MDA-MB-231、MDA-MB-361、MDA-MB-436、MDAMB-453、MDA-MB-468、BT-549、HCC-38、HCC1599和HCC1806,人脑转移TNBC 细胞系231Br(通过左心室注射将亲代TNBC 肿瘤细胞MDA-MB-231 植入免疫缺陷小鼠而衍生的;从收获的脑转移瘤中提取转移细胞,再经两轮注射—提取—脑转移形成循环产生的,其显示出丰富的脑转移活性[6])以及小鼠TNBC 细胞系4T1。其中,MCF-10A 细胞培养于含1%马血清、20 ng 表皮生长因子、0.5 μg 氢化可的松、10 μg/mL 胰岛素以及1%双抗的DMEM/F12 培养基中,其余细胞均培养于含10%胎牛血清、1%青霉素和链霉素的RPMI1640培养基中。
1.3 实验方法
1.3.1 稳转细胞株构建 取生长状态良好、汇合度达70%左右的231Br细胞,弃培养基,PBS清洗2次,更换新鲜培养基,分别将circSLCO1B3-OE 和circCTR-OE病毒液加入目的细胞和对照细胞293T中;培养箱内培养24 h后,弃含病毒液的培养基,更换新鲜完全培养基;继续培养48 h 后,更换含2 μg/mL 的嘌呤霉素完全培养基筛选稳定过表达circSLCO1B3 的细胞株及其对照细胞株。继续传代筛选并传3 代后,通过qRT-PCR 验证circSLCO1B3 的过表达效率,冻存稳转细胞株备用,分别命名为231Br/OE(circSLCO1B3稳定过表达组,即circSLCO1B3-OE组)和231Br/CTR(对照组,即circCTR-OE组)。
1.3.2 细胞侵袭能力检测 采用Transwell侵袭实验。将231Br/OE和231Br/CTR细胞分别制成2×105/mL单细胞悬液。在Transwell 小室中铺加基质胶,培养箱内静置6 h 成膜后取出。小室中加入150 μL 单细胞悬液,下方24孔板孔中则加入350 μL含20%的FBS培养基。于培养箱中常规培养24 h 后取出小室,0.5%结晶紫染色,清洗并晾干小室后,于镜下观察并统计染色细胞数目。
1.3.3 脑转移动物模型构建 4~6 周龄雌性NOD/SCID 小鼠购自广东药康生物科技有限公司。将231Br/OE细胞或对照231Br/CTR 细胞经左心室注射成瘤(每组5 只),1 月后摘除脑组织,肉眼统计肿瘤结节形成数,石蜡包埋后切片进行HE染色检测。
1.3.4 circSLCO1B3 亚细胞定位分析 根据细胞核/胞质细胞组分提取试剂盒的说明书进行操作,提取细胞胞质及胞核RNA,采用qRT-PCR 检测细胞核对照18S、细胞质对照GAPDH 和circSLCO1B3 分别在细胞质和细胞核中的相对表达量,并根据在胞核和胞质中所占的比例作图。
1.3.5 circSLCO1B3、PTEN 与miR-155 之间的结合关系验证 采用双荧光素酶报告基因实验。①circ-SLCO1B3 与miR-155 之间的结合关系验证。通过生物信息学软件CircInteractome 预测,发现circSLCO1B3序列中存在多个miR-155结合位点。将2×104个231Br 细胞接种到6 孔板中,培养箱内常规培养24 h。使用Lipo 3000 分别进行共转染,共转染分组分别为:野生型circSLCO1B3+miR-NC、野生型circ-SLCO1B3+miR-155、突变型circSLCO1B3+miR-NC、突变型circSLCO1B3+miR-155,转染后按照试剂盒说明书进行后续操作[7],qRT-PCR 检测相对荧光素酶的活性用以验证circSLCO1B3 与miR-155 之间的结合关系。②miR-155 与PTEN 之间的结合关系验证。通过TargetScan 预测miR-155的下游靶点,发现PTEN 的3'UTR 存在miR-155 的潜在结合位点。转染方法同上,共转染分组分别为:野生型PTEN+miR-NC、野生型PTEN+miR-155、突变型PTEN+miRNC、突变型PTEN+miR-155,操作方法同上,qRTPCR 检测相对荧光素酶的活性用以验证miR-155 和PTEN之间的作用关系。
1.3.6 circSLCO1B3、PTEN mRNA、miR-155检测采用qRT-PCR。根据RNA抽提试剂盒说明书进行操作,分别提取细胞总RNA,于紫外可见分光光度计上检测合格后储存于-20 ℃中备用。使用TaKaRa逆转录、荧光定量PCR 试剂盒(使用IQTM5 Multicolor 实时荧光定量系统,美国BioRad)进行相对表达量分析。circSLCO1B3、PTEN、miR-155 及其对照引物均购自广州复能基因有限公司,反应体系为20 μL,每组含3个复孔。使用2-ΔΔCT计算分子的相对表达量。
1.3.7 PTEN 蛋白检测 采用蛋白质印迹分析。RIPA 裂解法从细胞中提取总蛋白,然后进行SDSPAGE 凝胶分离实验。蛋白的转膜条件为300 mA进行2 h。随后转移PVDF 膜至4 °C 冰箱中,一抗PTEN(1∶1 000)和GAPDH(1∶3 000)分别孵育过夜,次日在室温条件下采用特异性二抗孵育2 h,最后进行显影成像,检测PTEN的蛋白表达。
1.4 统计学方法 采用SPSS25.0 统计软件。实验均重复至少3 次。正态分布的计量资料以表示,组间比较采用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 circSLCO1B3 在TNBC 细胞中低表达 与正常乳腺上皮细胞MCF-10A 相比,circSLCO1B3 在TNBC细胞系中的表达均下调,且在脑转移相关的TNBC细胞HCC38、MDA-MB-231、231Br及鼠源性TNBC细胞4T1 中下调尤为显著(P均<0.05);与亲代TNBC细胞系MDA-MB-231相比,子代脑转移细胞系231Br中的circSLCO1B3 表达下调更为显著(P<0.05),见图1。

图1 qRT-PCR检测circSLCO1B3在正常乳腺上皮细胞及不同分子分型的乳腺癌细胞中的表达情况
2.2 过表达circSLCO1B3可抑制TNBC 细胞侵袭能力 qRT-PCR结果显示:与circCTR-OE组相比,circ-SLCO1B3-OE 组circSLCO1B3 的相对表达量显著增加(t=11.82,P<0.05,图2),circSLCO1B3过表达细胞株231Br/OE 构建成功。Transwell 侵袭实验结果显示:与circCTR-OE 组相比,circSLCO1B3-OE 组细胞的侵袭数量显著降低(t=4.084,P<0.05,图3-4)。
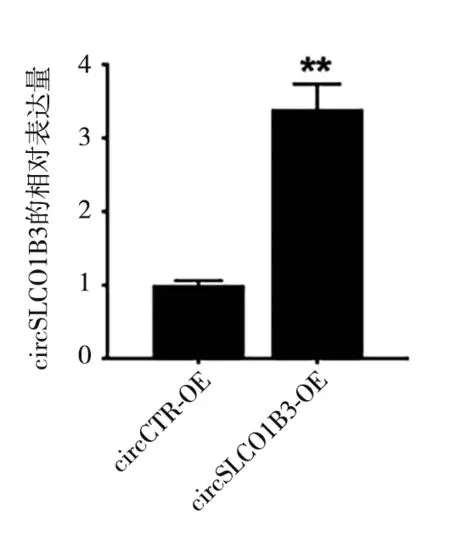
图2 两组circSLCO1B3表达比较
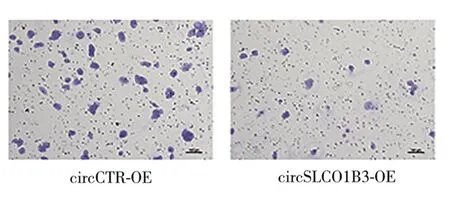
图3 Transwell侵袭实验中的代表性穿膜细胞图

图4 两组侵袭细胞数比较
2.3 过表达circSLCO1B3可抑制TNBC 细胞的脑转移能力 左心室注射构建的脑转移模型结果显示:与circCTR-OE 组相比,circSLCO1B3-OE 组细胞的脑转移结节数量显著降低(t=3.600,P<0.05,图5)。circCTR-OE 组和circSLCO1B3-OE 组的脑转移灶HE染色代表性图片如图6所示,过表达circSLCO1B3能抑制TNBC细胞的脑转移能力。
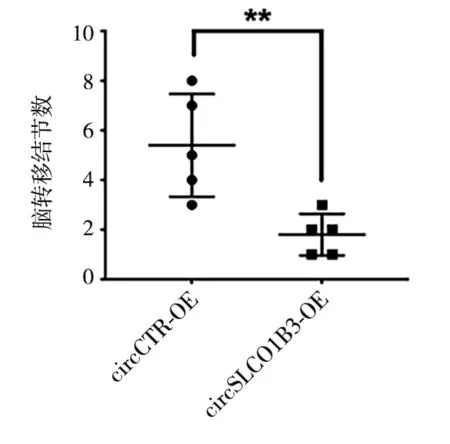
图5 两组脑转移结节数比较
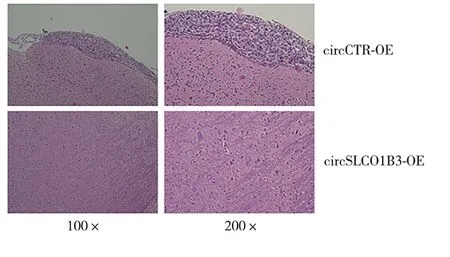
图6 脑转移组织HE染色
2.4 circSLCO1B3 可作为ceRNA 吸附miR-155 亚细胞定位实验结果显示:与细胞核相比,circSLCO1B3在细胞质中相对含量高(t=49.15,P<0.05,图7A),circSLCO1B3 的亚细胞定位主要为细胞质。荧光素酶报告基因实验结果显示:与野生型circSLCO1B3+miR-NC 共转染组相比,野生型circSLCO1B3+miR-155 组的相对荧光酶活性显著降低(t=15.85,P<0.05,图7B);与突变型circSLCO1B3+miRNC 组相比,突变型circSLCO1B3+miR-155 组的相对荧光酶活性无显著变化(t=1.059,P>0.05,图7B)。进一步的qRT-PCR 结果显示,与circCTR-OE 组相比,circSLCO1B3-OE 组miR-155 的相对表达量显著降低(t=10.37,P<0.05,图7C)。以上结果表明在TNBC 中,circSLCO1B3 可吸附miR-155,下调miR-155的表达水平。
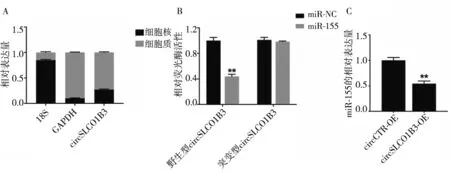
图7 circSLCO1B3可作为ceRNA吸附miR-155
2.5 circSLCO1B3 通过miR-155/PTEN 调控TNBC脑转移 荧光素酶报告基因实验结果显示:与野生型PTEN+miR-NC 共转染组相比,野生型PTEN+miR-155 组的相对荧光酶活性显著降低(t=29.09,P<0.05,图8A);与突变型PTEN+miR-NC 组相比,突变型PTEN+miR-155 组的相对荧光酶活性无显著变化(t=1.750,P>0.05,图8A)。miR-155可与PTEN相互作用。进一步的qRT-PCR 结果显示:与miR-NC组相比,miR-155 组PTEN mRNA 的相对表达量显著降低(t=7.87,P<0.05,图8B)。与circCTR-OE 组相比,circSLCO1B3-OE 组PTEN mRNA 的相对表达量显著增加(t=7.223,P<0.05,图8C);而与circSLCO1B3-OE 组相比,circSLCO1B3-OE+miR-155 组PTEN mRNA 的相对表达量则显著降低(t=6.667,P<0.05,图8C),相应的PTEN 蛋白质印迹分析结果如图8D 所示。以上结果表明,过表达circSLCO1B3 可以上调TNBC 细胞中的PTEN 表达水平,而过表达miR-155可以逆转circSLCO1B3对PTEN表达的促进作用。
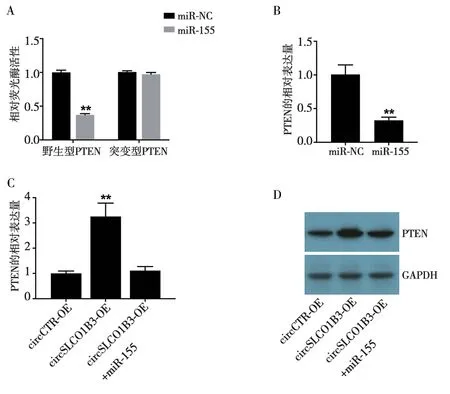
图8 circSLCO1B3通过miR-155/PTEN调控TNBC脑转移
3 讨论
乳腺癌是女性最常见的恶性肿瘤,也是女性最常见的肿瘤死亡原因之一,其发病率正不断上升。肿瘤远处转移是导致乳腺癌患者死亡的主要原因,其常见转移部位包括骨、肺、肝和脑,其中发生脑转移的患者预后最差(中位生存时间仅为4~6 个月)[8]。尽管诊疗水平的进步极大地改善了乳腺癌患者的预后,乳腺癌脑转移的发生率依然居高不下,其中以TNBC 患者的脑转移发生率最高(30%~50%)。TNBC侵袭性强,极易发生内脏转移,常发生在初次治疗后3~5 年内[9]。然而,由于缺乏有效的预后预测和治疗靶点,目前TNBC 脑转移缺乏有效的治疗手段。因此,研究TNBC 脑转移的分子机制和搜寻有效的治疗靶点有助于提高乳腺癌患者的生存情况。
近年来,随着对非编码RNA 生物学功能研究的不断深入,circRNA被发现在肿瘤发生发展过程中发挥着关键作用[10]。多个研究发现,circRNA可调控乳腺癌的发生发展。circFBXW7 可通过调控185-aa 蛋白抑制TNBC的生长与肺转移[11];下调circCNOT2的表达可以显著降低乳腺癌细胞的生存能力[12];circFECR1可通过调控DNA 甲基化和去甲基化酶从而促进乳腺癌的远处转移[13]。以上结果表明,circRNA 在乳腺癌的进展过程中起着关键作用,但circRNA 在TNBC 脑转移中的作用以及分子机制尚不明确。在本文中,我们通过检测circSLCO1B3 在乳腺癌细胞系中的表达,发现circSLCO1B3 在TNBC细胞系中显著下调。且相对于亲代TNBC 细胞系,子代脑转移细胞系中circSLCO1B3 下调更明显,说明circSLCO1B3 可能是TNBC 脑转移密切相关的一个circRNA。接下来,通过在脑转移性TNBC 细胞系中过表达circSLCO1B3,我们发现circSLCO1B3 可显著抑制TNBC细胞的侵袭及体内脑转移能力。
circRNA 是一类内源性非编码RNA,其结构呈闭合环状单链结构。研究表明,circRNA主要在细胞质内表达,多含有大量的miRNA 结合位点,可作为ceRNA,通过自身miRNA应答元件竞争结合miRNA,从而调控基因的表达水平[14-15]。通过吸附miRNA 进而解除miRNA 对其目的基因的转录抑制作用[16-17],circRNA 调控着肿瘤细胞的生长、凋亡以及侵袭、迁移等多种生物学行为[18]。例如,circRNA CDR1as可通过调控IGF2BP3从而抑制黑色素瘤的远处转移[19]。又如,circ0000799 通过吸附miR-31-5p,靶向上调RAB27A的表达,促进膀胱癌的进展[20]。通过亚细胞定位,我们确定了circSLCO1B3主要位于细胞质。随后通过生物信息学软件预测,我们发现circSLCO1B3存在miR-155 的结合位点,而PTEN 是miR-155 的预测下游靶基因。
既往文献表明,miR-155 在多种肿瘤中均显著表达上调,其高表达均提示肿瘤患者的不良预后[21]。在乳腺癌,miR-155 在肿瘤发生发展中起着关键作用,可促进肿瘤生长、血管生成和侵袭转移[22]。研究显示,miR-155 可通过抑制PTEN 的表达,激活PI3K/Akt 通路,从而促进肿瘤细胞增殖、侵袭和迁移[23]。PTEN 是一个重要的抑癌因子,它具有促进肿瘤细胞凋亡、参与细胞周期的调控以及抑制肿瘤转移的作用。在乳腺癌中,PTEN 的缺失可通过激活致癌信号通路PI3K/AKT 从而诱导乳腺癌的细胞增殖、凋亡抑制和肿瘤转移[24]。研究表明,miRNA 可通过诱导PTEN 的表达缺失促进乳腺癌的恶性进展。在乳腺癌脑转移灶中,研究者发现来自脑微环境中的星状细胞通过外泌体释放靶向PTEN的miRNA,引起PTEN 的表达缺失,从而增强细胞增殖和减少凋亡,促进脑转移瘤细胞的生长[25]。因此,miRNA 诱导的PTEN 的表达缺失是乳腺癌脑转移的特异性驱动因素,如何恢复脑转移灶中PTEN 的表达成为乳腺癌脑转移的研究关键。通过双荧光素酶报告基因、qRT-PCR 和Western blotting 实验,我们证实了circSLCO1B3 与miR-155、PTEN 与miR-155 之间的相互作用关系,即circSLCO1B3 可通过吸附miR-155,下调miR-155的表达,最终促进PTEN 的表达而抑制TNBC 脑转移的。circSLCO1B3/miR-155/PTEN轴在TNBC脑转移中发挥重要调控作用。
目前该机制的严谨性仍待完善,后续将纳入多株亲代及子代转移性TNBC 细胞系、临床脑转移样本,并进行RIP、qRT-PCR、小动物活体成像等实验进一步验证。本研究初步证实了circSLCO1B3 与TNBC 脑转移的密切关联,该过程可能是通过调控miR-155/PTEN 轴实现的,该研究可能为提高TNBC脑转移患者的预后提供新的思路和靶点。
利益冲突声明所有作者声明不存在利益冲突
作者贡献声明唐海林,赖洁兰:研究构思与设计;张颖,宋彩露,刘凌蕊:细胞及动物实验;张颖,宋彩露:结果分析与解释;张颖:起草原稿

