磁共振T2对比剂Fe3O4@Cys的制备及新西兰兔活体成像研究
祖涵瑜,陈梦莎,韩慧婷,闫鹏,陈亮,黄娅楠,张濬韬,姜兴岳*
0 前言
磁共振对比剂作为顺磁性或超顺磁性的物质,其与氢质子存在磁性相互作用,影响氢质子的弛豫率,使得不同组织和结构间的对比度增强[1]。磁共振对比剂主要分为两大类[2]:T1 对比剂缩短T1 弛豫时间,使信号强度增加,亮度变亮,为阳性对比剂,最常见的为钆类对比剂[3];T2 对比剂缩短T2 弛豫时间,信号强度变低,亮度变暗,故被称为阴性对比剂,最常见的为铁类对比剂[4]。钆类对比剂因其肾毒性限制了其在临床中的应用[5],此外,人脑中尤其是苍白球和齿状核的Gd3+沉积是钆剂的另一个显著不利影响[6];而铁是人体的必需元素,也是血红蛋白不可或缺的一部分,Fe3O4可被溶酶体降解,降解后可以被机体清除或进入体内正常代谢途径,基于氧化铁纳米颗粒的对比剂被认为更具生物安全性[7]。Fe3O4纳米颗粒作为一种阴性对比剂,由于具有强磁性和高磁化率、优异的表面化学性质及多样性的功能被越来越多的学者关注[8],已在磁共振分子成像、磁性引导药物输送、磁热治疗中显示出巨大的应用前景[9-10]。Fe3O4纳米颗粒通过偶联多种药物[11-12]或配合多种序列[13]广泛应用于多个系统[14-16]疾病的诊断、鉴别诊断和治疗[17-19]研究当中,尤其在分子影像领域中发挥着重要的作用,有广阔的医学应用前景[7]。目前Fe3O4纳米颗粒合成的主要化学方法有:共沉淀法、溶剂热法、微乳液法、热分解法和溶胶-凝胶法[20-22]。其中溶剂热法因制造成本低、反应条件安全简单、最终产物纯度高且具有良好的水分散性被越来越多的学者应用。未经表面修饰的Fe3O4纳米颗粒生物相容性较差,会对活体动物的正常组织或器官产生潜在的毒性[23]。目前主流用于修饰Fe3O4的修饰物为葡聚糖或聚乙二醇等聚合物[24-25],亦有学者将Fe3O4与其他无机物偶联[26-27]或与放射性元素偶联[28],还有学者将巨噬细胞作为铁载体[29]或者将细胞膜作为包覆物[30],较少有学者使用半胱氨酸(cysteine, Cys)进行Fe3O4的表面修饰[31]。Cys 属于人体内的氨基酸,本身具有良好的生物相容性和化学稳定性。另外,Cys 由于其巯基具有独特的亲核性、较低的氧化还原电势以及较低的自然丰度等特点,适合作为纳米颗粒的表面修饰材料,经Cys 修饰可以降低Fe3O4纳米颗粒的表面能,减小颗粒间的引力,从而制备出稳定性好、分散均匀的Fe3O4纳米颗粒[32]。目前,尚未发现有学者将Fe3O4@Cys作为T2对比剂用于磁共振活体成像。
本研究制备的Fe3O4@Cys 纳米颗粒,增加其生物相容性的同时,表现出优异的磁学性能,在活体内进行磁共振成像时有明显的对比增强效果,有望作为T2 对比剂应用于缺血性疾病例如小肠缺血的定性及定位的诊断研究。
1 材料与方法
1.1 试剂与仪器
FeCl3·6H2O(分析纯)、柠檬酸三钠(分析纯)、乙酸钠(分析纯)、乙二醇(分析纯)、Cys(分析纯)均购自于国药集团化学试剂有限公司。
恒温加热箱(精宏DHG-9146A)、真空干燥箱(乔跃DZF-6020)、X 射线粉末衍射仪(理学SmartLab 3KW)、扫描电子显微镜(日立S-4800)、ZETA电位纳米粒度分析仪(马尔文ZetasizerNano S90)、震动样品磁强计(量子LakeShore7404)、3.0 T 磁共振成像系统(西门子MAGNETOM SKyra)、8 通道小动物线圈(苏州众志医疗科技有限公司,3A81108C RB80)。
1.2 实验动物
健康的雌性新西兰大白兔5只(济南西岭角养殖繁育中心,普通级,NO.370822211100090357),4~6月龄,体质量(2.00±0.16)kg,由滨州医学院动物房提供,许可证号:syxk(鲁)20180022。清洁环境下分笼饲养。实验获得滨州医学院附属医院动物实验委员会批准,批准文号:20190812。
1.3 制备及表征
1.3.1 制备、洗涤及取样
制备:称量不同质量的FeCl·36H2O,一次称量0.2 g 柠檬酸三钠、1.2 g乙酸钠。分别量取20 mL乙二醇,置于3个烧杯中,将FeCl·36H2O加入到乙二醇溶液中,搅拌5 min,将柠檬酸三钠加入到乙二醇溶液中,磁力搅拌15 min,将乙酸钠加入到乙二醇溶液中,搅拌30 min,完成后将样品转移至高压反应釜中,并将高压反应釜放入恒温加热箱。调节恒温加热箱温度至200℃,分别加热4、6、8 h。
洗涤:取出高压反应釜,将样品分别转移至200 mL烧杯中,高压反应釜中残留样品用酒精冲洗并转移至烧杯中。向各个烧杯中加入酒精至120 mL,烧杯下方放置磁铁,烧杯口覆盖保鲜膜,静置沉淀,沉淀完成后将烧杯中余液倒出。向3 个烧杯中加入去离子水至120 mL,烧杯下放置磁铁,烧杯口覆盖保鲜膜,静置沉淀,沉淀完成后将烧杯中去离子水倒出,重复5次。
取样:向烧杯中加入少量的去离子水,放入超声波清洗机中分散均匀;用移液器将分散后的样品移至离心管中,将离心管放入高速离心机中离心;离心完成后,用移液器将离心管上层清液移出,保留下层沉淀。将离心管放入干燥箱中干燥6 h,得到干燥样品。
1.3.2 改变反应时间
在一次反应中,FeCl3·6H2O 的用量为0.325 g,加热时间分别为4、6、8 h。制得的样品采用X射线粉末衍射仪进行表征,分析反应时间对样品结晶性的影响。
1.3.3 改变底物浓度
选择结晶性最高的反应时间,调整FeCl3·6H2O 的用量分别为0.65、0.325、0.1625 g。制得的样品采用扫描电子显微镜(scanning electron microscope,SEM)进行表征,随机选取150个纳米颗粒纳入统计,分析底物浓度对样品形貌、粒径的影响。
1.3.4 表面修饰
选择结晶性较高,粒径分布较均匀的样品进行表面修饰。将干燥后的样品加入到10 mL去离子水中并放入超声波清洗机分散,分散后加入10 mL 浓度为0.121%的Cys溶液并加热搅拌10 h,制得Fe3O4@Cys。将部分修饰后的样品充分稀释,室温下经ZETA 电位分析仪测量修饰前后样品的ZETA电位。将部分修饰后的样品干燥,室温下经震动样品磁强计测量磁滞回线。
1.4 细胞增殖抑制实验
将4T1小鼠乳腺癌细胞接种于96孔板中,标准状态下培养24 h,更换新鲜培养液并加入相应浓度梯度的Fe3O4和Fe3O4@Cys,最终96 孔板的浓度梯度为0.025、0.05、0.1、0.2、0.4 mg/mL,37 ℃、5% CO2孵育24 h,在倒置显微镜下观察,吸除培养液,PBS 洗涤,加入新鲜无血清DMEM 培养基,每孔加入20 μL MTT溶液(5 g/mL),继续培养4 h。吸去培养液终止培养,每孔加入150 μL 二甲基亚砜(Dimethyl sulfoxide, DMSO),置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪OD 490 nm 处测量各孔的吸光值。
1.5 磁共振成像性能测试
将新西兰兔麻醉后,仰卧位放置于8通道兔专用线圈(苏州众志医疗科技有限公司3A81108C RB80),冠状位行T2 加权成像扫描。将对比剂(注射剂量为5.0 mg Fe/kg,即每千克新西兰兔体重注射纳米探针5.0 mg,以纳米颗粒中Fe质量计算)经新西兰兔耳缘静脉注射,扫描间隔为20 min,共扫描240 min。3 次测量肾皮质、肾髓质及小肠肠壁信号值并记录,取平均值。T2 加权成像扫描序列参数如下:TR 2000.0 ms,TE 83.0 ms,FOV 140 mm×123 mm,翻转角100°,体素尺寸0.7 mm×0.7 mm×3.0 mm,矩阵136×192,层厚3.0 mm。
1.6 统计学方法
采用R 语言进行数据统计和分析。不同浓度Fe3O4与Fe3O4@Cys 细胞存活率的比较采用独立样本t检验。比较注射对比剂前后不同时间点肾脏及小肠信号值的差异,判断正态性及方差齐性,若都符合,采用t检验,若其中之一不符合,则采用Kruskal-Wallis 秩和检验。P<0.05 被认为差异具有统计学意义。
2 结果
2.1 反应时间对产物结晶性的影响
X 射线衍射仪(X-ray powder diffractometer,XRD)显示(图1):图谱出现了明显的衍射峰,且衍射峰为Fe3O4的特征峰,表明反应时间为4、6、8 h 时制备得到的物质均为Fe3O4,证实改变上述的反应时间对产物性质无明显改变,样品结晶性随反应时间的延长而增加。表明,反应时间不影响产物性质,并与结晶性正相关。
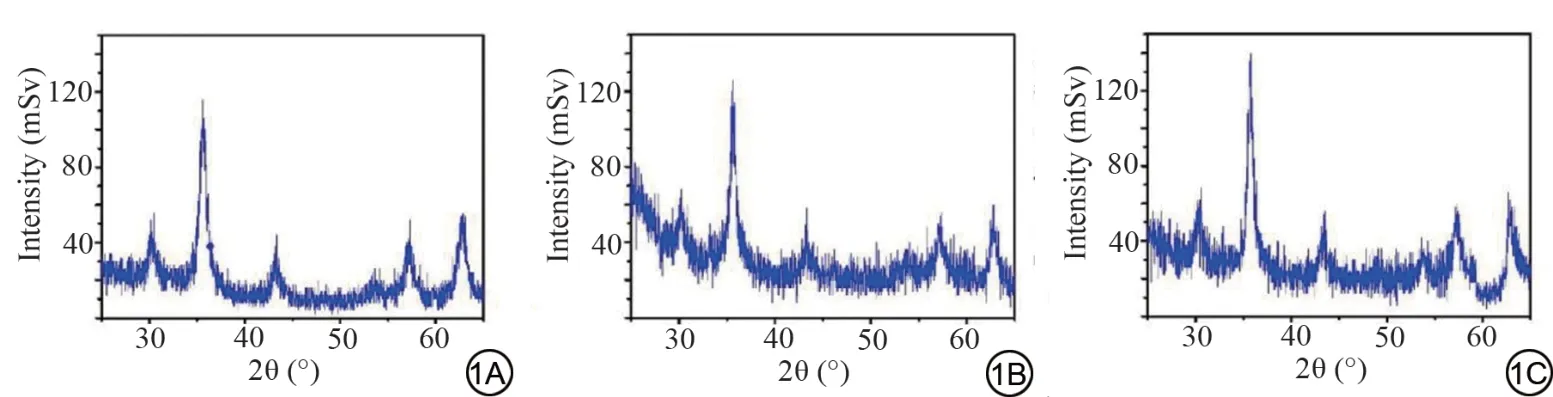
图1 不同反应时间的产物性质及结晶性。图1A~1C 分别为反应时间4、6、8 h 时产物的X 射线衍射图谱。(1 mSv=10-3 J/kg)。Fig.1 Product properties and crystallization properties at different reaction times.1A-1C show the X-ray diffraction (X-ray powder diffractometer,XRD) map of the products at 4 h, 6 h and 8 h, respectively.(1 mSv=10-3 J/kg).
2.2 底物浓度对粒径的影响
扫描电镜(scanning electron microscope, SEM)显示(图2):当FeCl3·6H2O的用量为0.650 g时制备的平均粒径约为116.0 nm,相邻Fe3O4纳米颗粒通过磁性作用相互吸引使得样品出现团聚;当FeCl3·6H2O的用量为0.325、0.1625 g 时制备得到的Fe3O4纳米颗粒表面较光滑、分散较均匀且呈球形,平均粒径分别为57.2、57.0 nm。可以看出样品的平均粒径随着FeCl3·6H2O 的浓度降低而减小。样品经Cys 修饰后,粒径大小、形貌均未发生明显改变。

图2 FeCl3·6H2O 用量0.650 g(2A)、0.325 g(2B)、0.1625 g(2C)时产物的扫描电镜图像及反应时间8 h、FeCl3·6H2O 用量0.325 g 时产物经半胱氨酸修饰后样品的扫描电镜图像(2D)。Fig.2 The scanning electron microscope (SEM) images of the product at FeCl3·6H2O dosage 0.650 g (2A), 0.325 g (2B) and 0.1625 g (2C), respectively, and the SEM images of the product after cysteine modification at the reaction time 8 h and FeCl3·6H2O dosage 0.325 g (2D).
2.3 Fe3O4@Cys具有超顺磁性
震动样品磁强计显示(图3):磁滞回线呈对称的“S”形,不存在滞后现象。制备的纳米颗粒饱和磁化强度约为73 emu/g(1 emu/g=1 Am2/kg)。剩余磁化强度和矫顽力均趋近于零。表明样品非铁磁性、具有良好的超顺磁性。
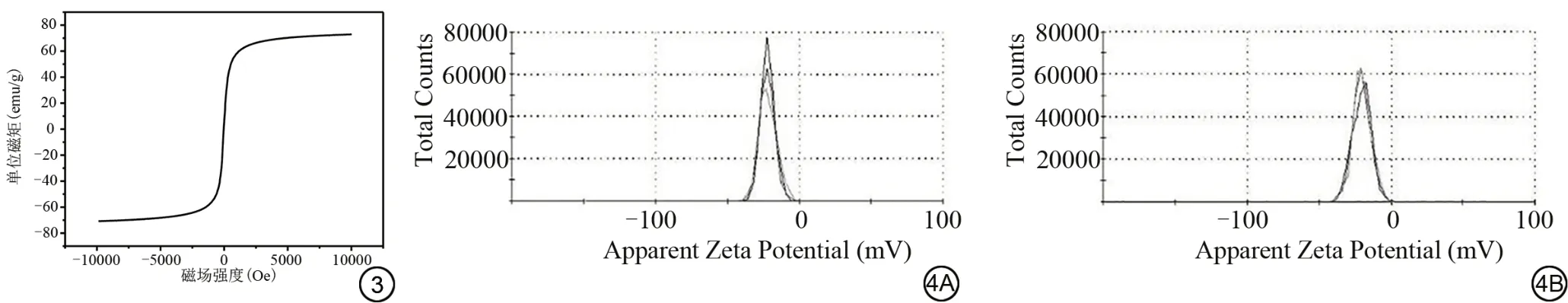
图3 当反应时间为8 h、FeCl3·6H2O 用量为0.325 g 时样品的磁滞回线。(1 Oe≈79.6 A/m;1 emu/g=1 Am2/kg)。图4 Fe3O4纳米颗粒(4A)与Fe3O4@Cys(4B)的表面电位。Fig.3 The hysteresis loop of the samples when the reaction time is 8 h and the FeCl3·6H2O dosage is 0.325 g.(1 Oe≈79.6 A/m; 1 emu/g=1 Am2/kg).Fig.4 The surface potential of the Fe3O4 nanoparticles (4A) and Fe3O4@Cys (4B).
2.4 Cys修饰使纳米颗粒稳定性增加
ZETA 电位纳米粒度分析仪显示(图4):Fe3O4、Fe3O4@Cys 表面均带有负电荷,在水相中的电位分别约为-20、-22 mV。
2.5 Cys修饰降低纳米颗粒的细胞毒性
不同浓度的纳米颗粒与4T1 细胞共培养24 h后,经MTT实验测得细胞存活率(图5):Fe3O4@Cys组的细胞存活率始终高于Fe3O4组,当浓度达到0.4 mg/mL时细胞存活率仍保持在80%以上。
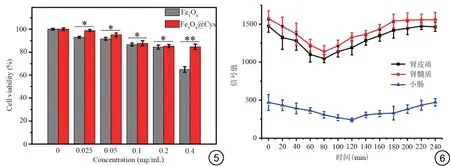
图5 不同浓度Fe3O4与Fe3O4@Cys 的细胞存活率。*:P<0.05;**:P<0.01。图6 新西兰兔耳缘静脉注射Fe3O4@Cys 后,T2 加权成像信号值-时间变化曲线。Fig.5 Cell viability of different concentrations of Fe3O4 versus Fe3O4@Cys.*: P<0.05; **: P<0.01.Fig.6 T2-weighted imaging signal value-time change curve after intravenous Fe3O4@Cys in New Zealand rabbits.
2.6 Fe3O4@Cys 在新西兰兔活体成像中的信号值-时间变化曲线
磁共振T2 加权成像信号值-时间变化曲线显示(图6):注射Fe3O4@Cys后,肾脏皮质、髓质及小肠肠壁信号值先降低后逐渐升高,其中肾皮质与肾髓质在注射对比剂后80 min时信号值最低,小肠在注射对比剂后120 min 信号值最低。通过Kruskal-Wallis 秩和检验比较注射前与注射后不同时间节点的信号值,其中肾皮质、髓质信号值均于注射后20~160 min内显著低于注射前水平(P<0.05,P=1.29×10-8),小肠肠壁信号值于注射后40~200 min 内显著低于注射前水平(P<0.05,P=1.29×10-8)(图7)。

图7 不同时间点肾脏及小肠T2 加权像。弧线为肾皮质区,扇形为肾髓质区,直线为小肠壁。Fig.7 T2-weighted images of the kidney and the small intestine at different time points.Arc is renal cortical area, fan shape of renal medullary area, straight line is small bowel wall.
3 讨论
本研究采用溶剂热法,通过改变反应时间、底物浓度,制备了不同结晶性、不同粒径的Fe3O4纳米颗粒。本研究首次将Fe3O4@Cys 纳米颗粒应用于磁共振成像,研究证实修饰后产物的稳定性及生物相容性增加。
3.1 反应时间对Fe3O4纳米颗粒结晶性的影响
本研究表明,反应时间延长,Fe3O4纳米颗粒结晶性随之增加,这与以往研究[33]报道的规律相一致。这是由于当反应体系中底物浓度和反应温度一定时,当反应时间更加充足,产物反应亦更加充分,导致Fe3O4纳米颗粒结晶性增加[34]。晶体的生长在高压釜内进行,高压釜上部为结晶区,悬挂籽晶;下部为溶解区,放置培养晶体的原料,釜内填装溶剂介质。反应过程中由于结晶区与溶解区之间存在温度差而产生对流,将高温的饱和溶液带至低温的结晶区形成过饱和析出溶质使籽晶生长。温度降低并已析出了部分溶质的溶液又流向下部,溶解培养料,如此循环往复,使籽晶持续生长结晶。相关研究[35]表明,延长反应时间,由于奥氏熟化,小粒子溶解消失,颗粒逐渐长大;相反,反应时间不足会导致产物不纯或反应不完全,结晶性降低。
3.2 底物浓度及Cys 修饰对Fe3O4 纳米颗粒粒径的影响
本研究结果表明,当FeCl3·6H2O 的浓度降低,产物平均粒径随之减小;当FeCl3·6H2O 浓度过高,会导致Fe3O4纳米颗粒团聚而粒径增大;当FeCl3·6H2O 浓度过低,粒径分布带将增宽。这是由于液相环境中铁离子浓度太高时,大部分Fe3+和Fe2+未能被表面活性剂形成的水膜包覆,而是以离子的形式自由存在,因此形成的Fe3O4纳米颗粒粒径较大[36]。当铁离子浓度较低时,由于羧基与Fe3+具有很强的配位作用,Fe3O4纳米颗粒表面的负电荷增多,静电斥力和表面张力的共同作用抑制Fe3O4晶体进一步长大,使Fe3O4纳米颗粒粒径减小。当FeCl·36H2O 的用量为0.1625 g时,粒径大小分布不均匀。这是由于反应体系中底物浓度太低时,过量的表面活性剂会造成部分纳米颗粒相互黏结,从而引起粒径分布较广,粒径均匀性难以控制。本研究发现,电镜下Fe3O4经Cys修饰后,粒径大小、形貌均未发生明显改变,这与以往的研究[37]的发现相一致,这是因为Cys在电镜下不可见。
3.3 Fe3O4@Cys纳米颗粒的磁学性能
本研究证明Fe3O4@Cys具有超顺磁性。有研究[38]表明当磁性材料的饱和磁化强度大于16.3 emu/g时(1 emu/g=1 Am2/kg),在外加磁场作用下便可从溶液中分离,而本研究制备的Fe3O4@Cys 饱和磁化强度约为73 emu/g,提示其具有磁性引导药物输送的潜能[21]。
3.4 Cys修饰对稳定性的影响
本研究发现,修饰前后Fe3O4纳米颗粒表面均带有负电荷,均能够稳定分散于水相,研究[37]证明ZETA电位的数值与胶态分散的稳定性有关。ZETA 电位是对颗粒间相互排斥或吸引力的强度的度量。ZETA 电位绝对值越高,体系越稳定,即溶解或分散可以抵抗聚集;相反,绝对值越低,体系越倾向于凝结或凝聚。相关基础研究表[37]明经Cys修饰后的Fe3O4胶体粒子分散于去离子水中时,通过电离作用使得表面产生更多负电荷,表面带有负电荷的Fe3O4胶体粒子之间便产生静电排斥力,使其可以稳定分散于水相中。
3.5 Cys修饰对生物相容性的影响
本研究发现Fe3O4@Cys 组的细胞存活率始终高于Fe3O4组,当浓度达到0.4 mg/mL 时细胞存活率仍保持在80%以上,表示其细胞毒性较小,证明Cys 修饰可以降低Fe3O4纳米颗粒的细胞毒性,增加生物相容性。相关基础研究[37]表明Cys 自然存在于人体内,是细胞代谢所需要的物质,其本身具备良好的生物相容性和化学稳定性;故经Cys 表面修饰,将Fe3O4纳米颗粒包覆,亦可降低纳米颗粒的细胞毒性及增加其生物相容性。
3.6 磁共振T2 对比剂Fe3O4@Cys 在新西兰兔活体成像中的应用
本研究发现静脉注射Fe3O4@Cys 后的肾脏皮质、髓质及小肠肠壁信号值随时间变化先降低后逐渐升高。这是由于Fe3O4@Cys 进入血液后与血浆蛋白结合,并在调理素的作用下被内皮网状系统识别并摄取,Fe3O4@Cys 被巨噬细胞吞噬后,相应区域的磁共振信号强度降低,当Fe3O4@Cys被溶酶体降解并代谢,该区域的磁共振信号强度逐渐恢复[39],肾脏皮质与髓质信号值随时间变化下降及上升规律大致相近,但与小肠的信号值变化规律相差较大,我们认为主要是由于肾脏与小肠的巨噬细胞分布的数量差别导致信号值下降、恢复时间及变化幅度的差异[40]。本研究发现肾皮质、髓质信号值均于注射后20~160 min 内显著低于注射前水平,小肠肠壁信号值于注射后40~200 min内显著低于注射前水平,这在以往文献中未曾报道,提示肾脏扫描的时间窗为注射对比剂后20~160 min,小肠扫描的时间窗为注射对比剂后40~200 min内。
3.7 本研究的局限性
本研究尚有不足:(1)由于新西兰兔小肠管壁较薄,且受呼吸及肠蠕动等影响,对ROI 勾画会产生一定的影响;(2)本研究中新西兰兔活体成像时各时间点的样本量较少,结果存在一定的误差,有待扩大样本量进行研究。
4 结论
综上所述,本研究制备的磁共振T2 对比剂Fe3O4@Cys 具有良好的稳定性和生物相容性,且磁学性能优异,在活体成像中表现出明显的阴性对比增强效果。当组织缺血时细胞缺氧水肿,在T2 加权像中缺血部位表现为高信号,而正常血供的组织因对比剂的存在表现为低信号,从而增加缺血组织与正常组织之间的对比度,有望作为T2 对比剂应用于缺血性疾病例如小肠缺血的定性及定位的诊断研究。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:姜兴岳参与选题和设计,对稿件重要内容进行了修改,并获得山东省自然科学基金项目的资助;祖涵瑜负责主要的对比剂合成及表征工作,起草和撰写稿件;陈梦莎在磁共振扫描序列参数的调整、完善方面做出重要贡献,对稿件重要内容进行修改;韩慧婷负责实验动物的饲养及动物麻醉,对稿件重要内容进行了修改;闫鹏分析对比剂的表征工作,对稿件重要内容进行了修改,获得国家自然科学基金项目资助;陈亮参与磁共振图像内容的分析与解释,对稿件重要内容进行修改;黄娅楠负责磁共振扫描工作,对稿件重要内容进行了修改;张濬韬在磁共振数据分析方面进行了关键的指导及修改。全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

