基于临床、病理、DWI 定量参数构建列线图预测宫颈癌程序性死亡受体配体1阳性表达:不同ROI选择的比较
刘开惠,杨蔚,田海萍,张治宁,李云霞,何剑莉
0 前言
宫颈癌是发展中国家最常见的女性恶性肿瘤之一[1]。尽管大多数患者同步放化疗后预后良好,但仍有患者出现复发或转移[2-3]。以程序性死亡受体1(programmed death 1, PD-1)及 其 配 体(PD-1 ligand, PD-L1)为靶点的免疫疗法在宫颈癌、非小细胞肺癌等恶性肿瘤治疗中备受关注[4-6],其疗效与PD-L1表达状态相关[7]。目前,PD-L1表达状态主要经免疫组化明确,其为有创性检查,且采用的是肿瘤的局部组织,不能反映肿瘤的整体特征。MR 扩散加权成像(diffusion weighted imaging, DWI)的表观扩散系数(apparent diffusion coefficient, ADC)在宫颈癌分期、分级及与免疫标志物相关性的研究中均表现出良好的应用价值[8-10]。但不同感兴趣区(region of interest, ROI)的选择可能影响组织中ADC 值。目前,研究多集中于临床或病理特征与宫颈癌PD-L1阳性表达的相关,尚缺乏影像特征与之相关的研究报道[11-12]。因此,本研究旨在探究DWI不同ROI选择提取的ADC值与宫颈癌PD-L1表达的相关性,并将其联合临床、病理相关参数建立列线图预测宫颈癌PD-L1阳性表达的价值,为患者免疫治疗提供依据。
1 材料与方法
1.1 研究对象
本研究遵守《赫尔辛基宣言》,经宁夏医科大学总医院科研伦理委员会批准,批准文号:2018-062,对于回顾性的研究,免除受试者知情同意;对于前瞻性的研究,所有受试者均签署知情同意书。收集2018年1月至2022年12月在我院就诊的高度怀疑为宫颈癌的初诊患者资料。其中,回顾性分析的2018年1月至2020年7月就诊的患者病例为训练组,前瞻性招募2020年8月至2022年12月就诊的患者为验证组。两组的纳入标准:(1)经病理证实为宫颈癌的首诊患者;(2)在GE Signa Excite HD 3.0 T MR 仪上行盆腔MRI检查,且盆腔MRI与之后的病理检查之间的时间间隔不超过2周。两组的排除标准:(1)MR图像不清晰、病理资料不完整;(2)既往有治疗干预史。
1.2 仪器设备
所有受检者均在GE Signa Excite HD 3.0 T MR 仪上行盆腔MRI 扫描。所有患者检查前禁食至少6 h,保持膀胱半充盈。扫描序列及参数:轴位T1WI,重复时间(repetition time, TR)500 ms,回波时间(echo time, TE)8.5 ms,视野(field of view, FOV)240 mm×320 mm,层厚5 mm;轴位T2WI,TR 4200 ms,TE 95 ms,FOV 240 mm×360 mm,层厚5 mm;轴位DWI扫描采用单次激发平面回波成像序列,TR 4600 ms,TE 66 ms,FOV 320 mm×192 mm,层厚5 mm,b 值取0 和1000 s/mm2;增强扫描,TR 160 ms,TE 1.4 ms,FOV 240 mm×240 mm,层厚5 mm;经肘静脉用高压注射器以2.0 mL/s 的流率注射对比剂钆喷酸葡胺注射液(Gd-DTPA,马根维显,拜耳医药保健股份有限公司),剂量0.2 mmol/kg,最后以15 mL 生理盐水用相同流率冲洗管腔。
1.3 图像分析
将原始数据导入GE ADW 4.4 工作站,由2 名分别有22 年和3 年妇科肿瘤影像诊断经验的主任医师和住院医师在双盲条件下进行阅片,测量病灶大小及不同ROI 的ADC 值,针对穿刺活检患者需评估病灶浸润深度、是否有宫旁浸润及淋巴结转移情况。若两者的测量、评估结果一致性良好,则以住院医师的测量结果进行后续分析。参考T2WI 及增强扫描图像,在DWI图像上选择包含肿瘤实体成分的所有连续层面,沿肿瘤边缘手动勾画ROI,并从对应的ADC伪彩图上获得各个层面的ADC 值,将所有层面的ADC 值平均,即为肿瘤平均ADC(mean ADC, ADCmean)(图1A);在DWI 图像上选择包含肿瘤实体成分的最大层面,沿肿瘤边缘手动勾画ROI,获得该层面ADC值,即为肿瘤单层面ADC(single section ADC, ADCss)(图1B);在包含肿瘤实体成分的每一个层面上手动放置若干个圆形或类圆形30~50 mm2的ROI,每个肿瘤约放置15~30个ROI,选取一个ROI对应的最小ADC值,即为肿瘤最小ADC(minimum ADC, ADCmin)[13](图1C)。在选取ROI 时,尽量避开出血、坏死及囊变区域。针对穿刺活检患者,以T2WI、DWI 及增强扫描图像为参考评估病灶浸润深度、宫旁浸润,以淋巴结短径>1 cm 作阳性[14]。
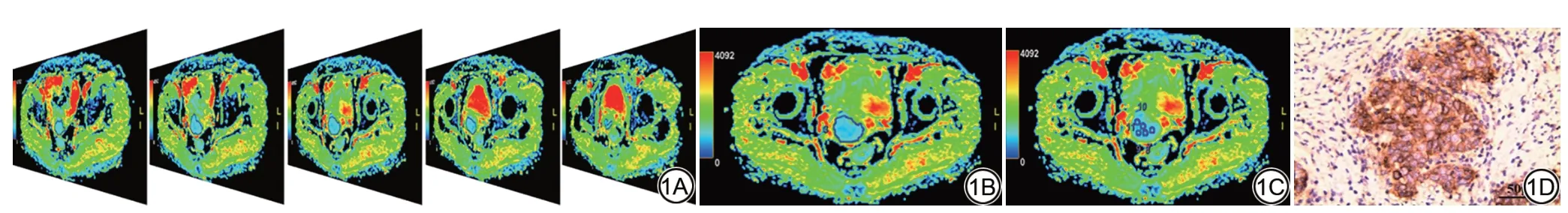
图1 感兴趣区(ROI)勾画示意图及免疫组化染色图。1A:在包含肿瘤实体成分的所有连续层面绘制ROI,并计算这些层面的表观扩散系数(ADC)值的平均值得到肿瘤平均ADC(ADCmean);1B:在肿瘤实体成分最大的层面绘制ROI,记录得到的ADC 值为肿瘤单层面ADC(ADCss);1C:测量ADCmin的ROI 放置方法;1D:免疫组化染色下的PD-L1强阳性表达(×400倍),肿瘤细胞核染色为棕色。Fig.1 Sketch map of region of interest (ROI) and immunohistochemical staining map.1A: Draw ROI along all consecutive slices containing tumor solid components on the apparent diffusion coefficient (ADC) pseudo-color map and calculate the average ADC values of all selected slices to determine mean ADC(ADCmean); 1B: Define ROI along the slice with the maximum extent of tumor solid components, and record the obtained ADC value as single section ADC (ADCss);1C: Illustration of the ROI placement method for measuring minimum ADC (ADCmin); 1D: Strongly positive PD-L1 expression (×400) depicted by immunohistochemical staining, tumor cell nuclei are stained brown.
1.4 免疫组织化学染色
采用免疫组化法检测宫颈癌组织中PD-L1 表达水平,对于穿刺活检的患者,通过多点取材以保证免疫组化检测有充足的标本。以PD-L1 鼠抗人单克隆抗体标识PD-L1。以阳性细胞比率与染色强度乘积为评分标准[15],最终得分≥2 分视为阳性,否则为阴性(图1D)。S-100 染色阳性提示病灶嗜神经侵犯,CD34 和(或)D2-40 染色阳性提示存在淋巴脉管侵犯(lymphovascular invasion, LVI)。
1.5 统计学分析
采用SPSS 26.0(IBM Corp., Armonk, NY, USA)、R 4.2.2(R Development Core Team, Vienna, Austria)软件进行统计分析。用组内相关系数(intraclass correlation coefficient, ICC)评估两名医师对病灶大小、ADCmean、ADCss、ADCmin测量结果的一致性;用Cohen's Kappa 系数(κ)评估两名医师对病灶浸润深度、宫旁浸润、淋巴结转移评估结果的一致性,ICC、κ>0.8 被认为一致性极好。对于符合正态分布的定量资料以均数±标准差(xˉ±s)表示,组间比较采用独立样本t检验;分类资料用频数(百分数)表示,组间比较采用χ2检验。在训练组中,首先进行单因素logistic 回归分析,将差异有统计学意义的参数纳入多因素logistic 逐步回归分析,行共线性诊断及相关性分析;若参数的方差膨胀系数(variance inflation factor, VIF)>10,则予以排除;若变量间具有较强的相关性,则进一步比较诊断效能,选择最优变量,最终确定宫颈癌PD-L1阳性表达的独立相关因素,分别建立临床病理模型及联合模型,绘制受试者工作特征(receiver operating characteristic,ROC)曲线评估不同模型及各独立相关因素的诊断效能,并采用DeLong 检验评估诊断效能的差异。随后绘制模型列线图及校准曲线,采用Hosmer-Lemeshow检验评估列线图预测情况与实际情况的一致性;决策曲线评价模型的临床获益度;PD-L1 表达与不同ADC 值及PD-1 表达间的相关性采用Spearman 相关系数分析;不同ADC 值间的相关性采用Pearson 相关系数分析。以P<0.05为差异有统计学意义。
2 结果
本研究排除了79 例因盆腔MRI 图像质量差无法应用及67 例既往有放化疗干预史患者,最终纳入1015例宫颈癌患者,年龄27~91(53±11)岁;其中训练组683 例,366 例患者为手术病理,317 例为穿刺活检病理,PD-L1 阳性表达375 例(54.9%);验证组332 例,207 例 手 术 病 理,125 例 穿 刺 活 检 病 理,PD-L1阳性表达190例(57.2%)。
2.1 训练与验证组间基线资料比较
观察者间测量ADCmean[ICC=0.983 (95%CI:0.980-0.985)]、ADCss[ICC=0.987 (95%CI: 0.984-0.988)]、ADCmin[ICC=0.991 (95%CI: 0.990-0.992)]、病灶大小[ICC=0.991 (95%CI: 0.989-0.993)]、病灶浸润深度[κ=0.844 (95%CI: 0.802-0.885)]、宫旁浸润[κ=0.846 (95%CI: 0.807-0.885)]、淋 巴 结 转 移[κ=0.876 (95%CI: 0.838-0.913)]的一致性均极好。
两组间PD-L1阳性表达比例、年龄、绝经状态、病灶大小、吸烟史、分娩次数、HPV感染、FIGO分期、组织学类型、病理分级、病灶浸润深度、宫旁浸润、LVI、嗜神经侵犯、淋巴结转移、Ki-67指数、ADCmean、ADCss、ADCmin差异均无统计学意义(P均>0.05),详细见表1。
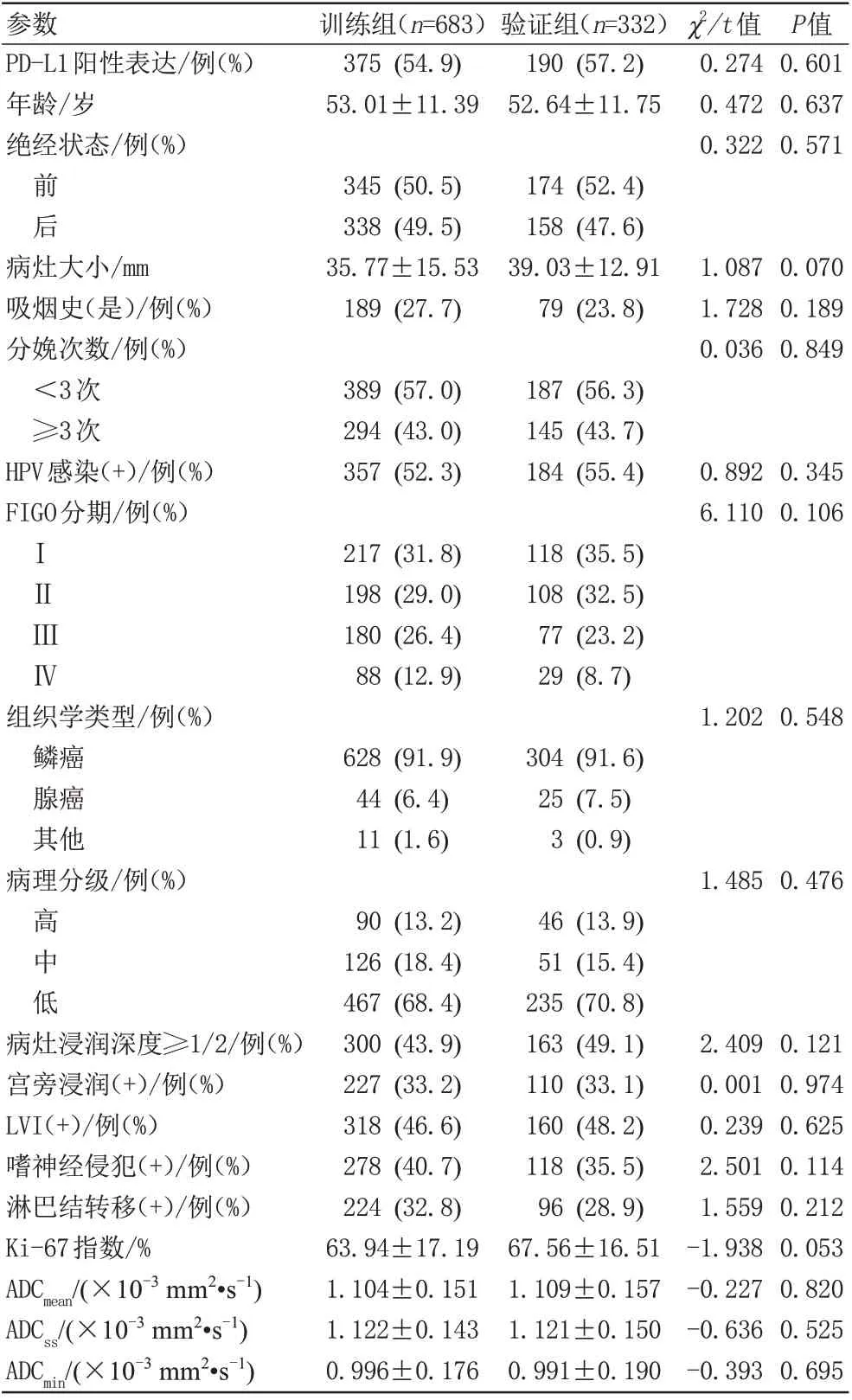
表1 训练组与验证组基线资料比较Tab.1 Comparison of data between the training cohort and the validation cohort
2.2 训练组中PD-L1阳性表达组与阴性表达组临床、病理及影像参数比较
两组间绝经状态、吸烟史、分娩次数、HPV 感染、嗜神经侵犯、Ki-67指数差异均无统计学意义(P均>0.05);年龄、病灶大小、FIGO 分期、组织学类型、病理分级、病灶浸润深度、宫旁浸润、LVI、淋巴结转移、ADCmean、ADCss、ADCmin差 异 均 有 统 计 学 意 义(P均<0.05),详细见表2。
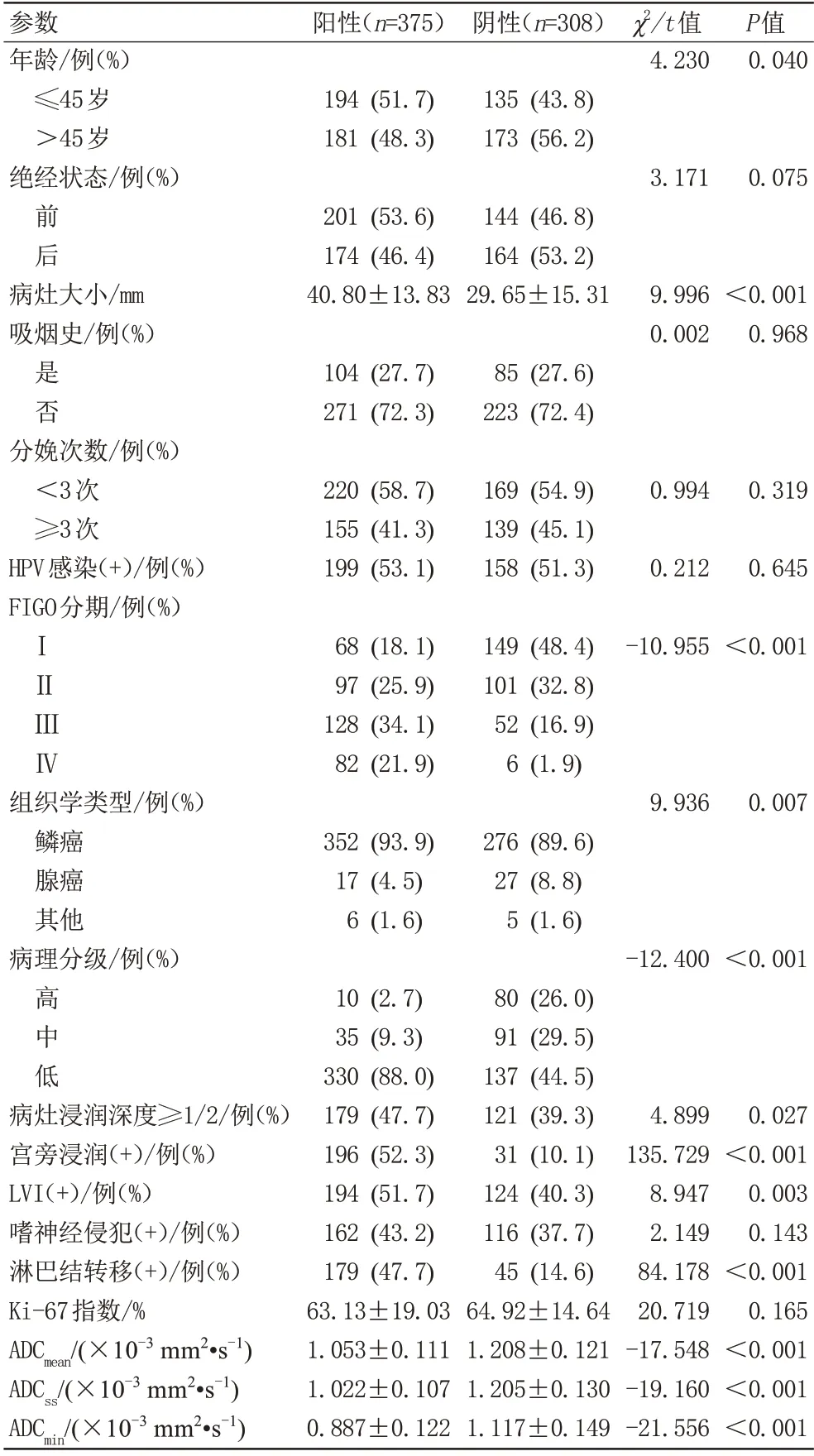
表2 训练组中PD-L1阳性表达组与阴性表达组临床、病理及影像参数比较Tab.2 Comparison of clinical, pathological, and imaging parameters between the PD-L1 positive and negative expression groups in the training cohort
二元logistic 回归分析显示FIGO 分期、病理分级、宫旁浸润、淋巴结转移、ADCmean、ADCss、ADCmin为PD-L1 表达的独立相关因素(表3)。其中,ADCmean、ADCss、ADCmin预测宫颈癌组织PD-L1表达的ROC曲线下面积(area under the curve, AUC)分别为0.830(95%CI: 0.800-0.857)、0.853(95%CI: 0.824-0.879)、0.882(95%CI: 0.855-0.905)。DeLong 检验显示,三种ADC 值的诊断效能差异存在统计学意义,ADCmin诊断效能最高(Z=2.455-4.852,P<0.05),因此,将ADCmin纳入后续建模分析。

表3 单、多因素logistic回归分析宫颈癌组织中PD-L1阳性表达的相关因素Tab.3 Univariable and multivariable logistic regression analyses for correlation factors of PD-L1 positive expression in cervical cancer
2.3 联合模型的建立及诊断效能
基于上述独立相关因素,分别构建包含FIGO 分期、病理分级、宫旁浸润、淋巴结转移的临床病理模型及包含FIGO分期、病理分级、宫旁浸润、淋巴结转移及ADCmin的联合模型。通过ROC曲线分析,联合模型的诊断效能最高,AUC 为0.906(95%CI: 0.882-0.927),高于临床病理模型及各独立预后因素(Z=3.645-14.210,P均<0.05),详见表4及图2。
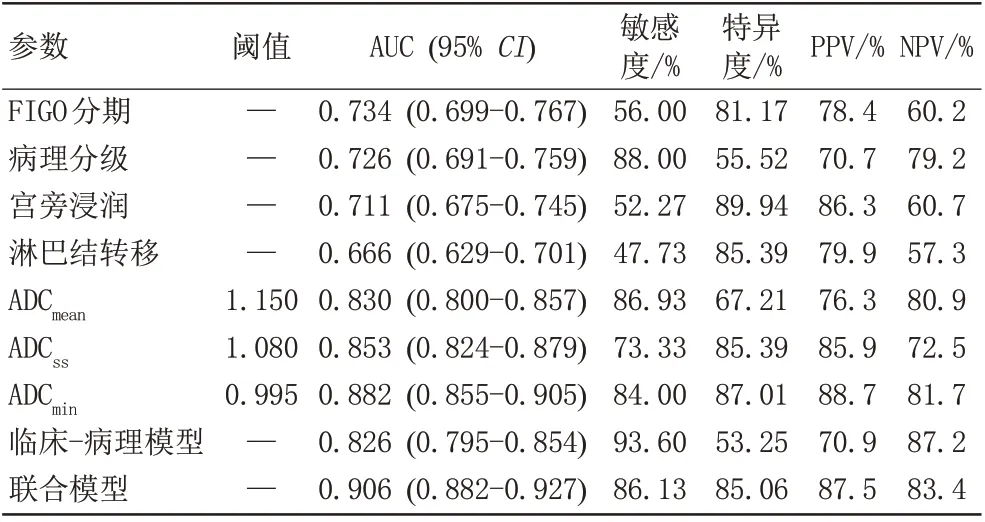
表4 ROC曲线分析各独立相关因素及模型预测PD-L1阳性表达的诊断效能Tab.4 Diagnostic performance of ROC curve analysis on independent related factors and models for predicting PD-L1 positive expression
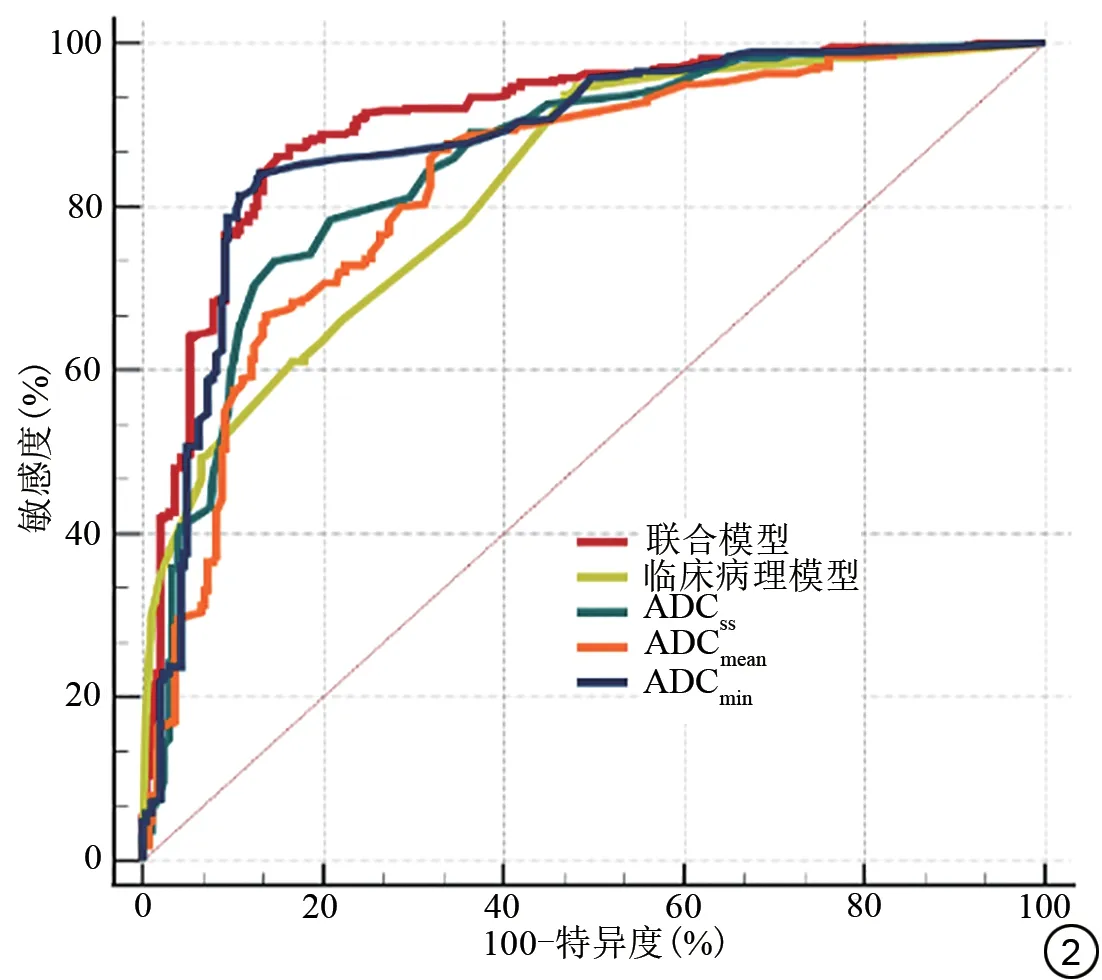
图2 受试者工作特征曲线。ADCss:单层面ADC;ADCmean:平均ADC;ADCmin:最小ADC;ADC:表观扩散系数。Fig.2 The receiver operating characteristic curves.ADCss: single section ADC; ADCmean: mean ADC; ADCmin: minimum ADC; ADC: apparent diffusion coefficient.
2.4 列线图的构建及验证
通过R软件构建联合模型的列线图及校准曲线。Hosmer-Lemeshow 检验中,P>0.05 提示列线图在训练组及验证组中均拟合度良好,即实际情况与预测结果一致性良好(图3)。列线图在验证组中也表现出良好的诊断效能,AUC 为0.903(95%CI: 0.866-0.933)(图4)。决策曲线分析显示,在所有阈值概率下,列线图在训练组与验证组中的人群临床净收益均较高(图5)。列线图预测PD-L1 阳性表达的案例如图6所示。
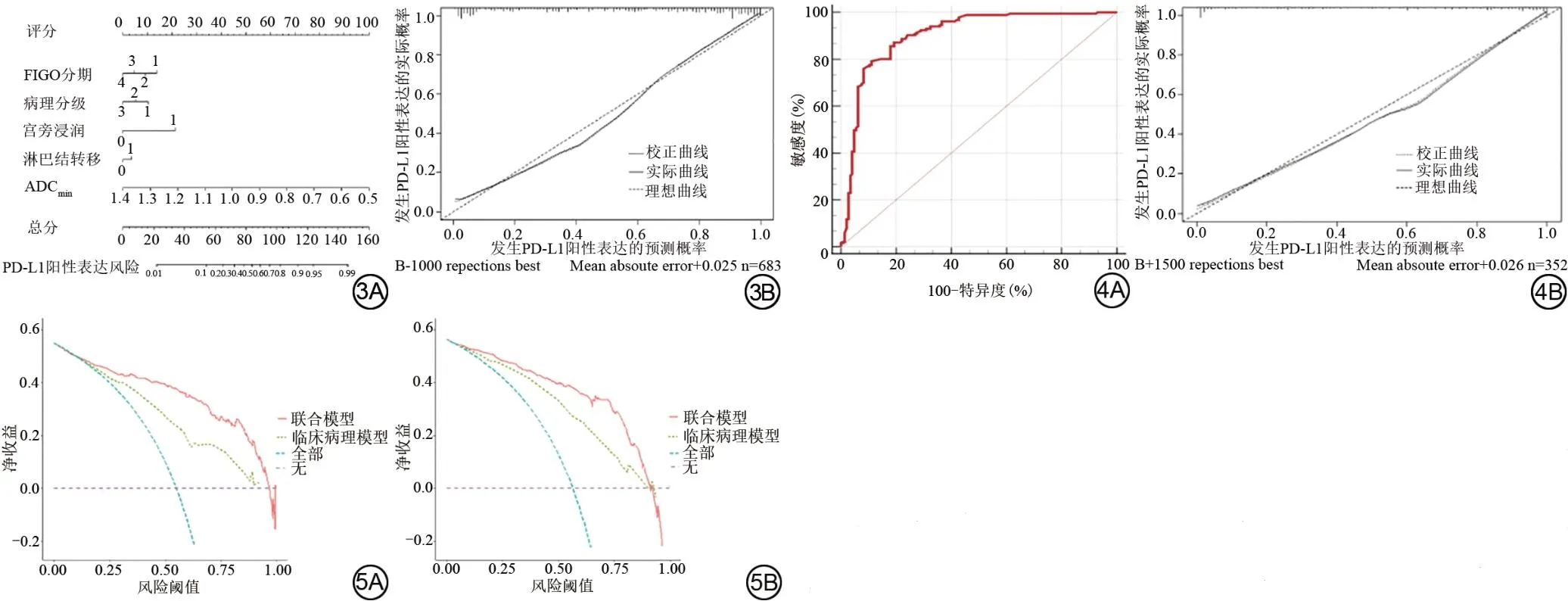
图3 训练组基于联合模型构建的列线图(3A)及校准曲线(3B)。图4 验证组中联合模型的受试者工作特征曲线(4A)及校准曲线(4B)。图5 训练组(5A)与验证组(5B)中临床病理模型与联合模型的决策曲线。FIGO:国际妇产科学联盟;ADCmin:肿瘤最小ADC;ADC:表观扩散系数;PD-L1:程序性死亡受体配体1。Fig.3 A nomogram based on the combined model of the training cohort (3A)and calibration curve (3B).Fig.4 The receiver operating characteristic curve(4A) and calibration curve (4B) of the combination model in the validation cohort.Fig.5 The decision curves of the combined model in the training (5A)and validation cohort (5B).FIGO: International Federation of Gynecology and Obstetrics; ADCmin: minimum ADC; ADC: apparent diffusion coefficient; PD-L1:programmed death-ligand 1.
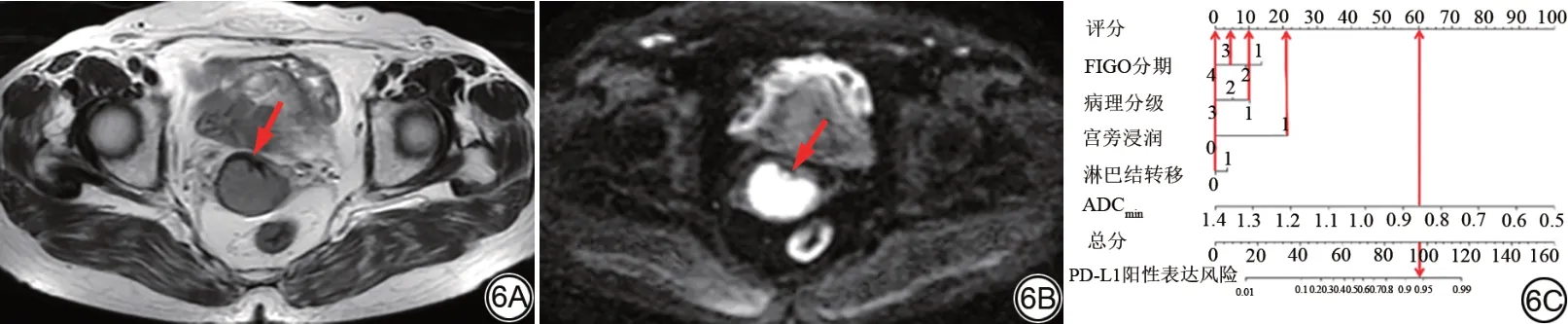
图6 女,51 岁,宫颈低分化鳞癌(PD-L1阳性表达)患者。6A:T2WI示肿块为不规则的等高信号(箭);6B:DWI(b 值为1000 s/mm2)示肿块为明显高信号(箭);6C:列线图示FIGO 分期Ⅲ期(4.9 分),病理分级为低分化(10 分),宫旁浸润阳性(21.25分),淋巴结转移阴性(0 分),ADCmin值为0.86×10-3 mm2/s(60 分),共96.15 分,对应PD-L1 阳性表达风险约为94%,预测情况与实际一致。DWI:扩散加权成像;FIGO:国际妇产科学联盟;ADCmin:肿瘤最小ADC;ADC:表观扩散系数;PD-L1为程序性死亡受体配体1。Fig.6 Female, 51-year-old, patient with poorly differentiated squamous cell carcinoma of the cervix (PD-L1 positive expression).6A: T2WI reveals an irregular mass in the cervix with iso- and hyper-intensity (arrow); 6B: Diffusion-weighted imaging (DWI; b=1000 s/mm2) exhibits a notably hyper-intense region (arrow); 6C:The nomogram displays that in this case, FIGO staging Ⅲ (score 4.9), poor pathological grade (score 10), positive parametrial invasion (score 21.25), negative lymph node status (score 0), ADCmin=0.86×10-3 mm2/s (score 60), resulting in a total score of 96.15 after summing all corresponding points.This corresponds to a risk of PD-L1 positive expression of about 94%, aligning well with the predicted outcome.DWI: diffusion weighted imaging; FIGO: International Federation of Gynecology and Obstetrics; ADCmin: minimum ADC; ADC: apparent diffusion coefficient; PD-L1: programmed death-ligand 1.
2.5 相关性分析
宫颈癌组织中PD-L1 表达与ADCmean、ADCss、ADCmin均呈负相关[r=-0.566 (95%CI: -0.608-0.498),-0.593 (95%CI: -0.654-0.548),-0.642 (95%CI:-0.707-0.612),P<0.01];PD-L1 与PD-1 表达呈正相关[r=0.21 (95%CI: 0.11-0.47),P<0.05]。ADCmean、ADCss、ADCmin三者间存在相关性[ADCmeanvs.ADCss:r=0.893 (95%CI: 0.871-0.912); ADCssvs.ADCmin:r=0.902 (95%CI: 0.877-0.922); ADCmeanvs.ADCmin:r=0.858 (95%CI: 0.833-0.879)]。
3 讨论
本研究采用三种不同ROI 勾画方法测量ADC 值,并探讨基于ADC值、临床及病理特征构建的列线图在预测宫颈癌PD-L1 阳性表达中的潜在价值。结果表明,ADCmin的诊断效能最佳,且将其联合临床、病理特征构建的列线图能够无创、准确、直观地预测PD-L1表达状态,进而为临床免疫疗法决策提供理论依据。
3.1 DWI定量参数预测宫颈癌患者PD-L1阳性表达状态的重要性
肿瘤组织中PD-L1 表达状态与免疫治疗密切相关[16-17],明确PD-L1 表达状态有利于指导临床治疗方案的选择。目前,PD-L1 表达状态主要是通过穿刺活检或手术病理对组织进行免疫组织化学染色明确,为有创性检查;并且,由于肿瘤的异质性,用于免疫组化的局部组织不能反映整个肿瘤的特征。因此,探究治疗前无创性预测宫颈癌患者PD-L1 表达状态有重要意义。DWI 对病灶敏感,能够反映组织中水分子布朗运动的微观变化,已被广泛用于表征肿瘤的内在特征。近年来,人工智能的迅速发展,应用ADC的纹理分析及影像组学[18-22]等预测肿瘤组织中PD-L1 阳性表达也表现出良好的诊断效能,但这些需要复杂的后处理工具,在临床实践中应用受限。因此,本研究选择DWI常规参数联合临床、病理特征,简单易行,更适用于临床实践及应用推广。
3.2 三种ROI选择方法提取ADC值的诊断效能比较
在我们的研究中,不同ROI 选择会影响ADC 值,与相关研究一致[23]。ADCmean、ADCss、ADCmin均与PD-L1阳性表达相关,与RASMUSSEN 等[24]及MEYER 等[25]在头颈部恶性肿瘤中的研究结果相似。从DWI中提取的ADC值可以定量分析病灶内水分子的扩散受限,进而反映其细胞密度变化[26-27]。PD-L1阳性表达的病灶内肿瘤细胞增殖更明显、更密集,其水分子扩散更受限,因此ADC 值也更低。本研究对三种ADC 值的诊断效能进行比较显示ADCmin的诊断效能最高,AUC 为0.882,以0.995×10-3mm2/s为临界值,鉴别PD-L1阳性表达的敏感度和特异度为84.00%和87.01%。肿瘤组织中水分子扩散受限最明显的区域与肿瘤细胞增殖最活跃、分布最为密集的区域相对应,ADCmin可更好地反映肿瘤的内在特征,这与YANG 等[13]和BICKEL等[28]在宫颈癌和乳腺癌中的研究一致。另外,与ADCmean及ADCss相比,ADCmin的观察者间一致性最高,可重复性强,稳定性好,更利于临床应用。
3.3 基于ADCmin、临床及病理特征的列线图预测宫颈癌PD-L1阳性表达的效能
本研究表明FIGO分期、病理分级、宫旁浸润、淋巴结转移、ADCmin与PD-L1阳性表达独立相关,与OMENAI等[29]及韩丽萍等[30]的研究一致。联合上述独立相关因素构建列线图,其诊断效能高(AUC=0.906),且优于临床病理模型及各单一独立相关因素。该列线图在验证组中也表现出良好的辨别及校准能力。决策曲线分析显示在训练组与验证组中联合模型的总体净收益均高于临床-病理模型。该列线图可能成为筛选免疫疗法获益潜在患者的有力工具。
3.4 宫颈癌PD-L1与PD-1表达的相关性分析
我们的研究结果发现宫颈癌PD-L1 与PD-1 表达呈正相关,与韩丽萍等[30]的研究结果一致。肿瘤细胞表面的PD-L1诱导人体组织T细胞表面的PD-1表达并与之结合导致T细胞凋亡及功能衰竭,从而开启免疫逃逸机制[31-32]。PD-1 高表达是T 细胞功能耗竭的标志[12]。
3.5 本研究的局限性
第一,训练组为回顾性收集且所有病例均来自单一机构,可能存在数据偏倚;第二,免疫组化所取材的肿瘤层面可能与肿瘤整体情况存在差异;第三,本研究仅使用单中心数据建立模型,需多中心研究进一步验证。
4 结论
综上,FIGO 分期、病理分级、宫旁浸润、淋巴结转移、ADCmin与PD-L1 表达独立相关。基于上述参数构建的列线图有助于预测宫颈癌组织PD-L1阳性表达,为临床免疫治疗决策提供依据。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:杨蔚设计本研究的方案,对稿件重要内容进行了修改,对论文整体进行全面审阅与把关,获得了国家自然科学基金项目资助;刘开惠起草和撰写稿件,获取、分析或解释本研究的数据;田海萍、张治宁、李云霞、何剑莉获取、分析或解释本研究的数据,对病例收集及稿件相关内容给予指导,对稿件重要内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

