7 例甲状腺具有乳头状癌核特征的非浸润性滤泡性肿瘤临床病理分析
胡爱艳 陈斯 李明 张树辉
甲状腺癌是一种非常常见的内分泌系统恶性肿瘤,近20 年来发病率不断上升,女性更为常见,发病率占女性肿瘤的第六位。据《中国癌症登记年度报告》[1]显示,甲状腺癌总体人群年龄标化发病率的平均每年增长百分比为12.4%,而标化死亡率为2.9%。甲状腺癌的主要组织学类型有甲状腺乳头状癌(PTC),滤泡癌(FTC)和未分化癌(ATC)等,其中PTC 占全球病例的80%[2]。2017 年,世界卫生组织将之前称为非浸润性包裹性滤泡型甲状腺乳头状癌(NI-EFVPTC)的一类肿瘤新命名为NIFTP,并重新分类[3]。目前为止国外报道比较多,国内较少。有文献报道,欧美国家50%以上的滤泡型甲状腺乳头状癌(FVPTC)均属于此种类型[4-6]。这一新命名的提用使病变性质发生了改变,不再归为恶性,不仅减轻了患者及家属的负面心理负担,而且增加了医生选择保守治疗及低频率随访的安全性,有效避免了过渡治疗。本文通过对7 例NIFTP 的临床病理学特征、治疗及预后进行回顾性分析,以期进一步提升对该肿瘤的认知。
资料与方法
1 临床资料
搜集上海中医药大学附属中西医结合岳阳医院2017 年6 月~2021 年7 月期间7 例NIFTP 手术切除标本。回顾分析临床病理资料并复习相关文献。所有病例均经两名有经验的病理医师重新阅片。
2 方法
标本经常规固定,脱水、石蜡包埋,4μm 厚度切片,HE 染色,光学显微镜下观察其病理组织学形态。免疫组化采用EnVision 两步法染色,选用一抗CK19、TG、TPO、Galectin-3、CyclinD1、HBME-1、KRAS,P53、Ki67 等均购自福州迈新公司。BRAF V600E 抗体购自DAKO 公司。PBS 代替一抗作为阴性对照。分子病理学检测采用ARMS 法,人类K-RAS/NRAS/B-RAF V600E 基因突变联合检测试剂盒购自厦门艾德公司。操作按说明书进行。
结果
1 临床特征
7 例NIFTP 中女性3 例、男性4 例,平均年龄48.9(35~64)岁。均为超声检查发现,无明显症状。超声示3 例为混合回声结节,4 例为低回声结节,边界均较清,3 例伴钙化,分别为TI-RADS3 类或TIRADS4A 类。病变均为单发,2 例位于甲状腺右叶,5例位于甲状腺左叶。甲状腺各项激素水平4 例正常;病例1(伴发PTC)与病例7 甲状腺球蛋白(TG)增高(合并结节性甲状腺肿);病例5 术前患有甲状腺功能减退(合并桥本氏甲状腺炎),TG 降低。患者资料,见表1。
2 病理检查
2.1 巨检肿瘤最大径0.3~2.3cm,平均直径1.1cm,与周围甲状腺组织界限清或有完整包膜。切面灰黄或灰黄灰红色,质软,实性,质地中等,未见出血及坏死。其中3 例伴钙化。2 例(病例1 与6)伴发乳头状癌,肿块间距均大于1cm。
2.2 镜检7 例甲状腺切除标本HE 镜下可见肿瘤组织界限清楚或有完整包膜(图1),无血管及包膜侵犯;细胞以滤泡状生长方式为主,滤泡大小不等(图2),可见腔内胶质浓缩,并可见细胞密集区(图3)。部分病例可见不典型的乳头样结构,但无血管轴心(图4)。细胞核可呈毛玻璃样改变,可见核重叠、核沟及包涵体(图5),但无细胞坏死、砂砾体及核分裂像。肿瘤间质有纤维化、钙化现象,周围甲状腺可见桥本甲状腺炎或结节性甲状腺肿等病理学改变。2例(病例1 与6)伴发乳头状癌,镜下呈浸润性生长,并见典型的甲状腺乳头状癌核结构及复杂的乳头分支结构。
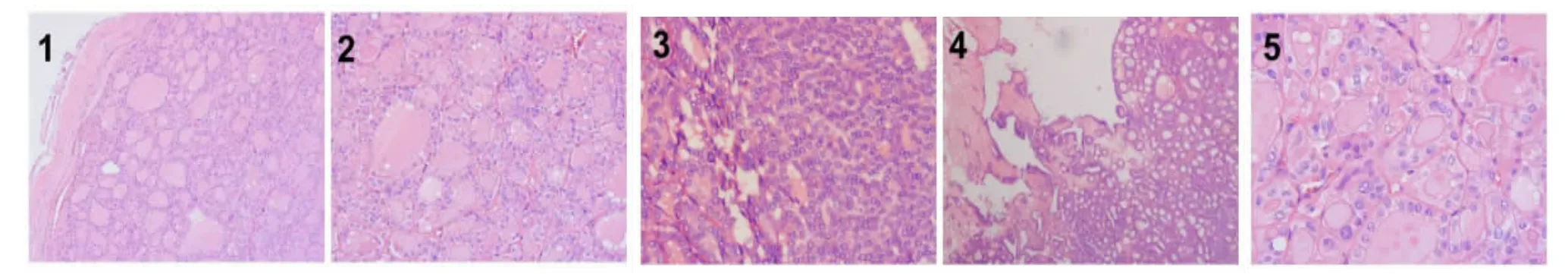
图1 肿瘤组织有完整包膜(HE×200);图2 细胞以滤泡状生长方式为主,滤泡大小不等(HE×200);图3 肿瘤细胞密集区,无滤泡结构(HE×200);图4 不典型乳头样结构,无血管轴心(HE×100);图5 肿瘤细胞核呈毛玻璃样改变,可见核沟及包涵体(HE×400)
2.3 免疫组化肿瘤细胞
CK19 (图6)、Galectin-3 (图7)、HBME-1、CyclinD1 均有不同程度阳性,KRAS、BRAF V600E均阴性,Ki67 增殖指数≤1%,见表2。
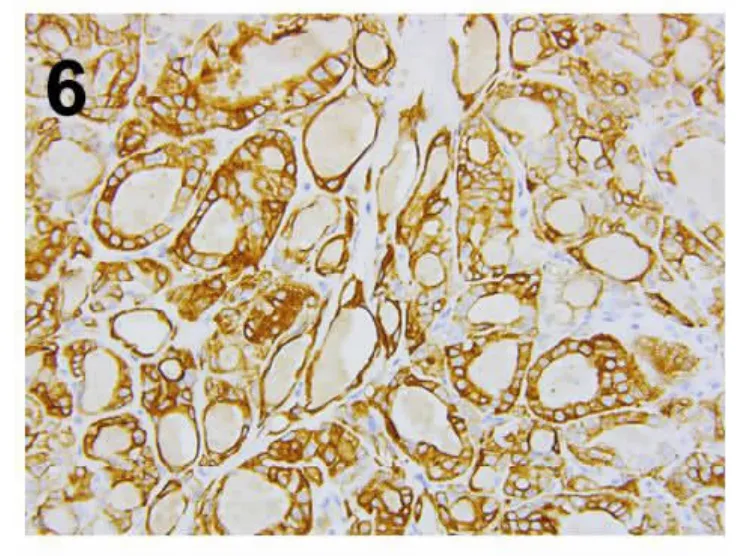
图6 肿瘤细胞CK19 胞质阳性(IHC×200)
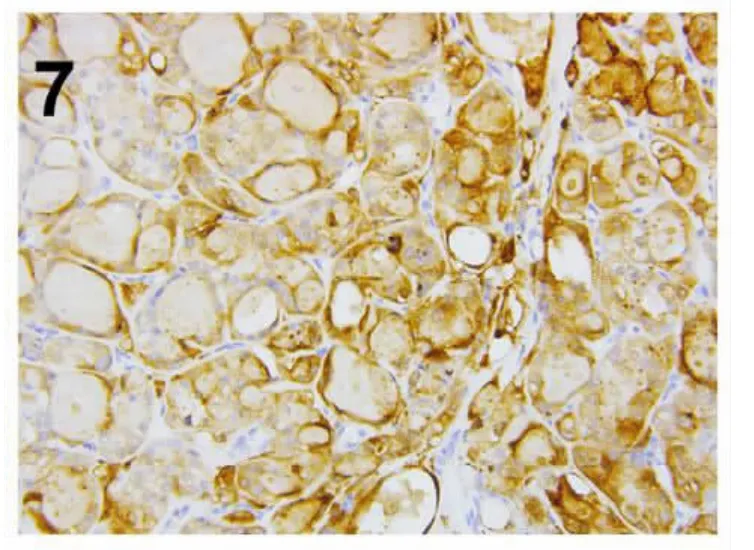
图7 肿瘤细胞Galectin-3 胞质阳性(IHC×200)
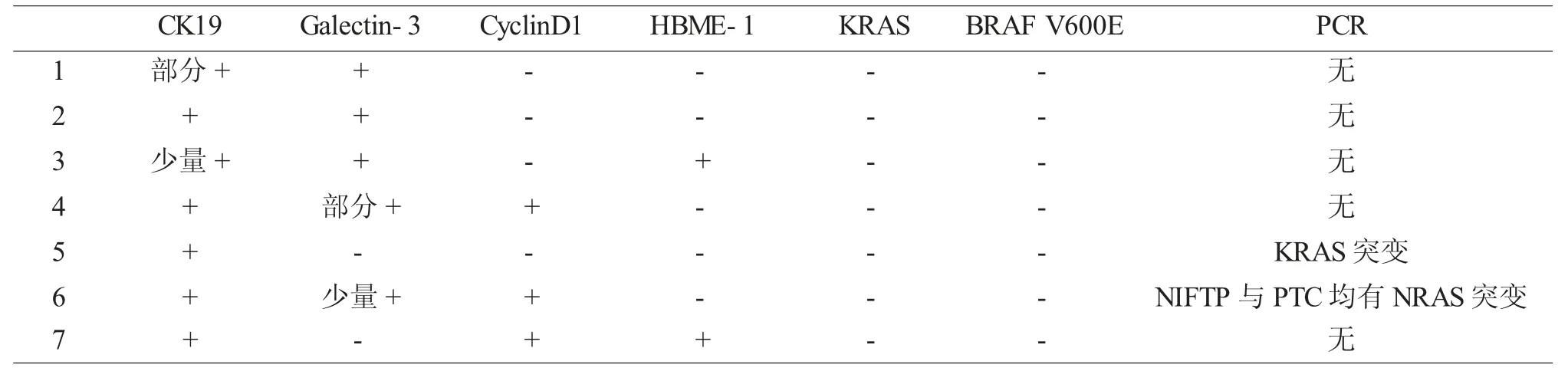
表2 7 例NIFTP 肿瘤细胞免疫组化及分子检测结果
2.4 分子检测本实验对NIFTP 和伴发的PTC 均行ARMS 法基因检测,病例5 存在KRAS 第3 外显子突变(图8),病例6 伴发乳头状癌(直径0.6cm)检测结果显示NRAS 第2 外显子点突变(图9),其余病例均无突变(图10),见表2。
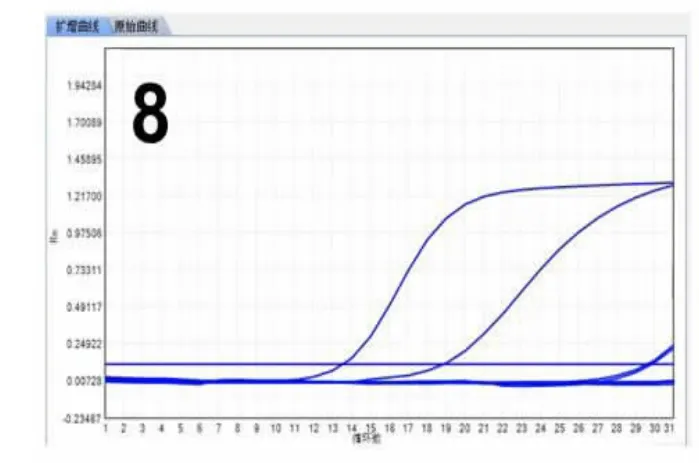
图8 NIFTP 中KRAS 第3 外显子点突变
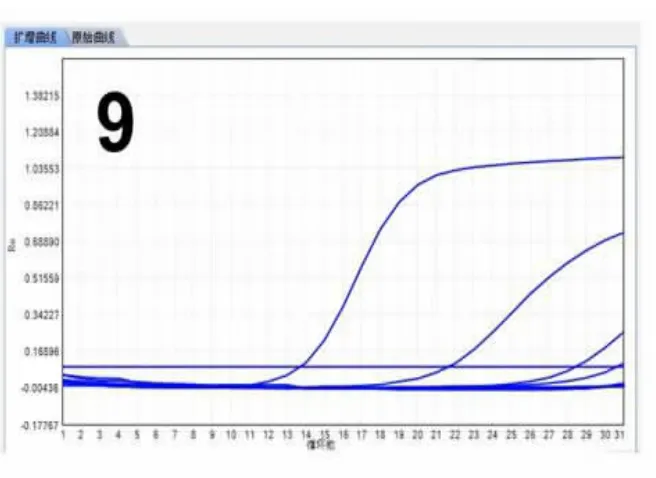
图9 NIFTP 中NRAS 第2 外显子点突变

图10 阴性对照
3 随访
7 例患者随访8~57 个月,均无复发或转移,见表1。
讨论
1 NIFTP 的定义
NIFTP 是一种非侵袭性肿瘤,其包膜或界限清楚,具有滤泡生长模式和甲状腺乳头状癌核的特征,无真性乳头状结构和砂粒体,无任何侵袭性PTC亚型和低分化癌的表现[7],被认为是一种交界性或恶性前病变。
2 临床特征
目前最新研究显示,该肿瘤在欧美等西方国家的发病率较高(约13.3%),在亚洲等国家发病率相对较低(约1.6%)[3]。患者多表现为无症状结节,甲状腺功能多正常,合并结节性甲状腺肿或桥本甲状腺炎者可表现为甲状腺功能异常。肿瘤直径大小不定,常见为2~4cm,可更大。与周围界限清或有完整包膜。发病年龄跨度广,但多见于40~60 岁。女性发病率较高(男女比约1∶3~1∶4)。超声常见表现为边界清楚,回声强度广泛变化,可表现为低、高或等回声[8],无侵袭性甲状腺癌的相关征象[9]。TIRADS 分级大多数为4 级,少数提示为3 或5 级。本组7 例中患者均为体检发现,无明显症状,肿瘤直径0.3~2.3cm,4 例男性,3 例女性,年龄35~64 岁,3 例示TI-RADS 3 类,4 例TI-RADS 4A 类。
3 组织学特征
2017 年内分泌器官肿瘤世界卫生组织明确提出了NIFTP 的诊断标准:①包膜完整或界限清楚;②无浸润;③滤泡生长方式;④乳头状癌核特征,细胞核评分2~3 分。排除性指标为:无分化良好的乳头结构;无沙砾体;<30%实性/梁状/岛屿状生长模式;无血管或包膜浸润;无肿瘤性坏死;核分裂像<3个/10 个高倍镜视野(400×)。
该肿瘤的诊断需要病变完全切除后,肿瘤与周围组织全部取材,严格按照诊断标准进行。
本组病例全部取材后,镜下观察:具有完整包膜或与周围组织界限清楚,呈滤泡型方式生长,未见核分裂像、砂粒体及坏死,肿瘤细胞核呈毛玻璃样,可见核沟,无典型乳头结构,参照WHO 诊断标准,本组病例诊断均符合NIFTP。
4 免疫组化
本组7 例NIFTP 的免疫组化结果与其他滤泡源性肿瘤类似,CK19、Galectin-3、HBME-1、CyclinD1均有不同程度阳性,可见免疫组化对于NIFTP 的诊断具有一定的提示作用。
5 分子学改变
Ghossein 等[10]对NIFTP 的分子学改变进行了深入研究,检测到了高频RAS 突变,还有部分PPAGR和THADA 重排,很少有BRAFV600E 突变。其高RAS 突变率与滤泡性肿瘤的基因改变类似[11]。
Point 等[12]研究发现了典型的乳头结构与BRAF V600E 突变之间有一定关系,在没有任何乳头结构的EFVPTC 肿瘤中没有BRAF V600E 突变。其他研究人员也发现乳头状癌常伴有BRAF V600E 突变[13,14]。BRAF V600E 突变属于高危突变,应该加强随访,严格定期监测血清甲状腺球蛋白水平及颈部超声[15]。
本组7 例肿瘤采用ARMS 法进行K-RAS、NRAS 以及B-RAF 基因检测,1 例显示K-RAS 突变,1 例显示NRAS 突变,RAS 突变率约为28.5%,BRAF V600E 均为阴性,与文献报道结果基本相符。
综上所述,基因突变检测有助于NIFTP 的诊断。因研究病例数量有限, 该肿瘤的基因突变情况还需积累更多病例深入研究。
6 鉴别诊断
①乳头状癌(PTC):总有经典的乳头状癌核特征及真性乳头结构,而NIFTP 无真性乳头结构。②滤泡癌:呈侵袭性生长,不具有乳头状癌的细胞核特征,其诊断需要有明确的包膜侵犯或脉管侵犯。CK19 基本均为阴性。③滤泡性腺瘤:是良性的有包膜的肿瘤,呈滤泡细胞分化,无乳头状癌核特征。④结节性甲状腺肿滤泡性增生结节:其常发生在结节性甲状腺肿的背景上,可有包膜,结节内大小滤泡混合,上皮细胞均无明显异型性,细胞核无乳头状癌核特征。⑤恶性潜能未定的滤泡性肿瘤:无乳头状癌核特征,存在可疑包膜或血管侵犯。⑥恶性潜能未定的高分化肿瘤:有可疑包膜或血管侵犯。
7 治疗及预后
随着人们体检意识的增加、超声及细针穿刺的广泛应用,亚临床肿瘤的检出逐年增多,虽然超声、细胞学及分子检查有助于NIFTP 的诊断,但其结果与包裹性滤泡型PTC 有一定重叠,尤其在清晰的组织界限上。鉴于NIFTP 的诊断标准,术前诊断是不可能的,而术中冰冻取材有限,也常常无法达到临床医生的理想诊断效果。就目前来看,没有一套固定的检查结果可以提供NIFTP 的准确诊断,但是临床医生了解到该肿瘤可能是NIFTP 也是很重要的,有助于综合分析患者的情况,灵活的选择手术方式。
NIFTP 虽然罕见,但可与PTC 同时发生,有文献报道甲状腺双侧NIFTP 伴发双侧PTC[16]。本组中有2 例NIFTP 伴发同侧PTC,患者行单侧(病例6)及双侧(病例1)腺叶切除术,术后按照PTC 行TSH抑制,未行放射性碘治疗,每6 个月随访,定期监测甲状腺激素水平,随访至今无复发转移。这提示病理医生诊断NIFTP 要严格参照诊断标准,同时要注意其他结节有伴发乳头状癌的可能。
NIFTP 预后良好,目前研究显示,完整切除后无复发或转移。2016 年,国际多学科工作组曾对109例患者进行预后评估,尽管半数以上的患者仅行单纯腺叶切除术,且所有患者均未行碘131 治疗,但术后随访10~26 年所有患者均无复发或转移。这一研究证明了该肿瘤完整切除后的良好预后[17]。也有文献中建议行单纯肿瘤切除[18],均不建议行完整的甲状腺切除及放射性碘治疗。本组术后随访8~57个月不等,均无复发或转移。
2019 年,一项关于NIFTP 的综述显示,NIFTP 死亡率为0,仅发现1 例肺转移[19],说明该肿瘤会出现远处转移,也有文献报道出现过区域淋巴结转移[20],因此NIFTP 的诊断需要严格参照诊断标准,术后需长期随访。NIFTP 患者的预后情况,还需要收集更多病例深入研究。

