丹参多酚酸对免疫性不孕大鼠的治疗作用及对下丘脑-垂体-卵巢轴的影响
柳艾霞 张庆玲 武志娟

摘要:目的 探討丹参多酚酸对免疫性不孕大鼠的治疗作用及对下丘脑-垂体-卵巢轴(HPOA)的影响。方法 取50只未孕雌性SD大鼠,采用人精液注射免疫的方法建立抗精子抗体阳性的免疫性不孕大鼠模型,将建模成功大鼠采用随机数字表法分为模型组(9只)、强的松组(10只)和丹参多酚酸低剂量组(9只)、中剂量组(10只)、高剂量组(10只),另取10只未孕雌性大鼠为正常对照组。强的松组经腹腔注射给予5 mg/kg强的松,丹参多酚酸低、中、高剂量组分别经腹腔注射给予10、20、40 mg/kg丹参多酚酸,正常对照组和模型组均给予等量生理盐水,每日1次,共14 d。各组雌性大鼠与正常雄性大鼠按3∶1数量比合笼2周,统计各组大鼠受孕率;放射免疫法测定血清中促性腺激素释放激素(GnRH)、卵泡刺激素(FSH)、黄体生成素(LH)以及雌二醇(E2)水平;苏木素-伊红(HE)染色观察大鼠卵巢组织病理改变情况;实时定量逆转录聚合酶链反应(qPCR)和蛋白质免疫印迹法检测大鼠卵巢卵泡刺激素受体(FSHR)、黄体生成素受体(LHR)、雌激素受体α(ERα)mRNA和蛋白表达。结果 与正常对照组相比,模型组大鼠受孕率,血清GnRH、FSH、LH、E2含量降低(P<0.05),卵巢内黄体和成熟卵泡明显减少,颗粒细胞层数减少,囊状卵泡较多,FSHR、LHR、ERα mRNA及蛋白表达降低(P<0.05)。与模型组相比,强的松组和丹参多酚酸中、高剂量组大鼠受孕率,血清GnRH、FSH、LH、E2含量升高(P<0.05),囊状卵泡数目减少,颗粒细胞层数增多,有成熟卵泡和黄体生成,FSHR、LHR、ERα mRNA及蛋白表达升高(P<0.05)。结论 丹参多酚酸可通过调控HPOA促进卵泡成熟治疗免疫性不孕。
关键词:不育,女性;下丘脑-垂体系统;促黄体激素;卵泡刺激素;受体,LHRH;丹参多酚酸;免疫性不孕
中图分类号:R711.6,R593文献标志码:ADOI:10.11958/20220990
Therapeutic effect of salvia miltiorrhiza polyphenolic acid on immune infertility rats and its
effect on hypothalamic-pituitary-ovarian axis
LIU Aixia ZHANG Qingling WU Zhijuan
1 TCM Gynecology Department of Jinan Second Maternal and Child Health Hospital, Jinan 250014, China; 2 Department of Reproduction and Genetics, Affiliated Hospital of Shandong University of Traditional Chinese Medicine
△Corresponding Author E-mail: luugs84@163.com
Abstract: Objective To investigate the therapeutic effect of salvia miltiorrhiza polyphenolic acid on immune infertility rats and its effect on hypothalamus-pituitary-ovarian axis (HPOA). Methods Fifty non-pregnant female SD rats were selected. A rat model of immune infertility with anti-sperm antibody (+) was established by human semen injection immunization. The model rats were divided into the model group (n=9), the prednisone group (n=10), the alvia miltiorrhiza polyphenolic acid low dose group (n=9), the salvia miltiorrhiza polyphenolic acid medium dose group (n=10) and the salvia miltiorrhiza polyphenolic acid high dose group (n=10) by random array table method. Another 10 non-pregnant female rats were selected as the normal control group. The prednisone group was given 5 mg/kg prednisone by intraperitoneal injection, and the salvia miltiorrhiza polyphenolic acid low, medium and high dose groups were given 10, 20 and 40 mg/kg salvia miltiorrhiza polyphenolic acid by intraperitoneal injection. The normal control group and model group were given the same amount of normal saline, once a day for 14 days. The female rats and normal male rats in each group were caged in a ratio of 3∶1 for 2 weeks, and the pregnancy rate of rats in each group was observed. The serum levels of gonadotropin-releasing hormone (GnRH), follicle-stimulating hormone (FSH), luteinizing hormone (LH) and estradiol (E2) were determined by radioimmunoassay. Hematoxylin-eosin (HE) staining was used to observe the pathological changes of rat ovarian tissue. Real-time quantitative reverse transcription polymerase chain reaction (qPCR) was used to detect rat ovarian follicle-stimulating hormone receptor (FSHR), luteinizing hormone receptor (LHR) and estrogen receptor alpha (ERα) messenger ribonucleic acid (mRNA) expression. Western blotting (WB) was used to detect rat ovarian FSHR, LHR and ERα protein expressions. Results Compared with the normal control group, the conception rate and the serum levels of GnRH, FSH, LH and E2 were decreased in the model group (P<0.05), the corpus luteum and mature follicles in the ovary were significantly reduced, the number of granulosa cell layers was reduced, and there were more cystic follicles, and the mRNA and protein expressions of FSHR, LHR and ERα were decreased (P<0.05). Compared with the model group, the conception rate and the serum levels of GnRH, FSH, LH, and E2 were increased in the prednisone group and the salvia miltiorrhiza polyphenolic acid medium and high dose groups (P<0.05), the number of cystic follicles was significantly decreased, the number of granulosa cell layers was increased, and mature follicles and corpus luteum were formed. The mRNA and protein expressions of FSHR, LHR and ERα were increased (P<0.05). Conclusion Salvia miltiorrhiza polyphenolic acid can promote follicle maturation by regulating HPOA in the treatment of immune infertility.
Key words: infertility, female; hypothalamo-hypophyseal system; luteinizing hormone; follicle stimulating hormone; receptors, LHRH; salvia miltiorrhiza polyphenolic acid; immune infertility
免疫性不孕是指由于生殖系统抗原的同种免疫和自身免疫等免疫因素造成的不孕症[1]。据统计,免疫性不孕占不孕症总体的10%~30%,且发病率呈逐年上升趋势[2]。目前临床上主要采用免疫抑制剂和促排卵药物进行治疗,但存在不良反应多、治疗周期长、疗效不理想的问题[3]。近年来研究发现,由于机体对下丘脑-垂体-卵巢轴(HPOA)的一个或多个组织抗原产生免疫应答,进而调节性激素水平,引起无排卵性闭经并最终导致免疫性不孕[4-5]。下丘脑通过分泌促性腺激素释放激素(GnRH)调节垂体释放卵泡刺激素(FSH)和黄体生成素(LH),在FSH和LH作用下诱导卵巢颗粒细胞分泌雌二醇(E2),促进卵泡发育成熟以及排卵[6]。丹参多酚酸为来自唇形科植物丹参的一种水溶活性成分,具有抗炎、抗栓、抗氧化、改善心血管损伤等药理学作用[7]。丹参可通过改善子宫内膜的形态以及局部血流状况,促进子宫内膜发育来治疗子宫内膜薄型不孕症[8]。但其是否对免疫性不孕有治疗效果,相关研究较为缺乏。本研究通过构建免疫性不孕大鼠模型,探究丹参多酚酸对免疫性不孕大鼠的治疗作用及对HPOA的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物与人精液标本 60只6~8周龄SPF级未孕雌性SD大鼠,平均体质量(205.57±20.42)g,20只6~8周龄SPF级雄性SD大鼠,平均体质量(297.16±29.33)g,均购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2020-0001。选取2019年4—7月山东中医药大学附属医院精子库的人正常精液35份,所用精液标本均获得捐献者本人知情同意,并签署临床研究知情同意书。纳入标准:(1)连续3次精液常规检查前向运动精子率>32%。(2)无与精液质量异常相关的疾病史。(3)各项性激素水平无异常。排除标准:(1)精液常规参数异常。(2)无完整病例及随访资料。本研究通过济南市第二妇幼保健院伦理委员会批准。
1.1.2 试剂与仪器 Freund完全佐剂(美国Sigma);灭活卡介苗(上海瑞楚生物科技有限公司);强的松(甘肃兰药药业有限公司);丹参多酚酸(上海绿谷制药有限公司);大鼠GnRH、FSH、LH及E2放射免疫分析法试剂盒(上海沪震实业有限公司);苏木素-伊红(HE)试剂盒(北京百奥莱博科技有限公司);抗精子抗体(AsAb)酶联免疫吸附试验(ELISA)试剂盒(上海康朗生物科技有限公司);卵泡刺激素受体(FSHR)、黄体生成素受体(LHR)、卵巢雌激素受体α(ERα)、β-肌动蛋白(β-actin)兔抗鼠一抗,山羊抗兔二抗(武汉华美生物工程有限公司)。C2500-R-230V型高速冷冻离心机(美国Labnet公司);BMS 175型超低温冰箱(法国Froilabo公司);alpha300 RS型光学显微镜(德国WITec公司);Veriti96 PCR型聚合酶链式反应(PCR)仪(美国Thermo Fisher公司);DT-MINIE-135型电泳仪[德诺杰亿(北京)生物科技有限公司];GelDoc Go型凝胶成像系统(美国BIO-RAD公司)。
1.2 方法
1.2.1 建模与分组干预 取20份人正常精液,4 ℃条件下以2 000 r/min(离心半径10 cm)离心30 min,将沉淀的精子用生理盐水冲洗2次,通过细胞计数板计数后以生理盐水稀释为3×1012个/L的精子悬液,加入Freund完全佐剂并加热,再加入灭活卡介苗混匀制成抗原,通过滴加生理盐水使精子密度最终为3×1011个/L。采用随机数字表法取50只雌性大鼠,经双侧腹股沟皮下注射0.5 mL制备的精子抗原。首次免疫后14 d,再取15份人正常精液,重复上述步骤,调整精子抗原密度为1×109个/L,在相同部位各注射0.5 mL进行加强免疫。在加强免疫后1 d,对各大鼠通过眼眶取血法取静脉血,ELISA法检测血清AsAb是否阳性,如大鼠AsAb阳性,提示建模成功[9]。最终共48只大鼠建模成功,采用随机数字表法分为模型组、强的松组和丹参多酚酸低、中、高剂量组,其中模型组和丹参多酚酸低剂量组各9只,其余各组均10只,另外10只未孕大鼠为正常对照组。强的松组经腹腔注射给予5 mg/kg强的松,丹参多酚酸低、中、高剂量组经腹腔注射给予10、20、40 mg/kg丹参多酚酸,正常对照组和模型组均给予等量生理盐水,每日1次,共14 d。
1.2.2 各组大鼠受孕率检测 将各组雌性大鼠与正常雄性大鼠按3∶1的数量比合笼2周,采用阴道涂片观察受孕情况,在光镜下观察到精子或阴道栓即为受孕成功。计算各组大鼠受孕率。受孕率=受孕大鼠数/本组大鼠总数×100%。
1.2.3 放射免疫法測定血清GnRH、FSH、LH及E2水平 取各组大鼠,1%戊巴比妥钠麻醉,经腹主动脉取血,以3 000 r/min(离心半径15 cm)离心10 min得到血清,根据试剂盒说明书操作步骤,采用放射免疫分析法检测大鼠血清中GnRH、LH、FSH及E2水平。
1.2.4 HE染色观察卵巢组织病理改变 将各组大鼠用1%戊巴比妥钠经腹腔注射麻醉大鼠,取一侧卵巢织固定于4%多聚甲醛溶液24 h后,梯度乙醇脱水,石蜡包埋,制成4 μm厚度切片,HE染色,脱水透明后中性树胶封片,光学显微镜下观察卵巢组织病理学变化。取另一侧卵巢组织于-80 ℃冰箱保存备用。
1.2.5 实时定量逆转录聚合酶链反应(qPCR)检测大鼠FSHR、LHR、ERα mRNA表达 取各组大鼠卵巢组织经液氮研磨后,提取总RNA,合成cDNA,以cDNA为模板行PCR。引物均由深圳华大基因股份有限公司设计合成。ERα引物上游5′-GGCATGCAGTTCAGAC-3′,下游5′-ATTGCAGTACGATCATC-3′,产物大小135 bp;FSHR引物上游5′-CCTAGAAGCTCGT-3′,下游5′-GATTATGCGTACGTC-3′,产物大小159 bp;LHR引物上游5′-CAATGACGATCGATCGTTC-3′,下游5′-TACGATACGTACA-3′,产物大小160 bp;β-actin引物上游5′-TACCGTACGATCGTCG-3′,下游5′-TCCGAACGTC-3′,产物大小201 bp。反应体系为20 μL,反应条件:50 ℃预变性2 min;95 ℃变性20 s;95 ℃退火3 s,60 ℃延伸20 s,40个循环。以β-actin为内参,2-ΔΔCt法计算各基因mRNA表达量。
1.2.6 蛋白质免疫印迹法检测大鼠卵巢FSHR、LHR、ERα蛋白表达 取各组大鼠卵巢组织经胰蛋白酶消化后,加入细胞裂解液提取总蛋白。测定蛋白浓度后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,按20 μg/孔进行蛋白上样,半干法转膜,将膜置于5%脱脂奶粉中封闭2 h,加入ERα、FSHR、LHR、β-actin兔抗鼠单克隆抗体(稀释比1∶1 000),于摇床上4 ℃孵育过夜,洗膜后加入对应的山羊抗兔二抗(稀释比1∶5 000),于摇床上37 ℃孵育2 h。充分洗膜后加入发光液曝光显影,GelDoc Go型凝胶成像系统成像,通过Quantity-One分析软件分析得到相应蛋白灰度值。
1.3 统计学方法 采用SPSS 16.0软件进行数据分析,计数资料以率表示,多组间比较采用Fisher确切概率法,组间多重比较采用χ2检验;计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠受孕率比较 正常对照组,模型组,强的松组,丹参多酚酸低、中、高剂量组受孕率分别为100.00%、11.11%、80.00%、11.11%、50.00%和80.00%,组间比较差异有统计学意义(χ2=27.509,P<0.01)。与正常对照组相比,模型组大鼠受孕率降低(P<0.01);与模型组相比,强的松组和丹参多酚酸中、高剂量组大鼠受孕率升高(P<0.05),丹参多酚酸高剂量组和强的松组大鼠受孕率差异无统计学意义。
2.2 各组大鼠血清GnRH、FSH、LH以及E2水平比较 与正常对照组相比,模型组大鼠血清中GnRH、FSH、LH、E2含量降低(P<0.05);与模型组相比,强的松组和丹参多酚酸中、高剂量组大鼠血清GnRH、FSH、LH、E2含量升高(P<0.05),丹参多酚酸高剂量组和强的松组大鼠血清中GnRH、FSH、LH以及E2含量差異无统计学意义,见表1。
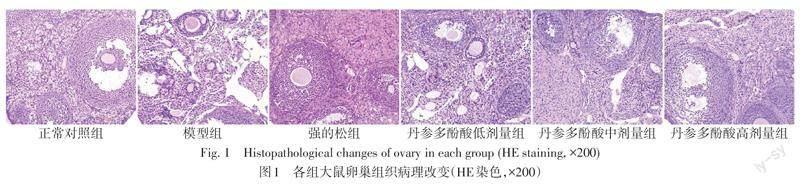
2.3 卵巢组织病理改变情况 HE染色显示,正常对照组大鼠卵巢内可见不同发育阶段卵泡和多个黄体,颗粒细胞层数较多,结构正常。模型组大鼠卵巢内可见黄体和成熟卵泡明显减少,颗粒细胞层数减少甚至消失,病理性囊状卵泡较多;强的松组和丹参多酚酸低、中、高剂量组卵巢内可见病理性囊状卵泡数目均有明显减少,颗粒细胞层数较模型组均有增多,排列整齐,原始卵泡和次级卵泡存在不同程度增多,有成熟卵泡和黄体生成。见图1。
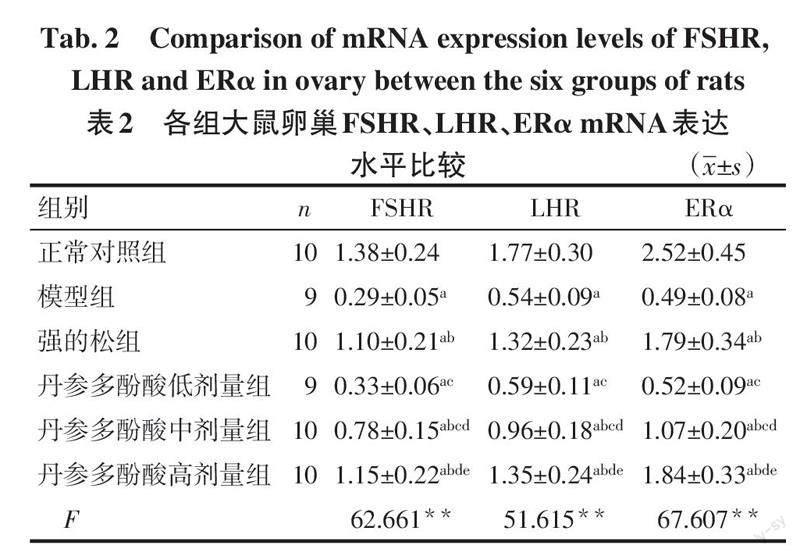
2.4 大鼠卵巢FSHR、LHR、ERα mRNA表达水平比较 与正常对照组相比,模型组大鼠卵巢FSHR、LHR、ERα mRNA表达降低(P<0.05);与模型组相比,强的松组和丹参多酚酸中、高剂量组大鼠卵巢FSHR、LHR、ERα mRNA表达升高(P<0.05),丹参多酚酸高剂量组和强的松组大鼠卵巢FSHR、LHR、ERα mRNA表达差异无统计学意义,见表2。
2.5 大鼠卵巢FSHR、LHR、ERα蛋白表达情况 与正常对照组相比,模型组大鼠卵巢FSHR、LHR、ERα蛋白表达水平降低(P<0.05)。与模型组相比,强的松组和丹参多酚酸中、高剂量组大鼠卵巢FSHR、LHR、ERα蛋白表达升高(P<0.05),丹参多酚酸高剂量组和强的松组大鼠卵巢FSHR、LHR、ERα蛋白表达差异无统计学意义,见图2、表3。
3 讨论
人体自身免疫功能失调,体内出现多种自身抗体是引起免疫性不孕的重要因素。免疫性不孕患者体内自身抗体或同种抗体的产生受机体内分泌系统的调节[10],因此探究HPOA与免疫性不孕的关系对寻求治疗免疫性不孕的新方法意义重大。
本研究结果显示,与正常对照组相比,免疫不孕模型组受孕率及血清GnRH、FSH、LH、E2水平均降低,卵巢内黄体、成熟卵泡及颗粒细胞层数明显减少,囊状卵泡较多。经丹参多酚酸干预治疗后,大鼠受孕率及血清中上述性激素水平均升高,囊状卵泡数目明显减少,颗粒细胞层数增多,有成熟卵泡和黄体生成,提示丹参多酚酸可通过调节HPOA促进性激素释放,有效缓解免疫性不孕大鼠卵巢病理性改变,促进卵泡成熟,提高大鼠受孕率。人体妊娠过程和免疫功能均受内分泌、神经、细胞因子等多种因素调节[11-12]。FSH可通过促进卵泡颗粒层细胞增殖分化诱导卵泡成熟,而LH不仅可以刺激卵泡成熟,还能够促进排卵并使卵泡转化为黄体。FSH和LH均可促进雌激素产生[13]。E2是成熟卵泡在FSH刺激下分泌的一种雌激素,其水平可有效反映卵巢功能,卵巢功能衰退将导致其水平下降。高郁森等[14]研究显示,免疫性不孕症患者血清中性激素水平发生显著改变,其中FSH、LH、E2水平均降低,经治疗后上述性激素水平均升高。此外,HPOA功能紊乱可引起机体内性激素调节紊乱,卵泡不能发育成熟,最终导致免疫性不孕发生[15]。
本研究结果显示,与正常对照组相比,模型组卵巢FSHR、LHR、ERα mRNA及蛋白表达降低。经丹参多酚酸干预治疗后,大鼠卵巢FSHR、LHR、ERα mRNA及蛋白表达均明显升高,提示丹参多酚酸可能是通过上调大鼠卵巢FSHR、LHR、ERα的表达,发挥治疗免疫性不孕作用。FSH主要通过与其受体FSHR结合促进雌激素的分泌及卵泡成熟,LH通过与其受体LHR结合促进黄体形成和排卵,E2主要通过与其受体ERα结合发挥调节排卵的生物学作用[16]。有研究发现,与正常大鼠相比,排卵障碍型不孕模型大鼠卵巢组织FSHR、LHR、ERα mRNA及蛋白表达水平均降低[17]。麦秀云等[18]发现丹参可通过调节多囊卵巢综合征大鼠性激素水平,改善大鼠受孕情况。Shen等[19]研究显示,丹参可有效提高多囊卵巢综合征患者的妊娠率。Jin等[20]研究发现,丹参酮可通过促进FSHR mRNA及蛋白的表达,减少囊状卵泡数目,增加黄体生成,改善小鼠多囊卵巢综合征。以上研究均证实丹参对性激素水平的调节作用和改善卵巢功能的作用,为本研究提供理论支持。
综上所述,丹参多酚酸可通过调控HPOA促进大鼠卵巢FSHR、LHR、ERα表达,提高免疫性不孕大鼠受孕率和血清中GnRH、FSH、LH、E2水平,促进卵泡成熟,治疗免疫性不孕,本研究为免疫性不孕的临床治疗提供实验依据。
参考文献
[1] MAL??KOV? K,AMBRUSOV? Z,BELVON??KOV? S,et al. Current possibilities of diagnostics and treatment of immunological causes of female infertility[J]. Cas Lek Cesk,2021,160(1):5-13.
[2] 张宏方,王金玲. 不孕不育与免疫[M]. 西安:世界图书出版社,2008:70. ZHANG H F,WANG J L. Infertility and immunity[M]. Xi'an:World Book Publishing House, 2008:70.
[3] 林蓉,曾勇,连若纯,等. 免疫性不孕症诊治的思考[J]. 实用妇产科杂志,2020,36(5):341-344. LIN R,ZENG Y,LIAN R C,et al. Thoughts on the diagnosis and treatment of immune infertility[J]. Journal of Practical Obstetric Gynecology,2020,36(5):341-344.
[4] YAMAGUCHI K. Tacrolimus treatment for infertility related to maternal-fetal immune interactions[J]. Am J Reprod Immunol,2019,81(4):e13097. doi:10.1111/aji.13097.
[5] SI W,LI H,KANG T,et al. Effect of GABA-T on reproductive function in female rats[J]. Animals(Basel),2020,10(4):567. doi:10.3390/ani10040567.
[6] LI J,HE P,ZHANG J,et al. Orcinol glucoside improves the depressive-like behaviors of perimenopausal depression mice through modulating activity of hypothalamic-pituitary-adrenal/ovary axis and activating BDNF-TrkB-CREB signaling pathway[J]. Phytother Res,2021,35(10):5795-5807. doi:10.1002/ptr.7237.
[7] LU P,XING Y,PENG H,et al. Physicochemical and pharmacokinetic evaluation of spray-dried coformulation of salvia miltiorrhiza polyphenolic acid and L-leucine with improved bioavailability[J]. J Aerosol Med Pulm Drug Deliv,2020,33(2):73-82. doi:10.1089/jamp.2019.1538.
[8] 鄧小满,彭莉芸,郑桂凤,等. 丹参注射液对改善子宫内膜薄型不孕症子宫血流的效果分析[J]. 药品评价,2018,15(14):35-37. DENG X M,PENG L Y,ZHENG G F,et al. Effect of salvia miltiorrhiza in jection in improving uterine blood flow in infertile women with endometriosis[J]. Drug Evaluation,2018,15(14):35-37. doi:10.3969/j.issn.1672-2809.2018.14.011.
[9] SUN X,WU B,GENG L,et al. Xiaokang Liuwei Dihuang decoction ameliorates the immune infertility of male rats induced by lipopolysaccharide through regulating the levels of sex hormones,reactive oxygen species,pro-apoptotic and immune factors[J]. Biomed Pharmacother,2021,139:111514. doi:10.1016/j.biopha.2021.111514.
[10] 王凌,潘心瑶. 免疫性不孕症中西医结合诊疗的思考[J]. 中国中西医结合杂志,2019,39(5):529-532. WANG L,PAN X Y. Thoughts on the diagnosis and treatment of immune infertility with integrated traditional Chinese and Western medicine[J]. CJITWM,2019,39(5):529-532. doi:10.7661/j.cjim.20181224.299.
[11] CALINA D,DOCEA A O,GOLOKHVAST K S,et al. Management of endocrinopathies in pregnancy:A review of current evidence[J]. Int J Environ Res Public Health,2019,16(5):781. doi:10.3390/ijerph16050781.
[12] MUTHUSAMI S,VIDYA B,SHANKAR E M,et al. The functional significance of endocrine-immune interactions in health and disease[J]. Curr Protein Pept Sci,2020,21(1):52-65. doi:10.2174/1389203720666191106113435.
[13] GUERRA D D,BOK R,CARI E L,et al. Effect of neuronal nitric oxide synthase serine-1412 phosphorylation on hypothalamic-pituitary-ovarian function and leptin response[J]. Biol Reprod,2020,102(6):1281-1289. doi:10.1093/biolre/ioaa025.
[14] 高郁森,李露,宋关书,等. 醋酸泼尼松片联合低分子肝素对免疫性不孕患者性激素水平和妊娠结局的影响[J]. 中国妇幼保健,2022,37(7):1260-1263. GAO Y S,LI L,SONG G S,et al. Effect of prednisone acetate tablet combined with low-molecular-weight-heparin on levels of sex hormones and pregnancy outcomes in patients with immune infertil-ity[J]. Maternal & Child Health Care of China,2022,37(7):1260-1263. doi:10.19829/j.zgfybj.issn.1001-4411.2022.07.029.
[15] 张少娣,张翠莲. 内分泌代谢性不孕症患者的管理[J]. 实用妇产科杂志,2020,36(5):338-341. ZHANG S D,ZHANG C L. Management of patients with endocrine and metabolic infertility[J]. Journal of Practical Obstetric Gynecology,2020,36(5):338-341.
[16] LI L,LU S,MA Q,et al. The comparison of reproductive hormone receptor expressions of the sheep ovary and hormone concentrations in two Chinese breeds[J]. Reprod Domest Anim,2019,54(6):892-901. doi:10.1111/rda.13441.
[17] 何丽娟,翟建英,杨海润,等. 参茸丸对排卵障碍型不孕大鼠性腺轴激素调节及卵巢功能的影响[J]. 中华中医药杂志,2021,36(10):6145-6149. HE L J,ZHAI J Y,YANG H R,et al. Effects of Shenrong Pills on gonadal axis hormonal regulation and ovarian function in ovulatory infertility rats[J]. CJTCMP,2021,36(10):6145-6149.
[18] 麥秀云,张静,郭乐琴. 黄芪丹参对多囊卵巢综合征大鼠雄激素/胰岛素受体表达影响的研究[J]. 世界中医药,2020,15(20):3051-3054. MAI X Y,ZHANG J,GUO L Q. Effects of Astragalus salvia on the expression of androgen/insulin receptors in rats with polycystic ovary syndrome[J]. World Chinese Medicine,2020,15(20):3051-3054. doi:10.3969/j.issn.1673-7202.2020.20.009.
[19] SHEN W,JIN B,HAN Y,et al. The effects of Salvia miltiorrhiza on reproduction and metabolism in women with polycystic ovary syndrome:A systematic review and meta-analysis[J]. Evid Based Complement Alternat Med,2021,2021:9971403. doi:10.1155/2021/9971403.
[20] JIN J,HU Q Y,XU W W,et al. Tanshinone IIA attenuates estradiol-induced polycystic ovarian syndrome in mice by ameliorating FSHR expression in the ovary[J]. Exp Ther Med,2019,17(5):3501-3508. doi:10.3892/etm.2019.7352.
(2022-06-27收稿 2022-10-08修回)
(本文编辑 李志芸)

