逍遥散通过调节肿瘤免疫微环境抑制肺转移前微环境形成
汤晓霞 邓皖利 张勇 陈彬 柴妮 张澍 谢曼丽
摘要:目的 探討逍遥散抗肿瘤转移作用的机制。方法 建立小鼠结肠癌CT26.WT移植瘤及肺转移模型,通过活体成像、肺组织解剖以及HE染色评价不同剂量(200、400、800 mg)逍遥散干预下的肺转移情况。免疫荧光及Western blot检测肿瘤M2型巨噬细胞标志物CD206、ARG1、PDL2表达;酶联免疫吸附试验检测血清中转化生长因子(TGF)-β和肿瘤坏死因子(TNF)-α的水平;流式细胞术检测肺组织中血管内皮生长因子受体1阳性(VEGFR1+)髓系细胞的募集情况;Western blot检测原位肿瘤组织磷脂酰肌醇3激酶(STAT3)、血管内皮生长因子(VEGF)及肺组织中转移前微环境标志物基质金属蛋白酶(MMP)-9、S100A8及Fibronectin表达。结果 逍遥散干预后,肺转移灶显著减少,小鼠肺组织中MMP-9、S100A8及Fibronectin的表达量显著降低,肿瘤相关巨噬细胞发生M1极化,血清中TGF-β的水平显著降低,TNF-α的水平显著升高,小鼠肺组织中VEGFR1+髓系细胞募集明显减少,肿瘤组织中STAT3磷酸化被抑制,VEGF表达量显著降低。结论 逍遥散的抗肿瘤转移活性与其抑制转移前微环境的能力有关,并且这种抑制作用可能通过肿瘤相关巨噬细胞的表型转化以及抑制STAT3信号转导实现。
关键词:逍遥散;肿瘤免疫微环境;转移前微环境;肿瘤相关巨噬细胞;肿瘤转移
中图分类号:R73-37文献标志码:ADOI:10.11958/20220136
XiaoYaoSan inhibits lung pre-metastatic niche formation through tumor immune microenvironment regulation
TANG Xiaoxia DENG Wanli ZHANG Yong CHEN Bin CHAI Ni ZHANG Shu XIE Manli
1 Putuo Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 200062, China; 2 Yueyang Hospital of Integrated Traditional Chinese and Western Medicine, Shanghai University of Traditional Chinese Medicine;
3 Changzheng Town Community Health Service Center, Putuo District
△Corresponding Author E-mail: 6274718522@qq.com
Abstract: Objective To investigate the mechanism of XiaoYaoSan in anti-tumor metastasis. Methods A mouse model of CT26.WT colon cancer xenograft and lung metastasis was established. In vivo imaging of small animals, lung tissue anatomy and HE staining were performed to evaluate the lung metastasis under different doses (200, 400 and 800 mg) of XiaoYaoSan intervention. Tumor M2 macrophage markers were detected by immunofluorescence and Western blot assay. Serum levels of transforming growth factor (TGF) -β and tumor necrosis factor (TNF) -α were detected by enzyme-linked immunosorbent assay (ELISA). The recruitment of VEGFR1+ myeloid cells in lung tissue was detected by flow cytometry. The expression levels of phosphatidylinositol 3-kinase (STAT3), vascular endothelial growth factor (VEGF) and pre-metastasis microenvironment markers matrix metalloproteinase (MMP) -9, S100A8 and Fibronectin were detected by Western blot assay. Results After XiaoYaoSan intervention, the lung metastasis was significantly reduced, expression levels of MMP-9, S100A8 and Fibronectin in lung tissue were significantly decreased, M1 polarization occurred in tumor-associated macrophages, the serum level of TGF-β was significantly decreased, and TNF-α level was significantly increased. The recruitment of VEGFR1+ myeloid cells was significantly decreased in lung tissue, STAT3 phosphorylation was inhibited, and VEGF expression was significantly decreased. Conclusion The antimetastatic activity of XiaoYaoSan is related to its ability to inhibit the pre-metastatic microenvironment, which may be realized by the phenotypic transformation of tumor-associated macrophages and inhibition of STAT3 signal transduction.
Key words: Xiao Yao San; tumor immune microenvironment; PMNs; TAMs; tumor metastasis
恶性肿瘤作为仅次于心血管疾病的第二大死因,其预防与治疗一直是医学界的研究热点[1]。约90%的恶性肿瘤死亡患者,其死因与肿瘤转移相关[2]。因此,研究与开发抗肿瘤转移药物具有重要的现实意义。研究表明,肿瘤的远端转移依赖于靶器官转移前微环境的形成[3-4],而原发病灶中的肿瘤相关巨噬细胞又在远端器官感知肿瘤细胞并形成转移前微环境的过程中发挥重要作用[5-7]。因此,肿瘤相关巨噬细胞可能是抗肿瘤转移药物的一个潜在治疗靶点。传统中医药在肿瘤的防治中具有独特优势。逍遥散作为经典的疏肝解郁方剂,具有疏肝健脾,养血解郁之功效。研究表明,其可通过影响肿瘤细胞磷脂酰肌醇3激酶/蛋白激酶B(PI3K/Akt)信号通路[8],降低体内雌激素水平、抑制肿瘤细胞增殖和侵袭[9]来抑制乳腺癌的进展。逍遥散对于肿瘤转移的抑制作用已得到证实,但其机制尚不清楚。本研究主要探讨其通过调节肿瘤免疫微环境抑制肺转移前微环境形成的机制。
1 材料与方法
1.1 实验材料 逍遥散组方由甘草12 g、当归12 g、茯苓30 g、白芍 12 g、柴胡12 g组成,由上海中医药大学附属普陀医院中药房提供。将药材粉碎、水煎并过滤后浓缩成含生药1.6 g/mL的水煎剂。荧光素酶标记的小鼠结肠癌CT26.WT/LUC细胞购自宁波明舟生物科技有限公司。SPF级5周龄雌性BALB/C小鼠40只,体质量(22±3)g,购自上海斯莱克实验动物有限责任公司,生产许可证号:SCXK(沪)2012-0002,饲养于上海中医药大学动物实验中心SPF级屏障环境中。动物使用许可证号:SYXK(沪)2018-0040。HE染色试剂盒购自北京索莱宝科技有限公司。鼠源基质金属蛋白酶9(MMP-9)、S100钙结合蛋白A8(S100A8)、纤维连接蛋白(Fibronectin)、血管内皮生长因子(VEGF)、M2巨噬细胞标志物CD206、血管内皮生长因子受体1(VEGFR1)、髓系细胞标志物CD11b抗体购自英国Abcam公司。磷酸化信号转导与转录激活因子3(p-STAT3)、信号转导与转录激活因子3(STAT3)、精氨酸酶1(ARG1)、细胞程序性死亡蛋白1配体2(PDL2)抗体购自CST公司,F4/80、β-actin抗体购自Santa Cruz公司,辣根过氧化物酶(HRP)偶联二抗购自SouthernBiotech公司,APC和FITC荧光标记二抗购自Thermo Fisher公司。转化生长因子(TGF)-β和肿瘤坏死因子(TNF)-α酶联免疫吸附试验(ELISA)试剂盒购自ABclonal公司。石蜡切片机、倒置荧光显微镜购自Leica公司,化学发光成像系统购自Bio-Rad公司,全波长酶标仪购自Thermo Fisher公司,流式细胞仪购自BD公司。
1.2 动物建模及给药 取荧光素酶标记的小鼠结肠癌CT26.WT/LUC细胞悬液,计数后按每只小鼠2×105个细胞接种至小鼠左前肢腋下,建立小鼠结肠癌模型。然后采用随机数字表法将其分为4组:模型组,低、中、高剂量逍遥散组,每组10只。接种次日开始,模型组每日生理盐水0.5 mL灌胃,低、中、高剂量组每日分别给予200、400、800 mg逍遥散水煎剂浓缩液灌胃(按生药计)。连续灌胃28 d,每3 d进行1次活体成像。在第14天每组取5只小鼠,脱颈处死后摘除眼球取血、分离原位肿瘤及肺组织,第28天取剩余小鼠,分离肺组织用于HE染色。
1.3 肺组织HE染色 将肺组织切成小块,常规固定、石蜡包埋、切片、脱蜡、水化、苏木精及伊红染色后脱水进行封片,显微镜下观察病理改变。
1.4 Western blot检测蛋白表达 将原位肿瘤组织、肺组织进行匀浆处理后,提取总蛋白并煮沸变性,使用BCA法进行蛋白定量,按每孔40 μg蛋白进行上样。使用5%浓缩胶及10%分离胶按恒压100 V进行SDS-PAGE,恒流400 mA湿转1 h将目的蛋白转至PVDF膜,5%脱脂牛奶进行封闭1 h,TBST洗膜后加入对应一抗MMP-9、S100A8、Fibronectin、VEGF、CD206、p-STAT3、STAT3、ARG1(均为1∶800稀释)、PDL2、β-actin(1∶5 000稀释),4 ℃振摇过夜,次日回收一抗,TBST洗膜后加入二抗(1∶10 000)孵育1 h,TBST洗膜后使用化学发光试剂盒,于凝胶成像系统上进行曝光,使用Image J软件进行灰度分析。
1.5 ELISA检测血清TGF-β、TNF-α表达 按试剂盒说明書进行操作,检测血清TGF-β、TNF-α表达水平,在全波长酶标仪上读取吸光度,并根据标准曲线转换为相应浓度。
1.6 免疫荧光染色法检测M1型巨噬细胞标志物iNOS表达 将肿瘤组织切成小块,常规固定、石蜡包埋、切片、脱蜡、水化后置于柠檬酸盐修复液中进行高温抗原修复,PBS清洗后加入0.2% TritonX-100进行透化,PBS清洗,加入山羊血清封闭1 h,PBS清洗后加入F4/80和iNOS一抗(1∶5 000稀释),4 ℃孵育过夜,次日回收一抗后PBS清洗,加入荧光二抗,暗盒中孵育1 h,PBS清洗后加入DAPI,暗盒中染色15 min,PBS清洗后封片,进行荧光显微镜下观察。
1.7 流式细胞术分析VEGFR1+髓系细胞比例 肺组织进行匀浆处理后,将细胞用滤网过滤,加入流式上样管中,加入5 μL的Fc阻断剂,室温避光孵育5 min;随后加入APC-VEGFR1、FITC-CD11b抗体各5 μL,避光孵育15 min;再加入红细胞裂解液3 mL,避光孵育6~8 min,待细胞悬液澄清后800×g离心5 min,吸去上清液,加入300 μL PBS,重复离心3次,混匀后上机检测VEGFR1+髓系细胞比例。
1.8 统计学方法 采用GraphPad Prism 6.0软件进行数据分析,符合正态分布的计量资料采用均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间多重比较采用Turkey法,以P<0.05为差异有统计学意义。
2 结果
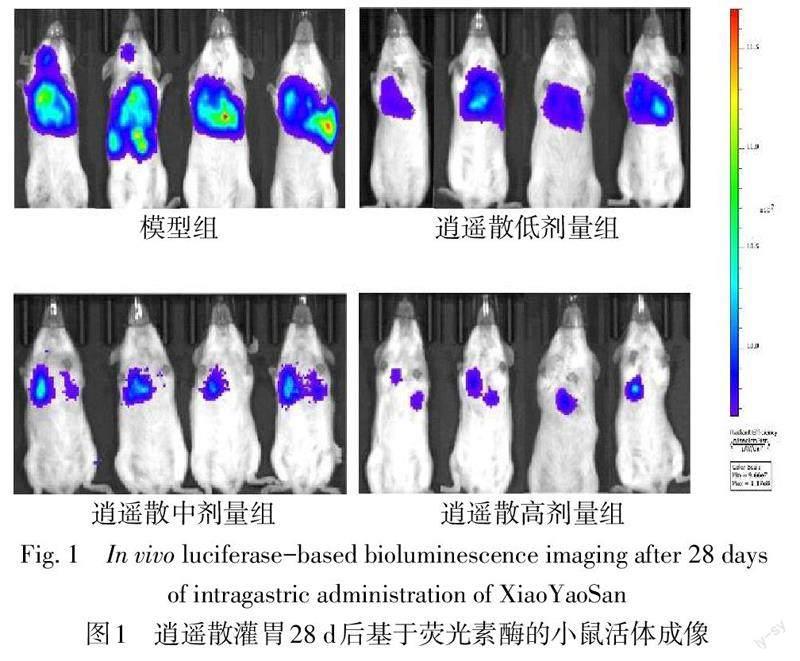
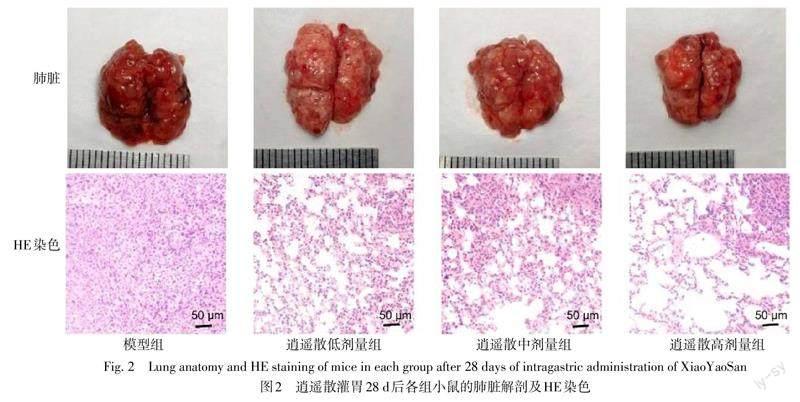
2.1 逍遥散减少小鼠结肠癌移植瘤的肺转移 结肠癌移植瘤小鼠分组灌胃处理28 d后,小动物活体成像及肺组织解剖观察到模型组结肠癌移植瘤出现明显的肺转移;模型组,逍遥散低、中、高剂量组肺转移灶数量分别为(52.67±6.64)个、(38.33±7.22)个、(23.67±4.33)个、(16.33+3.28)个,与模型组相比,逍遥散中、高剂量组的转移灶数量均下降(F=27.433,P<0.05)。HE染色显示,模型组肺组织实质化,肿瘤细胞大量浸润,逍遥散各剂量组的肺泡空腔明显。见图1、2。
2.2 各组MMP-9、S100A8及Fibronectin表达水平比较 各组小鼠分组灌胃处理14 d后,与模型组相比,逍遥散中、高剂量组小鼠肺组织中S100A8蛋白表达下降(P<0.01),逍遥散低、中、高剂量组MMP-9和Fibronectin蛋白表达下降(P<0.01),见图3、表1。
2.3 逍遥散促进肿瘤相关巨噬细胞向M1表型极化 免疫荧光染色结果显示,与模型组相比,逍遥散中、高剂量组原位肿瘤组织中M1型巨噬细胞(F4/80+/iNOS+细胞)的数量增加;Western blot结果显示,与模型组相比,逍遥散各剂量组M2型巨噬细胞标志物CD206、PDL2表达量均下降,中、高剂量组ARG1表达下降;ELISA结果显示,与模型组相比,逍遥散中、高剂量组血清中TNF-α的含量升高,而TGF-β的含量降低,见图4、5,表2。
2.4 各组肺组织VEGFR1+髓系细胞水平比较 模型组,逍遥散低、中、高剂量组VEGFR1+髓系细胞比例分别为(1.32±0.16)%、(0.84±0.10)%、(0.71±0.11)%、(0.71±0.05)%。与模型组相比,逍遥散各剂量组小鼠肺组织中VEGFR1+髓系细胞比例明显下降(F=34.850,P<0.01),见图6。
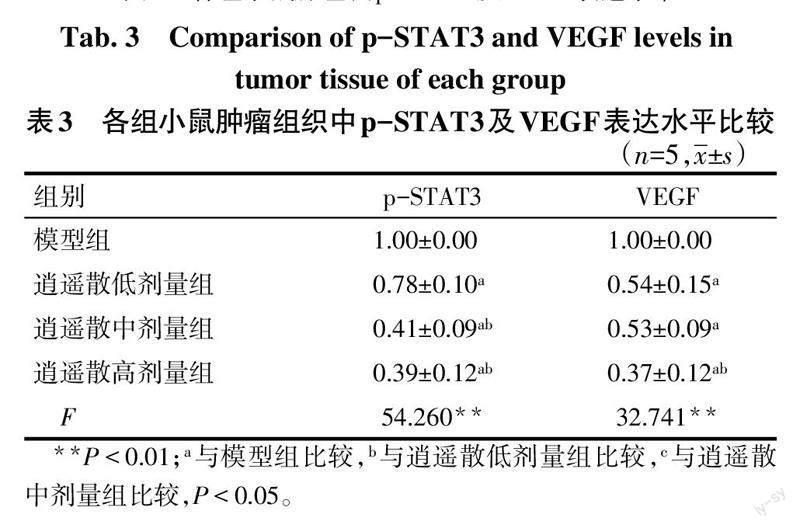
2.5 各组肺组织p-STAT3及VEGF蛋白表水平比较 与模型组相比,逍遥散各剂量组的肺组织中p-STAT3及VEGF蛋白表达水平下降(P<0.05),见图7、表3。
3 讨论
在恶性肿瘤的发展进程中,远端器官转移是不可避免的,然而正常器官组织的环境并不适合肿瘤细胞生長。近年来的研究发现,在肿瘤细胞到达远端靶器官之前,原发肿瘤就已释放出某种“信号”,使得远端靶器官的微环境发生改变,从而变得更适合肿瘤细胞定植[10-11],为肿瘤细胞顺利转移提供一张“温床”,具体表现为MMP-9、S100A8、Fibronectin的表达量增加以及VEGFR+的髓系细胞募集[12-14],而此时转移灶还未形成,因此被称为转移前微环境。既往研究发现,逍遥散具有一定的抗肿瘤效果。秦生发等[15]发现逍遥散能够下调肝郁脾虚症模型大鼠MMP-2的表达,减少罹患胃癌的风险。杨瑷竹[16]研究发现,逍遥散通过抑制炎性因子,调控PI3K/Akt信号通路抑制乳腺癌MDA-MB-231细胞的增殖、侵袭和转移。据此,本研究探讨了逍遥散的这种抗肿瘤转移作用是否与转移前微环境的形成有关。笔者建立小鼠结肠癌CT26.WT细胞移植瘤模型,证明逍遥散干预后能够有效抑制肺转移前微环境的形成。
原发肿瘤组织中,除了肿瘤细胞外,还存在大量间质细胞,其共同构成了肿瘤免疫微环境[17]。肿瘤组织中的巨噬细胞被称为肿瘤相关巨噬细胞。其M2表型产生的TGF-β能够促进肺组织中Fibronectin的形成[18]。本研究发现,逍遥散干预后可促进原位肿瘤相关巨噬细胞发生M1极化,减少TGF-β的释放,进而减少Fibronectin的生成。STAT3信号通路调控了其下游多种效应物的转录与激活,其中包括VEGF[19-20]。肿瘤相关巨噬细胞中的STAT3通路处于激活状态,VEGF大量释放,导致肿瘤血管新生[21],还能够促进含有VEGF受体的髓系细胞在外周募集[22]。本研究发现,逍遥散干预后,肿瘤组织中的STAT3磷酸化得到不同程度的抑制,其下游效应物VEGF的表达也出现相应的减少,通过对肺组织中的VEGFR1+髓系细胞进行分析,也证实逍遥散干预后,其在肺组织中募集显著减少。综合这些结果,笔者推测逍遥散的抗肿瘤转移活性与其抑制转移前微环境的能力有关,并且这种抑制作用可能是通过肿瘤相关巨噬细胞的表型转化以及抑制STAT3信号转导实现的。本研究初步探讨了逍遥散抗肿瘤转移活性的部分机制,为其抗肿瘤作用的后续研究以及临床应用提供了新的理论参考。
参考文献
[1] FERLAY J,COLOMBET M,SOERJOMATARAM I,et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods[J]. Int J Cancer,2019,144(8):1941-1953. doi:10.1002/ijc.31937.
[2] SIEGEL R L,MILLER K D,JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin,2020,70(1):7-30. doi:10.3322/caac.21590.
[3] PEINADO H,ZHANG H,MATEI I R,et al. Pre-metastatic niches: organ-specific homes for metastases[J]. Nat Rev Cancer,2017,17(5):302-317. doi:10.1038/nrc.2017.6.
[4] SCENEAY J,SMYTH M J,M?LLER A. The pre-metastatic niche: finding common ground[J]. Cancer Metastasis Rev,2013,32(3/4):449-464. doi:10.1007/s10555-013-9420-1.
[5] JOYCE J A,POLLARD J W. Microenvironmental regulation of metastasis[J]. Nat Rev Cancer,2009,9(4):239-252. doi:10.1038/nrc2618.
[6] CHEN P,BONALDO P. Role of macrophage polarization in tumor angiogenesis and vessel normalization: implications for new anticancer therapies[J]. Int Rev Cell Mol Biol,2013,301:1-35. doi:10.1016/B978-0-12-407704-1.00001-4.
[7] KITAMURA T,QIAN B Z,POLLARD J W. Immune cell promotion of metastasis[J]. Nat Rev Immunol,2015,15(2):73-86. doi:10.1038/nri3789.
[8] 何燦封,孙玲玲,林丽珠. 基于网络药理学探究逍遥散治疗乳腺癌的潜在机制[J]. 中国医院药学杂志,2020,40(21):2220-2226. HE C F,SUN L L,LIN L Z. Potential mechanism of Xiaoyao San for breast cancer based on network pharmacology[J]. Chinese Journal of Hospital Pharmacy,2020,40(21):2220-2226. doi:10.13286/j.1001-5213.2020.21.03.
[9] 杨佳慧. 丹栀逍遥散调控肿瘤相关成纤维细胞抑制乳腺癌生长、转移及分子机制[D]. 沈阳:辽宁中医药大学,2020. YANG J H. Danzhi Xiaoyao powder inhibits the growth, metastasis and molecular mechanism of breast cancer by regulating tumor-associated fibroblasts[D]. Shenyang:Liaoning University of Traditional Chinese Medicine,2020.
[10] GIL-BERNAB? A M,FERJANCIC S,TLALKA M,et al. Recruitment of monocytes/macrophages by tissue factor-mediated coagulation is essential for metastatic cell survival and premetastatic niche establishment in mice[J]. Blood,2012,119(13):3164-3175. doi:10.1182/blood-2011-08-376426.
[11] SHARMA S K,CHINTALA N K,VADREVU S K,et al. Pulmonary alveolar macrophages contribute to the premetastatic niche by suppressing antitumor T cell responses in the lungs[J]. J Immunol,2015,194(11):5529-5538. doi:10.4049/jimmunol.1403215.
[12] PSAILA B,LYDEN D. The metastatic niche: adapting the foreign soil[J]. Nat Rev Cancer,2009,9(4):285-293. doi:10.1038/nrc2621.
[13] DENG J,LIU Y,LEE H,et al. S1PR1-STAT3 signaling is crucial for myeloid cell colonization at future metastatic sites[J]. Cancer Cell,2012,21(5):642-654. doi:10.1016/j.ccr.2012.03.039.
[14] SAFARZADEH E,ORANGI M,MOHAMMADI H,et al. Myeloid-derived suppressor cells: Important contributors to tumor progression and metastasis[J]. J Cell Physiol,2018,233(4):3024-3036. doi:10.1002/jcp.26075.
[15] 秦生发,张铮,蓝敏敏,等. 逍遥散对慢性束缚应激肝郁脾虚证大鼠MMP2、TIMP2表达的影响[J]. 中国中医基础医学杂志,2021,27(7):1084-1088. QIN S F,ZHANG Z,LAN M M,et al. Effects of Xiaoyao Powder on expression of MMP2 and TIMP2 in rats with chronic restraint stress of liver depression and spleen deficiency syndrome[J]. Chinese Journal of Basic Medicine in Traditional Chinese Medicine,2021,27(7):1084-1088.
[16] 杨瑷竹. 基于PI3K/AKT通路探讨丹栀逍遥散抗乳腺癌骨转移的影响与机制研究[D]. 沈阳:辽宁中医药大学,2021:15-17. YANG A Z. The effect and mechanism of Danzhi Xiaoyao powder on bone metastasis of breast cancer based on PI3K/AKT pathway[D]. Shenyang:Liaoning University of Traditional Chinese Medicine,2021:15-17.
[17] MCALLISTER S S,WEINBERG R A. The tumour-induced systemic environment as a critical regulator of cancer progression and metastasis[J]. Nat Cell Biol,2014,16(8):717-727. doi:10.1038/ncb3015.
[18] BANSOD S,DOIJAD N,GODUGU C. Berberine attenuates severity of chronic pancreatitis and fibrosis via AMPK-mediated inhibition of TGF-β1/Smad signaling and M2 polarization[J]. Toxicol Appl Pharmacol,2020,403:115162. doi:10.1016/j.taap.2020.115162.
[19] TO?I? I,FRANK D A. STAT3 as a mediator of oncogenic cellular metabolism: Pathogenic and therapeutic implications[J]. Neoplasia,2021,23(12):1167-1178. doi:10.1016/j.neo.2021.10.003.
[20] GHARIBI T,BABALOO Z,HOSSEINI A,et al. Targeting STAT3 in cancer and autoimmune diseases[J]. Eur J Pharmacol,2020,878:173107. doi:10.1016/j.ejphar.2020.173107.
[21] MA Z,WEI K,YANG F,et al. Tumor-derived exosomal miR-3157-3p promotes angiogenesis, vascular permeability and metastasis by targeting TIMP/KLF2 in non-small cell lung cancer[J]. Cell Death Dis,2021,12(9):840. doi:10.1038/s41419-021-04037-4.
[22] MENG D,MENG M,LUO A,et al. Effects of VEGFR1(+) hematopoietic progenitor cells on pre-metastatic niche formation and in vivo metastasis of breast cancer cells[J]. J Cancer Res Clin Oncol,2019,145(2):411-427. doi:10.1007/s00432-018-2802-6.
(2022-01-23收稿 2022-09-18修回)
(本文編辑 胡小宁)

