血管细胞外基质胶促进骨髓CD34+祖细胞分化为内皮细胞的实验研究
左芯萌 王振华 高利平
摘要:目的 研究血管細胞外基质(ECM)胶促进骨髓CD34+祖细胞分化为内皮细胞的作用。方法 将人主动脉组织脱细胞后得到ECM,胃蛋白酶消化后得到ECM胶。HE染色和DAPI染色观察主动脉组织脱细胞效果。将小鼠骨髓CD34+祖细胞分为2组:纤连蛋白(FN)组置于涂有FN的培养板中培养;ECM组置于板底铺有人主动脉ECM胶的培养板中培养。逆转录聚合酶链反应(RT-PCR)检测CD34+祖细胞CD31、内皮型一氧化氮合酶(eNOS)及血管性血友病因子(VWF)mRNA表达;流式细胞术检测CD34+祖细胞表面标志物CD31、CD144、血管内皮生长因子受体2(VEGFR2)、CD133及CD45阳性细胞百分率;荧光显微镜下观察吞噬荧光素标记的乙酰化低密度脂蛋白(DiI-acLDL)的细胞数;蛋白芯片检测细胞分泌的促血管生成因子含量。结果 DAPI和HE染色均显示人主动脉组织脱细胞前含有大量细胞核,而脱细胞后得到的血管ECM中不含细胞核。与FN组相比,ECM组CD34+祖细胞CD31、eNOS及VWF mRNA表达升高,表达CD31、CD144及VEGFR2的阳性细胞率及吞噬Dil-acLDL的细胞数量增加,而表达CD133和CD45的阳性细胞率减少(P<0.05)。ECM组分泌血管生成素、成纤维细胞生长因子7、粒细胞-巨噬细胞集落刺激因子、瘦素及血小板源性生长因子BB较FN组增多(P<0.05)。结论 血管ECM胶可促进骨髓CD34+祖细胞分化为内皮细胞,可能为心血管植入物原位内皮化提供新策略。
关键词:细胞外基质;内皮细胞;细胞分化;CD34+祖细胞;内皮化
中图分类号:R331.3 文献标志码:A DOI:10.11958/20221138
Experimental study of vascular extracellular matrix gel promoting the differentiation of bone marrow CD34+ progenitor cells into endothelial cells
ZUO Xinmeng WANG Zhenhua GAO Liping
1 Department of Physiology, School of Basic Medicine, Xuzhou Medical University, Xuzhou 221004, China; 2 Department of Cardiovascular Surgery, Ren Ji Hospital, School of Medicine, Shanghai Jiao Tong University
Corresponding Author E-mail: pandag2011@sina.com
Abstract: Objective To investigate the role of vascular extracellular matrix (ECM) gel in promoting the differentiation of bone marrow CD34+ progenitor cells into endothelial cells. Methods ECM was obtained from the decellularized aortic tissue, and vascular ECM gel was prepared by enzyme digestion of vascular ECM. HE staining and DAPI staining were used to observe the decellularization effect of aortic tissue. Mouse bone marrow CD34+ progenitor cells were divided into two groups: the fibronectin (FN) group was cultured in plates coated with FN, and the ECM group was cultured in plates coated with human aorta ECM gel at the bottom of the plate. The mRNA expression of CD31, endothelial nitric oxide synthase (eNOS) and Von willebrand factor (VWF) were detected by RT-PCR in both groups. Flow cytometry was used to detect the percentage rates of positive CD31, CD144, vascular endothelial growth factor receptor 2 (VEGFR2), CD133 and CD45 positive cells. The number of phagocytic fluorescein labeled acetylated low-density lipoprotein (DiI-acLDL) cells was observed under fluorescence microscope. The content of proangiogenic factors secreted by cells was detected by protein microarray. Results Both HE and DAPI staining showed that human aortic tissue contained a large number of nuclei before decellularization, while the vascular ECM obtained after decellularization did not contain nuclei. Compared with the FN group, the expression levels of CD31, eNOS and VWF mRNA in CD34+ progenitor cells were increased, the positive rates of CD31, CD144 and VEGFR2 expressing cells and the number of phagocytosing Dil-acLDL cells were also increased in the ECM group, while the positive rates of CD133 and CD45 expressing cells decreased (P<0.05). The secretion of angiopoietin, fibroblast growth factor 7, granulocyte macrophage colony stimulating factor, leptin and platelet-derived growth factor BB were significantly higher in the ECM group than those of the FN group (P<0.05). Conclusion Vascular ECM gel promotes the differentiation of bone marrow CD34+ progenitor cells into endothelial cells, which may provide a new strategy for in situ endothelialization of cardiovascular implants.
Key words: extracellular matrix; endothelial cells; cell differentiation; CD34+ progenitor cells; endothelialization
心血管疾病致死已占据我国城乡居民死亡原因的首位,其中引起死亡最常见的心血管疾病为冠心病[1]。目前,治疗冠心病的主要手段为冠状动脉支架植入术和冠状动脉旁路移植术。然而,植入到冠状动脉内的血管支架和人工血管在术后均可能导致冠状动脉内血栓形成及血管狭窄等并发症[2-3]。研究发现,植入材料原位内皮化是解决血管内血栓及狭窄最有效的方法[4-5]。近期,通过捕获血液中的干/祖细胞并使之黏附在植入材料表面从而使材料内皮化的思路受到广泛关注,如Genous和COMBO心脏支架的表面包埋有CD34抗体,可捕获血液中CD34+祖细胞,使之粘附在支架表面;然而,这些支架表面捕获的祖细胞除分化为内皮细胞外,还可分化为其他细胞,如免疫细胞及平滑肌细胞等,不能实现植入材料表面完全内皮化[6]。由于细胞外基质(ECM)可提供特定的信号,诱导干/祖细胞分化为与ECM来源相同的组织或细胞[7-8],因此,本研究制备了血管ECM胶,并观察其诱导祖细胞分化为内皮细胞的效果,以期为心血管植入材料表面内皮化提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物和组织 清洁级C57BL/6J小鼠36只,6周龄,体质量(20±2)g,雌雄不限,购自上海斯莱克实验动物有限公司,动物生产许可证号:SCXK(沪)2017-0005。小鼠常规进食饮水,饲养1周后进行实验。人主动脉组织标本来自2014年6月—2015年10月上海仁济医院心血管外科行主动脉置换术的8例患者,其中男5例,女3例,年龄27~60岁。所取标本均取得患者知情同意,利用人主动脉组织进行的试验研究已通过上海仁济医院伦理委员会批准(批准号:2012027)。
1.1.2 主要试剂和仪器 6-二脒基-2-苯基吲哚(DAPI)、十二烷基硫酸钠(SDS)和胃蛋白酶购自美国Sigma公司;Ⅰ型DNA酶购自瑞士Roche公司;胎牛血清购自法国Biowest公司;小鼠CD34磁珠购自德国美天旎公司;RNA提取试剂盒购自美国zymo research公司;小鼠流式抗体CD31、CD34、CD133、CD144、CD45、血管内皮生长因子受体2(VEGFR2)购自美国Biolegend公司;1,1'-双十八烷基-3,3,3',3'-四甲基吲哚羰花青高氯酸盐标记的乙酰化低密度脂蛋白(DiI-acLDL)购自美国Invitrogen公司;小鼠蛋白芯片(型号:AAM-ANG-1)购自美国Raybiotech公司。冷冻真空干燥机(美国SP工业公司);冰冻切片机(德国徕卡公司);流式细胞分析仪(美国BD公司);扫描化学发光成像分析系统(型号Image Quant LAS 4000,美国GE公司);光学显微镜、荧光显微镜(日本尼康公司)。
1.2 方法
1.2.1 血管ECM制备 用预冷的磷酸盐缓冲液(PBS)清洗主动脉标本(图1)后将其切成1 cm×1 cm小块,用包埋剂包埋后在低温冰箱中放置2 h。用冰冻切片机将包埋的主动脉组织切成50 ?m厚的薄片,在0.5% SDS溶液中震荡12 h后用双蒸水充分漂洗主动脉组织切片,以脱去主动脉组织内细胞,再用Ⅰ型DNA酶溶液浸泡过夜,最后用冷冻真空干燥机干燥后保存。使用前在75%乙醇中浸泡2 h,然后紫外线照射8 h灭菌。
1.2.2 ECM胶制备 将制备好的ECM用液氮冷冻后研磨成粉末,置于含0.1 mol/L盐酸的胃蛋白酶溶液(1 g/L)中,搅拌72 h,得到的ECM液用1 mol/L氢氧化钠中和至中性,逐滴加入10×PBS使之形成黏稠胶液,铺满培养板板底,用冷冻真空干燥机干燥,紫外线照射8 h后使用。
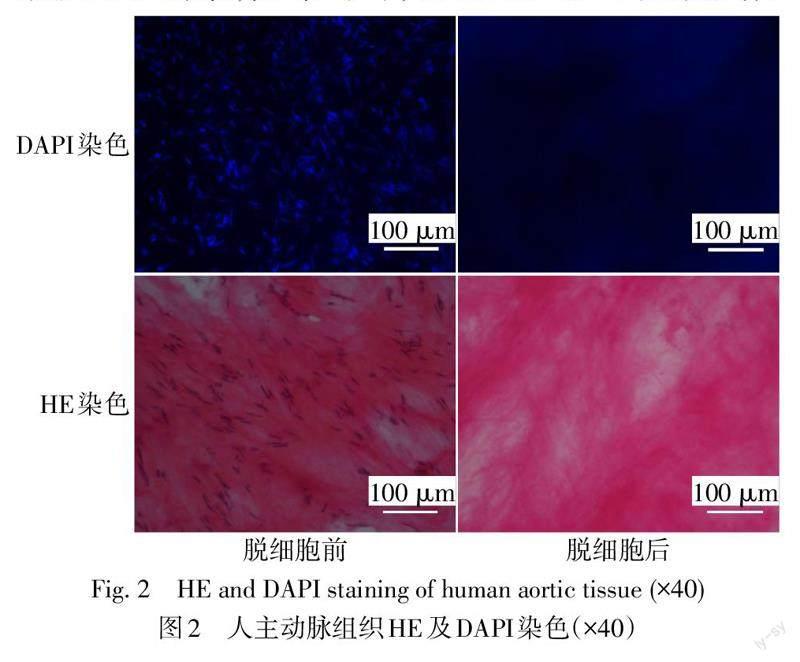
1.2.3 组织学观察 HE染色和DAPI染色观察主动脉组织脱细胞效果。
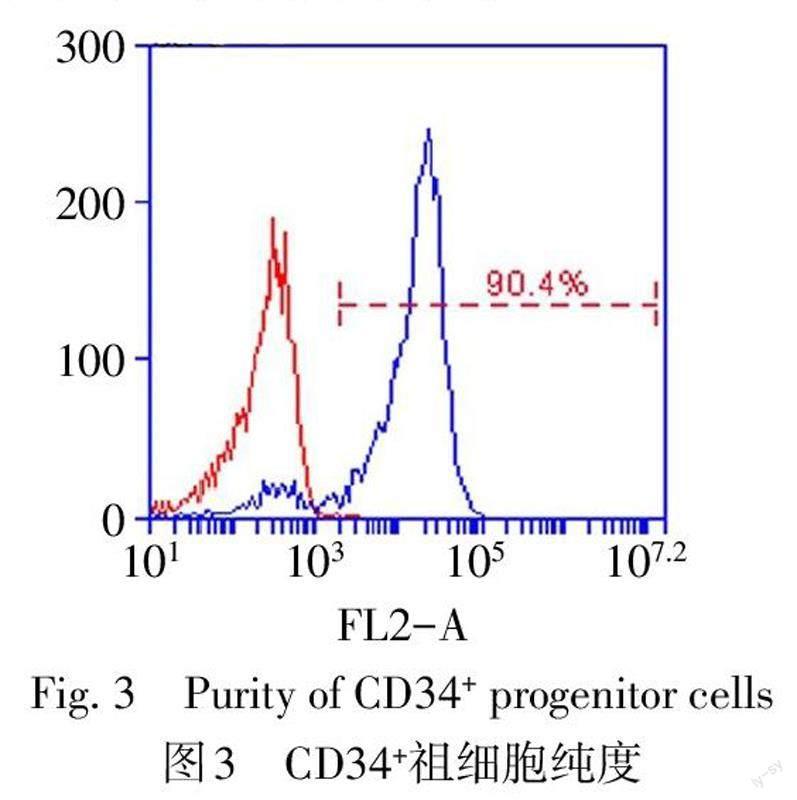
1.2.4 小鼠骨髓CD34+祖细胞分离、分组及生长情况观察 C57BL/6J小鼠颈椎脱臼法处死后,剪下小鼠前后肢,Hank's液冲洗小鼠胫腓骨骨髓腔,得到小鼠骨髓悬液;以淋巴细胞分离液室温下进行密度梯度离心后,在血浆层与分离液之间获取骨髓单个核细胞;然后加入1% BSA溶液封闭离心,再加入20 μL CD34磁珠,4 ℃避光孵育15 min,在分离柱上分离出小鼠骨髓CD34+祖细胞,取部分细胞与小鼠CD34流式抗体孵育后用流式细胞术检测其纯度。分离的细胞分为2组:纤连蛋白(FN)组置于涂有FN的培养板中培养;ECM组置于板底铺有人主动脉ECM胶的培养板中培养。2组均加入含15%胎牛血清的改良杜氏培养液(IMDM)培养,所有培养液中不另加生长因子。在培养的第5天用光学显微镜观察CD34+祖细胞在FN和ECM胶上的生长情况。
1.2.5 逆转录聚合酶链反应(RT-PCR)检测CD34+祖细胞CD31、内皮型一氧化氮合酶(eNOS)及血管性血友病因子(VWF)mRNA表达 将密度为1×106个/mL的CD34+祖细胞分别种植于铺有FN和ECM胶的培养板内,培养14 d时收集2组细胞。每组细胞采用Trizol法提取细胞总RNA,逆转录为cDNA后,利用PCR检测CD31、eNOS及VWF mRNA表达量。引物由上海生工生物工程有限公司合成,CD31引物:上游5′-CCAAGGTGGGATCGTGAGG-3′,下游5′-TCGGAAGGATAAAACGCGGTC-3′,产物大小187 bp;VWF引物:上游5′-ATGATTCCTGCCAGATTTGC-3′,下游5′-TGTCCCCCTGGTTTCTCAGA-3′,產物大小328 bp;eNOS引物:上游5′-TGATGGCGAAGCGAGTGAAG,下游5′-ACTCATCCATACACAGGACCC,产物大小129 bp;β-actin引物:上游5′-GCCACCCAGAAGACTGTGGAT-3′,下游5′-TGGTCCAGGGTTTCTTACTCC-3′,产物大小154 bp。反应条件:95 ℃预变性3 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸30 s,循环30次。RT-PCR产物经琼脂糖凝胶电泳及显像,所得图像用Image J软件进行半定量分析。
1.2.6 流式细胞术检测CD34+祖细胞表面标志物表达 在培养21 d时分别收集FN组和ECM组细胞,PBS洗涤重悬后,2组细胞悬液都分为5管,每管100 μL,含细胞1×106个,然后分别加入小鼠CD31、CD144、VEGFR2、CD133及CD45流式抗体2 μL,室温下冰上避光孵育30 min后用流式细胞仪检测各标志物阳性细胞百分率,结果采用CFlow Plus软件分析。
1.2.7 细胞吞噬功能观察 用IMDM培养液稀释DiI-acLDL,使其质量浓度为40 mg/L。在FN组和ECM组细胞培养至14 d时,取400 μL的DiI-acLDL溶液,分别加入2组细胞中,37 ℃孵育4 h,然后去掉培养液,PBS重悬后在荧光显微镜下观察吞噬DiI-acLDL的细胞数。
1.2.8 蛋白芯片检测CD34+祖细胞分泌的促血管生成因子表达 培养至14 d时收集2组细胞上清液,小鼠蛋白芯片检测CD34+祖细胞分泌的促血管生成因子的含量,利用扫描化学发光成像分析系统扫描蛋白芯片并提取数据,采用AAM-ANG-1蛋白芯片自带软件分析。
1.3 统计学方法 采用GraphPad Prism 5.0软件进行数据分析。计量资料用x±s表示,2组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 血管ECM染色及CD34+祖细胞种植情况 DAPI和HE染色均显示人主动脉组织脱细胞前含大量细胞核,而脱细胞后得到的血管ECM中不含细胞核,见图2。从小鼠骨髓分离出来的CD34+祖细胞纯度为90.4%,见图3。培养第5天发现ECM组CD34+祖细胞生长密集,分布均匀,而FN组CD34+祖细胞数量较少且分布不均匀,见图4。
2.2 血管ECM胶对CD34+祖细胞分化的影响 与FN组相比,ECM组CD34+祖细胞CD31、eNOS及VWF mRNA表达量均增加(P<0.05),见图5、表1。与FN组相比,ECM组表达CD31、CD144及VEGFR2的阳性细胞率升高,而表达CD133和CD45的阳性细胞率下降,见图6。FN组吞噬Dil-acLDL的细胞数量[(5.0±1.2)个/视野]较ECM组[(27.0±3.5)个/视野]减少(n=3,t=20.370,P<0.05),见图7。
2.3 2组CD34+祖细胞分泌促血管生成因子能力比较 蛋白芯片结果显示,ECM组细胞分泌血管生成素(Angiogenin)、成纤维细胞生长因子7(FGF-7)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、瘦素(Leptin)及血小板源性生长因子BB(PDGF-BB)较FN组增多(P<0.05),见表2。
3 讨论
正常血管的内皮细胞阻止血液与内膜下基质直接接触,可防止形成血栓;同时内皮细胞还分泌一些抑制平滑肌细胞增殖的因子,如一氧化氮(NO)、前列环素等,从而抑制内膜增生[9]。临床上使用的心血管植入材料由于没有内皮细胞层覆盖,常引起血栓形成及内膜增生等并发症,如药物洗脱支架虽然可通过释放药物来抑制血管平滑肌细胞增生,但同时也抑制了内皮细胞增殖,使支架表面內皮化延迟,导致血管内晚期血栓形成[10-11]。因此,在心血管植入材料与血液相接触的表层上建立内皮细胞层是防止血栓形成最有效的方式[12]。
一种促进植入材料表面内皮化的新方法是将特定的抗体或多肽固定在材料表面,以捕获血液中的干/祖细胞。为促进干/祖细胞的增殖及分化,植入材料表面常覆盖涂层,内含血管内皮生长因子等生物活性分子。研究发现含有血管内皮生长因子的涂层有抑制血管内膜增生的效果[13],但涂层中血管内皮生长因子的释放可能产生不良反应,如导致肿瘤发生[5]。将ECM的一种成分,如透明质酸或基质胶(主要成分为胶原蛋白)作为涂层覆盖于心血管植入材料表面,可促进材料原位内皮化[14-15]。然而单一ECM成分促进材料内皮化的作用有限,不如多种ECM成分效果明显[14]。心血管植入材料表面涂层应尽可能地与血管内皮细胞的ECM相似,才能提供最适宜的微环境以促进材料内皮化。基于此,笔者提取了血管ECM,尽可能保留其基质成分并制备ECM胶,以观察其对内皮祖细胞的诱导分化作用。结果发现,与在FN上培养相比,在血管ECM胶上培养的CD34+祖细胞标志物CD133表达降低,同时其内皮细胞标志物CD31、CD144、VEGFR2和内皮细胞基因CD31、VWF mRNA表达增加;此外,CD34+祖细胞eNOS mRNA也表达增加,而eNOS具有合成NO的作用,为成熟内皮细胞所表达;CD34+祖细胞还表现出较强的吞噬DiI-acLDL的能力,这是成熟内皮细胞的功能之一。这些结果表明在未加入任何生长因子或细胞因子的情况下,ECM胶促进了CD34+祖细胞分化为内皮细胞。这一功能使之适合作为涂层覆盖于心血管植入材料表面,并促进从血液中捕获的祖细胞(植入材料表面需包埋相应的抗体)向内皮细胞分化,从而导致植入材料的原位内皮化。
本研究检测CD34+祖细胞的旁分泌,发现与FN组相比,ECM组细胞分泌的Angiogenin、FGF-7、GM-CSF、Leptin及PDGF-BB明显增加。这可能是由于血管ECM是天然的细胞因子载体,可保护其不被降解或失活[16],从而使细胞上清液中这些促血管生成因子表达增加。Angiogenin、GM-CSF和Leptin均具有促进干/祖细胞向内皮方向分化的作用,如Angiogenin可促进循环血中的血管生成细胞分化为内皮细胞[17],GM-CSF可促进外周血来源的内皮祖细胞在纤维蛋白支架上分化为具有成熟表型的内皮细胞[18],Leptin可刺激人脂肪源性干细胞分化为血管内皮细胞,且这些因子间可通过协同的方式共同促进干细胞分化[19]。这些结果表明血管ECM胶具有促进干/祖细胞分化为内皮细胞的作用,提示其作为心血管植入材料涂层的优越性及植入材料原位内皮化的可行性。
綜上,血管ECM胶升高了CD34+祖细胞分泌的促血管生成因子水平,并促进其分化为内皮细胞,可能为心血管植入物原位内皮化提供一种新策略。
参考文献
[1] 《中国心血管健康与疾病报告》编写组. 《中国心血管健康与疾病报告2020》概述[J]. 中国心血管病研究,2021,19(7):582-590. The Writing Committee of the Report on Cardiovascular Health and Diseases in China. Key points of Report on Cardiovascular Health and Diseases in China 2020[J]. Chinese Journal of Cardiovascular Research,2021,19(7):582-590. doi:10.3969/j.issn.1672-5301.2021.07.002.
[2] BEST C,TARA S,WIET M,et al. Deconstructing the tissue engineered vascular graft:Evaluating scaffold pre-wetting,conditioned media incubation,and determining the optimal mononuclear cell source[J]. ACS Biomater Sci Eng,2017,3(9):1972-1979. doi:10.1021/acsbiomaterials.6b00123.
[3] ZHAO Y,WANG Z,BAI L,et al. Regulation of endothelial functionality through direct and immunomodulatory effects by Ni-Ti-O nanospindles on NiTi alloy[J]. Mater Sci Eng C Mater Biol Appl,2021,123:112007. doi:10.1016/j.msec.2021.112007.
[4] GUO H F,DAI W W,QIAN D H,et al. A simply prepared small-diameter artificial blood vessel that promotes in situ endothelialization[J]. Acta Biomater,2017,54:107-116. doi:10.1016/j.actbio.2017.02.038.
[5] 张明,赵卓,张建奇,等. 促进原位内皮化—冠状动脉支架生物活性涂层的研究进展[J]. 中国介入心脏病学杂志,2019,27(5):292-294. ZHANG M,ZHAO Z,ZHANG J Q,et al. Promoting in situ endothelialization:Research progress of bioactive coatings for coronary stents[J]. Chin J Intervent Cardiol,2019,27(5):292-294. doi:10.3969/j.issn.1004-8812.2019.05.011.
[6] AVCI-ADALI M,PERLE N,ZIEMER G,et al. Current concepts and new developments for autologous in vivo endothelialisation of biomaterials for intravascular applications[J]. Eur Cell Mater,2011,21:157-176. doi:10.22203/ecm.v021a13.
[7] PARMAKSIZ M,EL?IN A E,EL?IN Y M. Decellularized cell culture ECMs act as cell differentiation inducers[J]. Stem Cell Rev Rep,2020,16(3):569-584. doi:10.1007/s12015-020-09963-y.
[8] DA MATA MARTINS T M,DA SILVA CUNHA P,RODRIGUES M A,et al. Epithelial basement membrane of human decellularized cornea as a suitable substrate for differentiation of embryonic stem cells into corneal epithelial-like cells[J]. Mater Sci Eng C Mater Biol Appl,2020,116:111215. doi:10.1016/j.msec.2020.111215.
[9] QU Q,PANG Y,ZHANG C,et al. Exosomes derived from human umbilical cord mesenchymal stem cells inhibit vein graft intimal hyperplasia and accelerate reendothelialization by enhancing endothelial function[J]. Stem Cell Res Ther,2020,11(1):133. doi:10.1186/s13287-020-01639-1.
[10] JINNOUCHI H,GUO L,SAKAMOTO A,et al. Advances in mammalian target of rapamycin kinase inhibitors: application to devices used in the treatment of coronary artery disease[J]. Future Med Chem,2020,12(12):1181-1195. doi:10.4155/fmc-2019-0304.
[11] WAWRZYńSKA M,KRASKIEWICZ H,PAPROCKA M,et al. Functionalization with a VEGFR2-binding antibody fragment leads to enhanced endothelialization of a cardiovascular stent in vitro and in vivo[J]. J Biomed Mater Res B Appl Biomater,2020,108(1):213-224. doi:10.1002/jbm.b.34380.
[12] FILIPE E C,SANTOS M,HUNG J,et al. Rapid endothelialization of off-the-shelf small diameter silk vascular grafts[J]. JACC Basic Transl Sci,2018,3(1):38-53. doi:10.1016/j.jacbts.2017.12.003.
[13] TAN J,CUI Y,ZENG Z,et al. Heparin/poly-l-lysine nanoplatform with growth factor delivery for surface modification of cardiovascular stents:The influence of vascular endothelial growth factor loading[J]. J Biomed Mater Res A,2020,108(6):1295-1304. doi:10.1002/jbm.a.36902.
[14] CHEN L,HE H,WANG M,et al. Surface coating of polytetrafluoroethylene with extracellular matrix and anti-CD34 antibodies facilitates endothelialization and inhibits platelet adhesion under sheer stress[J]. Tissue Eng Regen Med,2017,14(4):359-370. doi:10.1007/s13770-017-0044-3.
[15] LI J,ZHANG K,WU J,et al. Tailoring of the titanium surface by preparing cardiovascular endothelial extracellular matrix layer on the hyaluronic acid micro-pattern for improving biocompatibility[J]. Colloids Surf B Biointerfaces,2015,128:201-210. doi:10.1016/j.colsurfb.2015.01.010.
[16] HOSHIBA T,CHEN G,ENDO C,et al. Decellularized extracellular matrix as an in vitro model to study the comprehensive roles of the ECM in stem cell differentiation[J]. Stem Cells Int,2016,2016:6397820. doi:10.1155/2016/6397820.
[17] CUCCI L M,SATRIANO C,MARZO T,et al. Angiogenin and copper crossing in wound healing[J]. Int J Mol Sci,2021,22(19):10704. doi:10.3390/ijms221910704.
[18] GRIEB G,SIMONS D,STEINBERGER H,et al. Improved in vitro cultivation of endothelial progenitor cells as basis for dermal substitutes with enhanced angiogenic capabilities[J]. Langenbecks Arch Surg,2011,396(8):1255-1262. doi:10.1007/s00423-011-0839-y.
[19] BEKHITE M M,FINKENSIEPER A,REBHAN J,et al. Hypoxia,leptin,and vascular endothelial growth factor stimulate vascular endothelial cell differentiation of human adipose tissue-derived stem cells[J]. Stem Cells Dev,2014,23(4):333-351. doi:10.1089/scd.2013.0268.
(2022-07-19收稿 2022-09-28修回)
(本文編辑 李志芸)

