指向“变化观念与平衡思想”的物质结构教学
——以补铁剂中配合物的应用为例
傅英懿 范晓媛
(北京市第十二中学 北京 100071)
一、教学背景
配合物在化学学科中具有广泛的应用,例如分析化学中定性测定、定量测定,在生命科学中也很重要,植物的光合作用离不开叶绿素,而叶绿素就是一个Mg2+的配合物,血液能靠着血红蛋白携带氧气,而血红蛋白的核心部位便是一个Fe2+的配合物,因此配合物的学习从知识本体来说具有丰富的社会价值。
从化学学科核心素养的培养目标来看,配合物这一载体不仅帮助学生丰富和完善自身动态平衡的视角,认识到配合物存在配位平衡,巩固“宏观辨识与微观探析”,并且在真实情境的问题解决中,认识到化学变化是有一定限度的,是可以调控的,帮助学生能够多角度的分析化学变化,运用化学反应原理解决简单的实际问题,进一步落实“变化观念与平衡思想”[1]。因此本教学案例选取补铁剂的发展作为研究对象[2],重点通过3个核心任务,落实和发展学生核心素养,展现了化学课程学习对学生未来发展的重要价值。
二、教学过程
1.深入解读课标及教材,确定教学目标
《物质结构与性质》新教材中,配位键是在第三章第四节提出来的,完善学生对于化学键的认识,配合物的制取也是学生必做实验。课标中对于配合物的要求是知道配位键的特点,认识简单的配位化合物的成键特征,了解配合物的存在与应用。要求学生能说明典型物质的成键类型,能解释某些配合物的典型性质。因此本节课是在学生学习了配位键的成键特点,了解了简单配合物的制备之后的一节体会配合物使用价值的综合复习课。本节课的功能是让学生体会配合物的使用价值,并且希望将配合物与之前所学的化学平衡建立起关联,不能独立地看待配位化合物,要求学生能够认识到配合物也是存在配位平衡的,该平衡是可以被调控的,体会配位平衡与其他反应间的竞争关系,能够动态地、多角度地分析和解决实际问题。
2.基于目标选取情境,设计核心任务
【引入——提取问题】
给出资料并提问:如何改善第一代补铁剂的问题。
资料:人们体内的铁大多来源于食物,食物铁经过胃酸作用,释放出Fe2+,然后在十二指肠被吸收。铁元素主要是以Fe2+被人体吸收,酸性环境更有利于Fe2+的吸收。第一代口服补铁剂:以硫酸亚铁为代表的无机补铁剂。硫酸亚铁快速释放的亚铁离子会对患者上消化道产生较大的刺激,并且由于Fe2+的氧化过程,会引起恶心、呕吐、腹部不适等不良反应[3]。
以补铁剂的发展为背景,提出真实问题:如何改善第一代补铁剂的问题?让学生认识到问题的解决需要先将真实问题转化成学科本体的问题,进而运用学科知识进行问题的分析,最终才能完成问题的解决。因此这一问题最终定位为速率问题和氧化还原问题,并提出改进方向:降低Fe2+的释放速率和被氧化速率。那么这些问题如何解决呢?
【解决问题——抗氧化问题】
以乳酸亚铁为研究对象,分析其形成过程复习配合物的成键特点:乳酸亚铁中氧原子提供孤电子对,Fe2+提供空轨道。进而提出问题:为什么乳酸亚铁可以起到抗氧化的作用?学生需要运用物质性质进行抗氧化问题的分析解释。乳酸亚铁可以抗氧化,一方面是由于配体中羟基具有还原性,可以抗氧化;另一方面是由于形成配合物后Fe2+浓度降低,还原性减弱,不易被氧化。进而继续分析富马酸亚铁、琥珀酸亚铁如何实现抗氧化,建立起配合物和物质性质之间的关联,让学生认识到物质的氧化性和还原性是可以通过形成配合物进行改变的,通过改变物质性质进行反应的调控,认识到物质的变化是有条件的,是可以调控的,并且在分析的过程中让学生体会到配合物在真实生活中的功能和价值。
【解决问题——缓释问题】
那么乳酸亚铁是如何在胃液中起到缓释的作用?学生首先需要将缓释和平衡建立起关系,缓释问题实际就是平衡移动问题,进而通过物质类别找到配位平衡,然后运用平衡移动原理进行分析:即胃液中氢离子会与弱酸根离子结合,从而使得配位平衡逆向移动,缓慢释放出Fe2+,实现缓释的目的,因此补铁剂大多都是亚铁离子和弱酸根形成的配合物。这一问题的设计旨在帮助学生认识配合物也是存在配位平衡的,配合物的稳定性不是一成不变的,是可以通过外界条件的改变进行调控的,能用动态平衡的观点看待和分析化学变化。此时进一步追问图1中两种补铁剂哪种缓释效果更好?
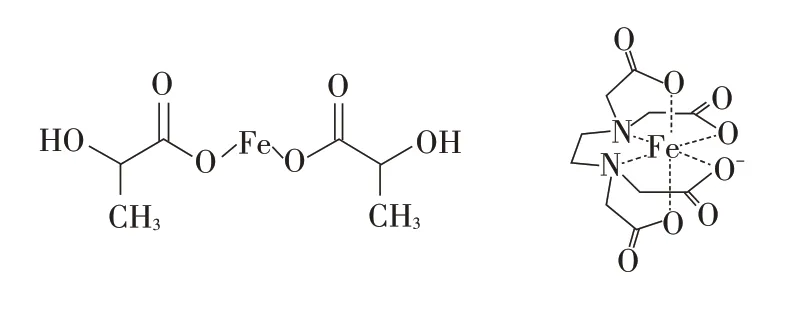
图1 两种补铁剂的结构简式
这一问题的提出帮助学生认识多齿配体,并且从配位键的个数认识配合物的稳定性,对于配位平衡的认识从定性逐渐过渡到半定量的维度,增加对于配位平衡的理解。这其实可以帮助同学们解决很多问题,例如在有机模块醛基的检验中,一种方法是利用银镜反应,既然都是正一价银离子作氧化剂,那为什么不直接用硝酸银,反而需要用银氨溶液?这其实也是一种缓释效果,让银离子通过配位平衡移动被缓慢释放出来,从而可以获得一层均匀分布,有序排列的光亮的银镜。这一缓释效果也经常应用于电镀这一工业生产中,为了获取致密、细腻的镀层也经常需要将电解液转换成含有相应离子的配合物,通过配位平衡移动实现缓释,最终达到工业要求。
【解决问题——铁元素检验】
这一环节的设置主要是进一步强化学生对于配位平衡的认识,并且体会配位平衡和其他平衡之间的竞争关系,体会反应条件对于反应的调控作用,增强学生运用化学反应原理解决真实问题的能力。
介绍两种Fe3+离子的检验方法:SCN-检测法和EDTA 检测法,并给出两个反应的平衡常数,即:Fe3++3SCN-Fe(SCN)3K≈105、Fe3++EDTA4-Fe(EDTA)-K≈1025。此时学生对于配位平衡的认识逐渐从定性、半定量,过渡到定量,从平衡常数的角度再一次认识多齿配体对于配合物稳定性的贡献。通过资料介绍,提出问题:为什么用KSCN检验Fe3+需要在酸性环境中进行?对于水溶液问题,从微粒组成入手分析,思考微粒间发生的反应:Fe3++3OH-====Fe(OH)3(副反应)、Fe3++3SCN-Fe(SCN)3(主反应),要想实现用SCN-进行Fe3+的检验,需要避免副反应的发生,需要调控pH,降低氢氧根离子浓度,即在酸性条件下进行铁离子检验。让学生体会到反应条件对于竞争反应的调控。那么为什么用邻二氮菲检验Fe2+需要控制pH 在2~9 范围内最好?学生根据刚才Fe3+检验的条件控制可以分析出此时条件的控制也是为了避免副反应的发生:Fe2++2OH-==== Fe(OH)2、与H+形成配合物,因此需要控制pH在2~9范围内。进一步体会到化学反应是有条件的,是可以调控的,落实核心素养中的“变化观念与平衡思想”。
三、教学反思
1.注重真实问题情境的创设
第一代补铁剂存在哪些问题?如何改善?正是这些真实的问题,激发了学生的学习热情,使学生从生活世界走进化学世界。如何解决补铁剂被氧化的问题?如何解决缓释的问题?这些真实问题促进学生交流讨论,并在这一过程中体会化学学科的社会价值,增强化学学科的自我认同感。
2.注重基于“学习任务”开展“素养为本”的教学
学习任务是连接核心知识和具体知识点的桥梁和纽带,是实现知识结构化的重要环节。本节课主要涉及了三个学习任务:如何解决抗氧化的问题,如何解决缓释问题?如何进行铁元素的检验?任务一是帮助学生认识到物质的变化是有条件的,是可以调控的。任务二是建立配位平衡,能用动态平衡的观点看待和分析化学变化,对平衡的认识从定性逐渐过渡到半定量。任务三强化学生从定量水平认识配位平衡,并体会配位平衡和其他平衡之间的竞争关系,体会反应条件对于反应的调控作用,提升了对于配位平衡的进一步认识。
——忌食

