基于“教、学、评”一体化的四线式教学设计*
——以“硫及其化合物第1课时”的教学为例
梁凤燕 刘志平 汤希雁
(南宁师范大学化学与材料学院 广西 南宁 530100)
一、问题的提出
《普通高中化学课程标准(2017 年版2020 年修订)》在“实施建议”中明确提出:要创设真实问题情境,促进学习方式的转变;要实施“教、学、评”一体化,有效开展化学日常学习评价[1]。
人类历史上和生活中有许多关于硫及其化合物的应用,但学生常常谈硫色变,对于硫的印象总是停留在硫酸伤人、酸雨腐蚀等负面新闻上面,极大削弱了学生对化学学习的热情,因此在讲授这一节内容时要注意转变教学方式,引导学生去发现硫及其化合物在生活当中的正面应用,改变对硫的负面印象,增强对生活和化学的热爱之情。本文将“历史线”为主线的“四线式”教学模式应用于“硫及其化合物”第一课时内容的教学当中,让真实的历史情境贯穿于整节化学课堂,一改以往学生对硫及其化合物的刻板消极印象,积极主动地完成本节内容的学习;同时在各个教学环节之中对学生开展多元化的过程性评价,充分促进学生化学核心素养的全面发展。
二、基于“教、学、评”一体化的“四线式”教学模式
“四线式”教学模式于2017 年由刘子忠教授团队的李红月硕士[2]首次提出。“四线式”教学模式是以某一事物在历史上的发现、发展及其应用等作为主线(历史线),创设探究情境,让学生在探究氛围中模拟前人的实验或者自主设计实验方案(探究线),并在探究过程中掌握相关的化学知识点(知识线),最后运用所学的知识解决相关的问题(应用线)。“四线式”教学模式能够有效地培养学生的学习兴趣以及化学学科核心素养。此外,教学评价是教学活动中的一个重要基本环节,也是判断核心素养是否有效落地的关键环节[3]。基于此,笔者将“教、学、评”一体化融入到“四线式”教学模式中(图1),首先课前以课标、学生学情以及教材为依据设置教学和评价目标;课中采取教师提问、交流讨论、设计实验方案等多元方式改进和完善教学;课后再通过学生自我检测、分层作业等方法反馈学习结果,教师再以此为依据调整后续教学[4]。
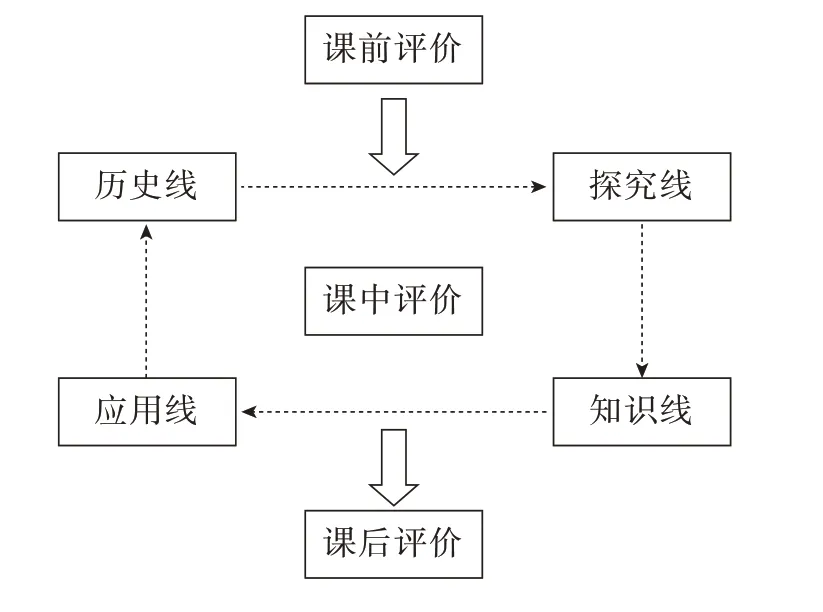
图1 基于“教、学、评”一体化的“四线式”教学模式
三、基于“教、学、评”一体化的“硫及其化合物”“四线式”教学设计
(一)教学目标和评价目标
1.教学目标
(1)通过实验探究理解硫及二氧化硫的物理、化学性质,并能正确书写相关化学方程式。(2)能够从硫元素的原子结构、价态以及硫元素在元素周期表中的位置出发,预测硫和二氧化硫的性质,形成基于物质类别、元素价态对物质性质进行预测和检验的认识模型。(3)通过设计如何防治酸雨等问题,感受化学物质及其变化的价值,进一步增强环境保护意识。
2.评价目标
(1)通过硫及二氧化硫性质的探究实验,诊断并发展学生自主设计实验方案以及实验操作的水平。(2)通过利用分类观与价态观推测物质性质,设计转化路径并选取合适的试剂进行初步实验验证等活动,诊断并发展学生基于事实获取结论,解释现象等认知水平和设计验证物质性质实验的水平。(3)通过设计汽车尾气排放处理以及酸雨治理防治的方法和措施,诊断并发展学生解决实际问题的能力水平及其对化学价值的认识水平。
(二)教学过程
[新课导入]播放硫的“自我介绍”。我是硫单质,自古就能当药材;我的哥哥二氧化硫,能杀菌消毒和漂白、防腐等;我的叔叔硫酸,是重要的化工原料,可用于生产化肥、农药、炸药、染料和盐类……
【教师】听了硫单质的自我介绍,同学们是不是想深入地了解一下硫家族呢?今天就让我们走近硫家族一探究竟吧!
环节一:硫的物理性质
环节一教学流程见图2。
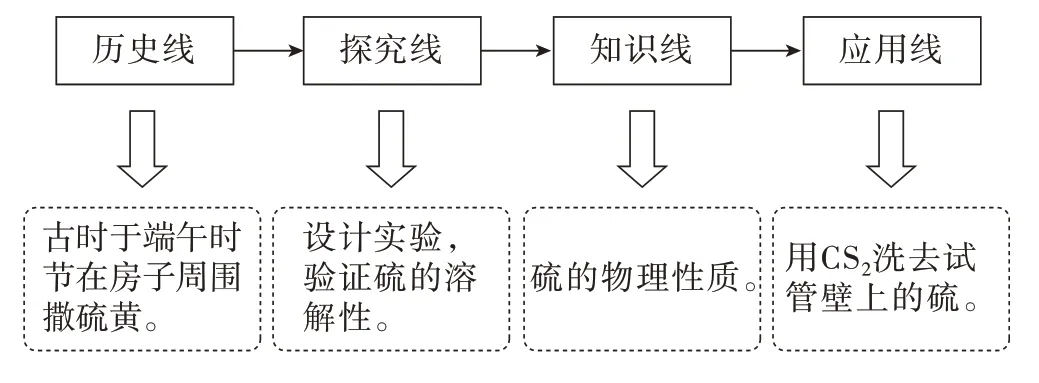
图2 环节一教学流程
【课件展示】古时候人们在每年的端午时节会在房子周围撒上一圈硫黄,以驱赶鼠蛇虫蚁。
【教师】夏天雨水充足,为什么将硫黄粉撒在房子外面?不会被雨水溶解吗?从中同学们可以得出什么信息?
【学生】硫粉可能不溶于水。
【自主探究实验1】向学生展示一瓶单质硫,学生观察其颜色、状态,各小组取一小块硫,试用研钵感受其脆性,并探究硫粉的溶解性(备有常见溶剂水、酒精、CS2溶液)。
【总结归纳】硫是一种黄色晶体,质脆,易研成粉末,难溶于水,微溶于酒精,易溶于CS2溶液。
【教师】实验室中用CS2溶液清洗管壁附着硫的试管。
环节二:硫的化学性质
环节二教学流程见图3。
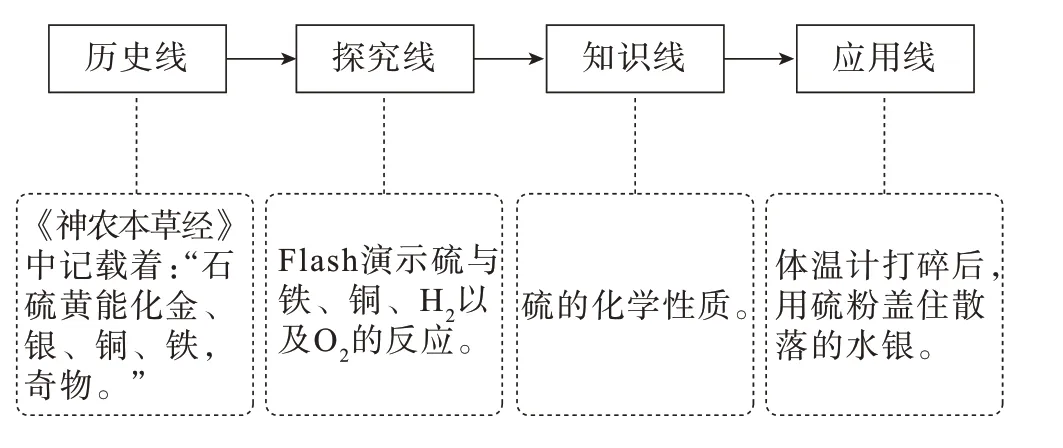
图3 环节二教学流程
【课件展示】东汉时期的《神农本草经》中记载着:“石硫黄能化金、银、铜、铁,奇物。”
【教师】从中可以得出关于硫的哪些性质?同学们可以结合硫在元素周期表中的位置来进行思考。
【学生】硫的最外层有6 个电子,容易得到2 个电子形成稳定结构,性质比较活泼,硫能和金、银、铜、铁金属单质发生反应。
【Flash 演示】两名学生协助演示硫与铁、铜、H2以及O2的反应,其余同学分组描述现象。
【教师】请同学们试着写出相关的化学方程式并互相点评。
【教师】若水银体温计打碎导致水银流出,可将硫粉洒在水银流过的地方,通过化学作用变成硫化汞,再收集处理。
环节三:二氧化硫的物理性质
环节三教学流程见图4。
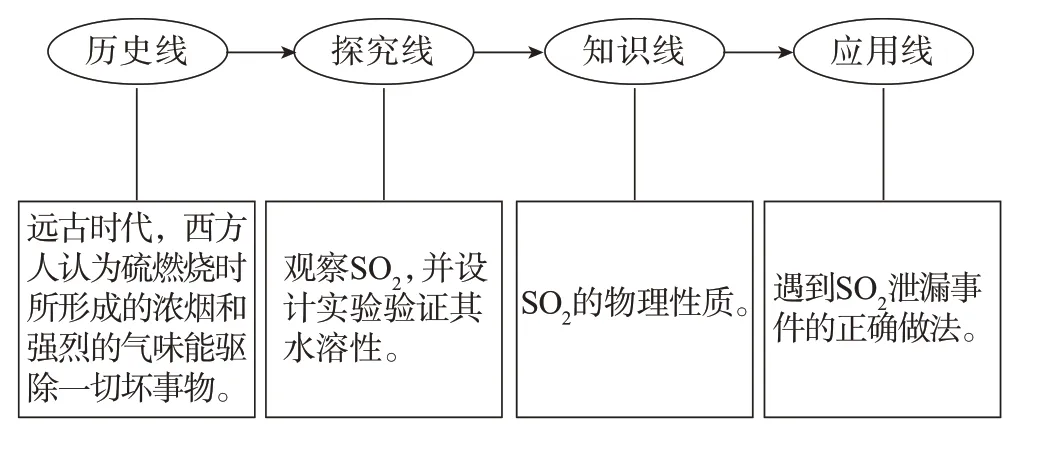
图4 环节三教学流程
【课件展示】远古时代,西方人认为硫燃烧时所形成的浓烟和强烈的气味能驱除一切妖魔和所有邪恶势力。
【教师】结合这个历史,从中可以得出关于SO2的哪些特点?
【学生】SO2可能具有一定的毒性。
【教师】同学们的猜想没错,现在摆在各个小组面前的是收集好的SO2气体,请同学们观察其颜色状态,并打开橡胶塞,注意一下空气中的味道。
【教师】在环节一中我们知道了硫难溶于水,SO2的水溶性又如何呢?请同学们小组内设计实验方案来验证SO2的水溶性。
【自主探究实验2】将集满SO2的集气瓶倒扣在水槽中,取下橡胶塞,若集气瓶中的液面上升,说明SO2溶于水(如图5所示)。
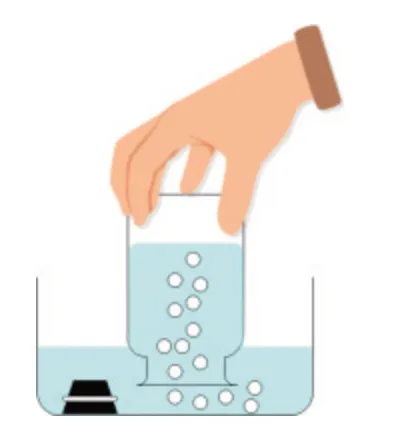
图5 二氧化硫溶于水
【总结归纳】SO2是一种无色、有刺激性气味的有毒气体,密度比空气大,易溶于水。通常情况下,1 体积的水可以溶解约40体积的SO2气体。
【教师】结合SO2的物理性质,若我们身边发生SO2泄漏事件,应该怎么做?
【学生】SO2密度比空气大,所以要迅速往高处撤离;SO2易溶于水,撤离时可用湿毛巾捂住口鼻,到达相对安全的地方后再报警。
环节四:二氧化硫的化学性质——与水反应、漂白性
环节四教学流程见图6。

图6 环节四教学流程
(1)二氧化硫与水反应
【课件展示】大约4000年前,古希腊和古罗马人已经能熟练地使用SO2来熏蒸消毒和漂白。
【教师】SO2是怎样起消毒和漂白作用的呢?请同学们分析SO2所属的物质类别,并思考它具有的性质。
【学生】SO2是酸性氧化物,具有酸性氧化物的通性,能与水反应生成对应的酸等等。
【教师】请同学们小组内合作,设计实验来探究SO2与水的反应。
【自主探究实验3】用胶头滴管向实验2 制得的SO2水溶液中滴加2~3 滴紫色石蕊溶液,观察溶液的颜色变化情况(如图7所示)。
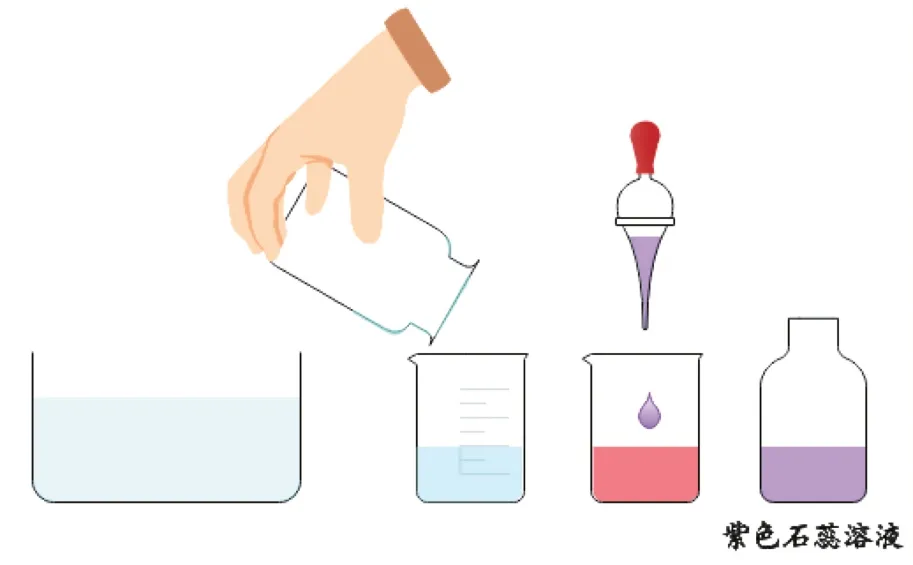
图7 二氧化硫与水反应生成酸
【教师】讲解SO2与水的不完全反应,引出可逆反应的概念。
【教师】请同学们写出SO2与水反应的化学方程式并互相点评。
【学生】SO2+H2OH2SO3。
【教师】SO2与水反应生成的H2SO3能够夺取菌体细胞中的氧,使菌体细胞失去O2这一生存的必要条件,最后导致细菌死亡,从而起到杀菌消毒的作用。
【课件展示】在葡萄酒酿制过程中,为防止葡萄汁中某些细菌的繁殖影响发酵,常添加适量的SO2。
(2)二氧化硫的漂白性
【教师】请同学们参考课本实验5-2,并利用前面实验中得到的SO2水溶液进行漂白性实验。
【自主探究实验4】用试管取2 mL实验3中得到的SO2水溶液,向其中滴入1~2 滴品红溶液,振荡,观察溶液的颜色变化,然后在通风情况下加热试管,再观察溶液的颜色变化。
【总结归纳】SO2具有漂白作用,但其漂白性是不稳定的、暂时的。
【教师】SO2能与有色物质生成不稳定的无色物质,生成的无色物质容易分解,见光、遇热或长久放置会使得有色物质恢复原来的颜色。
【学生】小组内讨论交流,回忆学习过的具有漂白性的物质(活性炭、HClO、H2O2)并比较它们的漂白原理,总结归纳(如表1所示):

表1 不同漂白性物质的比较
【教师】市场上刚买回来的草帽是经过SO2漂白过的,颜色比较白,但使用一段时间后,草帽颜色会逐渐变黄,是什么原因呢?
【学生】SO2与草帽中的色素发生化合反应,经过一段时间太阳照射后,生成的不稳定无色物质分解,导致SO2流失,草帽变回了黄色。
环节五:二氧化硫的化学性质——氧化性、还原性
环节五教学流程见图8。

图8 环节五教学流程
(1)二氧化硫的还原性
【课件展示】1831年,英国科学家菲利普斯发明了SO2在空气中通过炽热的铂粉或铂丝(催化剂)被氧化成SO3,并用水吸收生成H2SO4的方法,后人称此法为接触室法制硫酸。
【播放视频】接触室法制硫酸工艺。
【教师】接触室法制硫酸主要分为三个步骤,第一步是造气:将硫黄或经过粉碎的黄铁矿(FeS2)燃烧得到SO2;第二步是接触氧化:SO2和O2在接触室中接触V2O5,在500 ℃条件下发生反应生成SO3;第三步是SO3的吸收:SO3在吸收塔中被98.3%的浓硫酸吸收得到发烟硫酸。
【教师】第二步反应中,SO2表现出什么性质?
【学生】SO2中的硫由+4 价变成了SO3中的+6 价,表现出还原性。
【课件展示】SO2能够防止葡萄酒中的一些成分被氧化,起到保质作用,有助于保持葡萄酒的天然果香味。
(2)二氧化硫的氧化性
【课件展示】1883年,英国科学家C.F.克劳斯开发了H2S 氧化制硫的方法,在脱硫产生的含H2S 气体中回收硫,有效解决大气污染问题。
【播放视频】克劳斯法工业制硫工艺。
【教师】1883 年英国化学家克劳斯开发了H2S 氧化制硫的方法,但转化率不高。20世纪30年代,德国法本公司将克劳斯工艺发展为“改良克劳斯工艺”,H2S 的部分氧化分两阶段,一是的H2S 氧化为SO2:;二是余下的H2S 在催化剂的作用下与反应炉中的SO2反应:
【教师】改良克劳斯工艺第二阶段的反应中,SO2表现出什么性质?
【学生】SO2中的硫由+4 价变成了硫单质中的0价,表现出氧化性。
【课件展示】在食品加工过程中,利用SO2的氧化性,能够有效地抑制食品加工过程中的非酶褐变,保护食品“本色”。
【课堂小结】通过今天的学习,相信同学们对硫家族已经有了全新的认识,我们要辩证地看待硫及其化合物给人类带来的贡献与危害,养成一分为二看待问题的好习惯。
【作业布置】1.查阅资料,了解汽车尾气、酸雨的形成以及防治措施;2.以价类二维图表示出硫元素的常见价态和代表物。
四、结语
至2018年开始,全国大多数省市区都迎来了新一轮课程改革和高考改革,学生选课制将大力冲击传统课堂。在这样的形势下,化学学科也将面临着全新的挑战。如何让化学课堂被学生喜欢,进而成为学生的必选项,成为了每一个高中化学教学者需要深思的问题。“四线式”教学模式在激发学生学习兴趣方面具有明显优势,通过将化学史与学生的自主探究活动结合起来,增强学生化学素养和人文素养的同时还能够逐步提高学生的知识水平和探究能力,更能使学生逐步形成严密的科学思维;除此之外还能够培养学生将所学知识应用于实际的生产生活中的能力,这些都是新一轮课程改革的要求。因此将“四线式”教学模式应用在高中化学教学当中具有积极的意义。

