乏情期发情绵羊卵巢miRNA及相关靶基因筛选
谢梦婷 解一凡 朱梦婷 南颖 方晨辉 江白慧 齐行东 赵宗胜

摘要:目的 篩选、鉴定绵羊卵巢差异MicroRNA(miRNA)并研究其调控机制,为绵羊非繁殖季节发情的研究奠定基础。方法 使用Solexa测序技术进行筛选和分析,对发情和乏情绵羊卵巢,差异miRNA的数量和特征进行鉴定,通过实时荧光定量PCR进行检测。还进行了对miR-200c靶基因检测、GO注释和KEGG信号通路富集等的研究工作。并通过TargetScan技术、RNAhybrid技术等,成功找到了MAPK8-3′端非翻译区(3′UTR)与miR-200c的潜在互补结合位点,PCR扩增MAPK8(丝裂原活化蛋白激酶8)基因的3′UTR序列,并成功实现了在psiCHECK2的克隆,成功建立了MAPK8野生型/突变型重组的双荧光素酶报告质粒。接着把野生型psiheck2-MAPK8-3′UTR/突变型psiheck2-MAPK8-mut3′UTR的质粒,与miR-200c mimics/mimics-NC,转染至HEK 293T细胞中,从而通过双荧光素酶的系统,测定双荧光素酶的生物活性。结果 建立了OAN(乏情)和OEN(发情)非繁殖季节绵羊卵巢文库。鉴定出113个差异miRNA,9个为已知miRNA,104个为未知miRNA。在已知miRNA中有6个miRNA显著(P<0.05)上调、3个下调,其中上调倍数最高的为miR-200c。在104个未知的miRNA中,有52个miRNA显著(P<0.05)上调,52个显著(P<0.05)下调。获得候选新miRNA的长度分布主要集中在21~23 nt之间。荧光定量证实,miRNA表达的趋势与测序结果一致。用软件预测到miR-200c的27个靶基因。GO注释发现miR-200c在卵巢组织中介导细胞增殖、迁移、凋亡等过程。KEGG分析表明,miR-200c的靶基因涉及发情相关途径(MAPK信号途径、胰岛素信号通路和GnRH信号途径)以及与卵泡/黄体发育相关的途径,MAPK通路是富集基因最多的通路,共有25个基因被富集。干扰miR-200cmimics,会引起MAPK8基因的Wt型质粒的荧光表达明显减少(P<0.05),而Mut型则没有明显改变。结论 筛选出非繁殖季节发情差异显著(P<0.05)的miRNA有6个。试验研究初步证实了miR-200c与MAPK8的靶向关系,开展了miRNA家族调节绵羊非繁殖季节发情的试验,为深入研究其调控绵羊繁殖及卵泡发育机制提供了试验基础。
关键词:绵羊;卵巢;非繁殖季节发情;miR-200c;MAPK8
中图分类号:中图分类号S813文献标志码:A文献标识码
Screening and preliminary verification of miRNA related to estrus in sheep
during the non-breeding season
XIE Mengting,XIE Yifan,ZHU Mengting,NAN Ying,FANG Chenhui,JIANG Baihui,QI Xingdong,
ZHAO Zongsheng*
(College of Animal Science and Technology, Shihezi University, Shihezi,Xinjiang 832000,China)
Abstract: Objective Screening and identification of microRNAs (miRNAs) in sheep ovaries and studying their regulatory mechanisms laid the foundation for the study of sheep estrus in the non-breeding season.Methods Screening and analysis using Solexa sequencing technology to identify the number and characterisation of differential miRNAs, by real-time fluorescence quantitative PCR, in oestrus and estrus sheep ovaries. Work was also carried out on miR-200c target gene detection, GO annotation and enrichment of the KEGG signalling pathway. The potential complementary binding site of MAPK8-3′-end untranslated region (3′UTR) and miR-200c was successfully found by TargetScan technology and RNAhybrid technology, and the 3′UTR sequence of MAPK8 (mitogen-activated protein kinase 8) gene was PCR amplified and cloning in psiCHECK2 was successfully achieved, and a dual luciferase reporter plasmid for MAPK8 wild-type/mutant recombination was successfully established. The plasmid of wild-type psiheck2-MAPK8-3′UTR/mutant psiheck2-MAPK8-mut3′UTR, with miR-200c mimics/mimics-NC, was then transfected into HEK 293T cells, thereby measuring the biological activity of the dual luciferase by a dual luciferase system. Results A library of OAN (absence) and OEN (estrus) non-breeding season sheep ovaries was established. 113 differential miRNAs were identified, 9 were known miRNAs and 104 were unknown miRNAs. Six of the known miRNAs were significantly (P<0.05) up-regulated and three were down-regulated, with the highest up-regulation fold being miR-200c. Of the 104 unknown miRNAs, 52 were significantly (P<0.05) up-regulated and 52 were significantly (P<0.05) down-regulated. The length distribution of the obtained candidate new miRNAs was mainly concentrated in the range of 21~23 nt. Fluorescence quantification confirmed that the trend of miRNA expression was consistent with the sequencing results. The software was used to predict the 27 target genes of miR-200c. GO annotation revealed that miR-200c mediates cell proliferation, migration, and apoptosis in ovarian tissue. KEGG analysis showed that the target genes of miR-200c were involved in estrus-related pathways (MAPK signalling pathway, insulin signalling pathway and GnRH signalling pathway) and pathways associated with follicular/luteal development, with the MAPK pathway being the most enriched pathway with a total of 25 genes enriched. Interfering with miR-200cmimics caused a significant decrease in fluorescent expression of the Wt-type plasmid of the MAPK8 gene (P<0.05), while the Mut-type was not significantly altered. Conclusion Six miRNAs were screened for significant (P<0.05) differences in non-breeding season estrus. The experimental study initially confirmed the targeting relationship between miR-200c and MAPK8, and carried out experiments on the miRNA family regulating estrus in sheep during the non-breeding season, providing an experimental basis for an in-depth study on its mechanism of regulating reproduction and follicle development in sheep.
Key words: sheep;ovary;non-breeding season estrus;miR-200c;MAPK8
绵羊的生殖功能受到光周期的强烈影响,从乏情到发情的转变通常发生在夏末或初秋,而发情周期在冬末或初春停止[1]。随着繁殖季节开始,绵羊卵巢上卵泡的发育也呈现周期性变化[2]。绵羊的季节性发情直接影响生产效率和经济成本,对养羊业及羊肉的产量有重大的影响[3]。季节性发情是动物繁殖力的关键限制因素,它涉及卵巢生物学和激素分泌在不同季节的变化。因此,对卵巢周期性变化相关机制的研究来提高发情率在养羊业中是非常重要的。
以往的研究表明,miRNAs在卵巢生物学中起着重要的调节作用。为了解miRNA介导的转录后调控在绵羊季节性发情中的作用,利用Solexa测序技术分析了绵羊发情间期和繁殖季节卵巢miRNA表达模式的变化。
MicroRNA(miRNA)是长度为22~24 nt的短RNA序列,通过在转录后水平抑制转录或下调mRNA来调节基因表达,可以由单独的基因编码或嵌入蛋白质编码基因的内含子或外显子区域,然后转录为单基因或多顺反子簇形成茎环二级结构[4]。成熟的miRNA通过与mRNA 3或5UTR的种子序列(7~8 nt)互补碱基对结合,抑制了mRNA的翻译,从而导致了mRNA的降解[5]。miRNA也可以通过增强基因表达,在机体内针对细胞增殖分化、激素分泌和肿瘤细胞迁移等过程进行有针对性的调控[6]。此外,最新研究表明,miRNA对于生殖细胞分化和生殖系统的发育是必不可少的[7]。
近年来大量研究证实卵巢组织富含的多种稳定miRNA可直接调控卵泡发生、排卵、黄体发育、黄体退化、激素分泌等过程[8]。苏倩等[9]发现hsa-miR-200c-3p广泛的参与人类生命活动和疾病过程,与癌症的发生和发展密切相关。研究表明,miR-200c在原始生殖细胞分化过程中表达逐渐降低[10]。丝裂原活化蛋白激酶8(Mitogen-activated protein kinase 8,MAPK8)表达异常,与多种常见肿瘤(如肝癌、口腔癌等)的发生发展密切相关[11-12]。Wang等[13]在研究抑制MAPK8后,生殖相关基因的表达受到明显抑制,MAPK8的敲除/过表达可以通过抑制/激活JNK信号影响胚胎干细胞(Embryonic stem cell,ESC)的分化。Nan等[14]研究发现,miR-200c的表达,明显地减少了卵巢颗粒细胞中,MAPK8的表达量,但同时也间接调控了其他与卵泡成熟相关基因的过表达,从而更有效地控制了卵泡成熟。Cheng等[15]研究结果表明Mapk8基因能提高卵母细胞的成熟。
本试验在乏情季节中,利用Solexa的检测方法,研究了发情及不发情绵羊卵巢中,miRNA家族的表达量。通过筛选绵羊卵巢中的关键差异miRNA、GO注释、KEGG信号通路分析等,注释到了MAPK通路等关键通路,通过使用预测程序,检测到了miR-200c的靶基因MAPK8基因,通过双荧光素酶报告系统验证miR-200c和MAPK8之间的互相作用,对于明确卵巢中差异miRNA家族,以及调控绵羊季节性繁殖的分子机理,都有着重要意义。
1 材料与方法
1.1 材料
1.1.1 试验动物及样品采集
于非繁殖季节(5—6月)在石河子大学动物实验站选择年龄2~3岁、体重相近、健康状况良好的经产哈萨克母羊。
每日08∶30和16∶00进行公羊试情,将公羊引入绵羊圈中,监测发情率。发情特征:绵羊首次接受公羊爬跨、阴道泛红和生殖器肿胀。选择3只处于发情后期的绵羊,人工宰杀采集卵巢。同时选3只未发情绵羊,屠宰收集卵巢。卵巢样本立即冷冻在液氮中,分别提取总RNA。
1.1.2 主要试剂及仪器
Trizol購自赛默飞公司,Agilent BioAnalyzer 2100购自美国Agilent公司,NotI和XhoI及Lipofectamine 2000购自美国Thermo Fisher Scientific公司,连接酶T4、miRcute miRNA荧光定量试剂盒均购自上海TIANGEN生物有限公司,HEK 293T细胞购自Shanghai Cell Bank,大肠杆菌DH5α购自Sangon Biotech公司,质粒psiCHECK2购自Promega公司,Opti-MEM购自Gibco Life Technologies公司,miR-200c mimics及相应的阴性对照物内参mimics-NC购自Ribobio公司。
实时荧光定量PCR仪(Roche LightCycler 96)购自Roche公司;紫外分光光度计购自NanoDrop公司;酶标仪购自美国Tecan公司;凝胶成像系统购自上海培清科技有限公司。
1.2 方法
1.2.1 总RNA提取
先提取绵羊卵巢总RNA,并进行琼脂糖凝胶电泳,以检测其完整性。再利用Nanodrop ND-2000分析仪,测定绵羊卵巢RNA的浓度、D260和D280 nm值。最后,使用Agilent BioAnalyzer 2100,对样品进行质量检测。
1.2.2 高通量测序及文库构建
使用6个经过合格检测的绵羊卵巢样品,进行miRNA文库构建和高通量测序,该过程由中国北京基因组研究所完成。通过聚丙烯酰胺凝胶电泳法(PAGE),从绵羊卵巢RNA中分离出15~30 nt RNA,并将其进行纯化,最后将其连接到3′和5′接头上,以获得更准确的结果。经纯化后送进行Illumina Solexa测序,使用HiSeq2000平台测序构建OAN和OEN文库。每个样品需要使用3 μg的总RNA。第一步,利用SRNA的特殊构造,在SRNA的3′和5′末端添加剪接。第二步,再以总RNA作为模板,进行反转录,得到目标cDNA。第三步,再利用PCR扩增技术和PAGE凝胶电泳技术,分离出目标DNA片段,并通过凝胶切除方法,来建立cDNA文库。最后一步,在得到有效浓度和目标数据数量后,将不同样品的Raw Data合并,用于下一步的RNA-Seq分析。
1.2.3 测序数据的生物信息学分析
原始数据移除重复序列、rRNA、scRNA、snoRNA、snRNA和tRNA等,然后对得到的miRNA进行分类、注释。miRNA与miRNA前体完全匹配或与miRBase 21.0中的成熟miRNA一致,且至少有16个核苷酸重叠的RNA分子就是新的miRNA。利用预测软件mireap(适用于动物和植物)和mirDeep(适用于动物),就能够预测未经注释过的新miRNA家族的,二级结构、DICER裂解位点和最小自由能,以便寻找在外显子、内含子或基因间隔区中,都不能与基因组匹配的,新发现的miRNA。绘制已知和未知miRNA的log2(倍数变化)散点图,来确定差异表达的miRNA。
1.2.4 实时荧光定量PCR验证
在miRNA文库中,选择前6个差异显著(P<0.05)的miRNA,通过反转录合成cDNA并进RT-PCR。miRNA扩增及内参引物由海基生物科技公司设计合成(表1)。
20 μL体系,含2× miRcute miRNA Premix SYBR 10 μL、上下游引物各0.4 μL、ddH2O 8.2 μL和1 μL (500 ng·μL-1) cDNA。扩增程序:94 ℃ 2 min;40个循环,每个循环94 ℃ 20 s和60 ℃ 34 s。
1.2.5 靶基因预测及功能分析
利用Ensembl网站的BioMart对靶基因进行GO功能注释,获取靶基因的GO Term Accession,并利用BGI WEGO系统对其GO注释结果进行可视化。使用KEGG(http://www.genome.jp/kegg/)进行靶基因注释,误差≤0.05表示显着富集。使用TargetScan和RNAhybrid预测miRNA靶基因,利用R的merge函数合并两种预测方法的结果,获取交集。通过miRBase 21.0和NCBI获得miR-200c参考序列和绵羊MAPK8基因3′UTR序列,并使用TargetScan对它们的结合位点进行预测(图1)。
1.2.6 构建野生型/突变型MAPK8基因双荧光素酶报告质粒
利用Primer 6.0,设计MAPK8-3′UTR区,在扩增引物中,还包括miR-200c的结合位点(表2)。
以试验绵羊卵巢cDNA为模板,设计合成了MAPK8-3′UTR序列片段,PCR扩增体系为25 μL:95℃ 5 min;95℃ 30 s;56℃ 30 s;72℃ 30 s;35个循环;72 ℃ 5 min。采用百分之一凝胶电泳,检测与纯化。使用XhoI和NotI双酶切,利用T4连接酶连接PCR胶回收产物和psiCHECK2载体,构建野生型psiCHECK2-3′UTR载体(psiCHECK2-MAPK8-wt3′UTR)和突变型psiCHECK2-MAPK8-3′UTR载体(psiCHECK2-MAPK8-mut3′UTR)。将重组质粒转染到100 μL感受态大肠杆菌DH5α细胞中。在涂板中挑出5个阳性菌落,以1 μL发、大肠杆菌菌液PCR技术扩增,并结合百分之一点五凝胶电泳鉴别产物,再筛选为阳性的克隆质粒,并送至上海锐赛生物有限公司进行检测。
1.2.7 细胞转染及双荧光素酶报告系统测定
先将对数生长的HEK 293T细胞,以每孔1.5×104个细胞,播种在24孔板中,并于37℃ 5% CO2培养箱中培养,直到细胞密度达到八九成,再进行转染试验。取2.5 μL miR-200c模拟物,或用上述miR-200c NC,与1 μL psiCHECK-MAPK8-3′UTR野生型/突变型质粒混匀,然后根据不同组别,在约60 μL无血清Opti-MEM培养基中,稀释后室温孵育5 min。每组取2 μL Lipofectamine 2000,与50 μL无血清的,Opti-MEM培养基混合,室温培养5 min。取50 μL无血清Opti-MEM培养基,颠倒混合均匀,室温培养5 min。滴加Lipofectamine 2000 DNA稀释液,混合均匀,静置20 min,缓慢滴加到细胞表面,37℃ 5% CO2培养6 h,继续培养48 h。加入50μl LARII,摇晃后混合均匀。Dual-Reporter Assay System多功能酶标仪,检测萤火虫荧光酶的荧光数值。每孔内加入50 μL Stop&Glo试剂,摇动后混合,3 min后,用酶标仪检测海肾荧光酶荧光值。
1.3 统计分析
利用SPSS19.0和GraphPad Prism 9进行处理和分析结果。采用2-ΔΔct法来表示miRNA的相对表达量,并将其与P<0.05相比较,以确定其统计学意义;根据测序结果,當Fold-Change<1,P<0.01时,可以确定存在显著的下调miRNA;而当Fold-Change>1,P<0.05时,则可以确定存在显著的上调miRNA。
数据统计后,采用平均数±标准差表示,采用GraphPad Prism 9和SPSS19.0进行数据结果处理分析;miRNA的相对表达量用2-ΔΔct法表示,以P<0.05为差异有统计学意义。差异表达显著miRNA:测序结果中差异表达倍数Fold-Change<1,P<0.01,为已知或新增的下调miRNA;测序结果中Fold-Change>1,P<0.05,为已知或新增的上调miRNA。
2 结果
2.1 高通量测序及miRNA文库构建
本研究利用6个哈萨克母羊卵巢样本,成功构建了两个文库,分别是OAN和OEN文库。Unique reads去除接头、低质量、污染序列后OEN和OAN分别获得了8 665 978及9 071 102个 clean reads。候选新miRNA长度分布主要集中在21~23 nt之间,OAN 22 nt读数的百分比为54.60%,OEN为53.50%(图2),新miRNA前体都具有典型的颈环结构(图3)。
通过与Rfam数据库14.1重复相关RNA、外显子和内含子相关RNA,对miRBase 21.0中的非编码sRNA进行比对,并去除其中的rRNA、snRNA、snoRNA、tRNA和scRNA。对各类sRNA在Rfam数据库的种类和总数进行比对,表明两个文库大多数sRNA序列都为miRNA。除了高度保守的miRNA序列外,其他非编码sRNAs的表达较少但可变序列较多(如scRNAs、srpRNAs、和其他sRNAs),显示了Solexa测序的效率。Scatter plot图显示,OAN和OEN文库中,共检测到113个miRNA,其中9个为已知miRNA(6个miRNA上调、3个下调),104个为未知miRNA(52个miRNA上调、52个下调)(图4,图5)。
差异表达显著(P<0.05)的前6个miRNA如表3所示,其中差异倍数最高的为miR-200c且仅在乏情绵羊卵巢中差异表达。其余表达丰富的miRNA有miR-20a、miR-133、miR-181a等。
2.2 测序结果的验证
RT-qPCR结果显示,miR-200c表达量差异极显著(P<0.01),同时miR-200b和novel-miR-101的表达水平也达到了显著水平(P<0.05)。另外,统计表明,miRNA的相对荧光表达量变化,与之前的Solexa测序结果相同,由此证明了miRNA高通量测序的可靠性(图6)。
2.3 预测靶基因、注释GO信息和分析KEGG通路
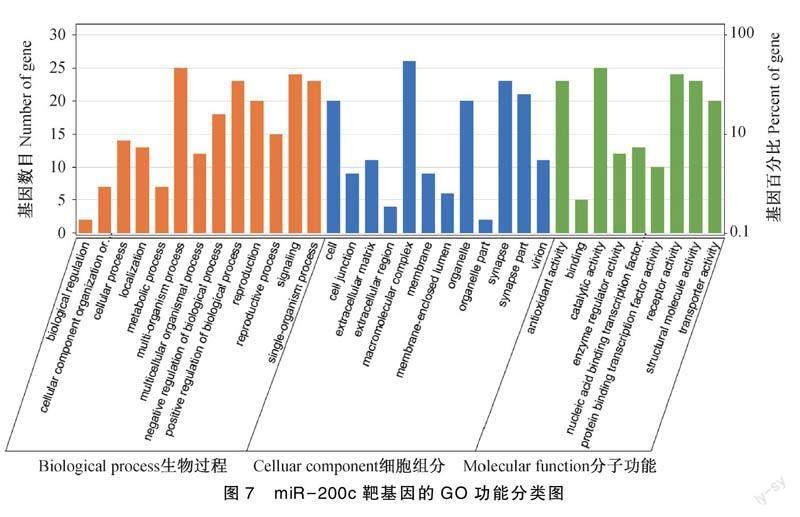
根据已有数据,共获得了6个miRNA的靶基因,分别是miR-200a、miR-200b、miR-200c、miR-10a、novel-miR-101和miR-148a。预测到的靶基因个数分别为:115、87、27、75、147和31个。对下调的miRNA miR-200c的靶基因进行GO和KEGG分析。经过GO分析和富集后,主要涉及繁殖活动、代谢过程、生物调节、细胞过程等过程。
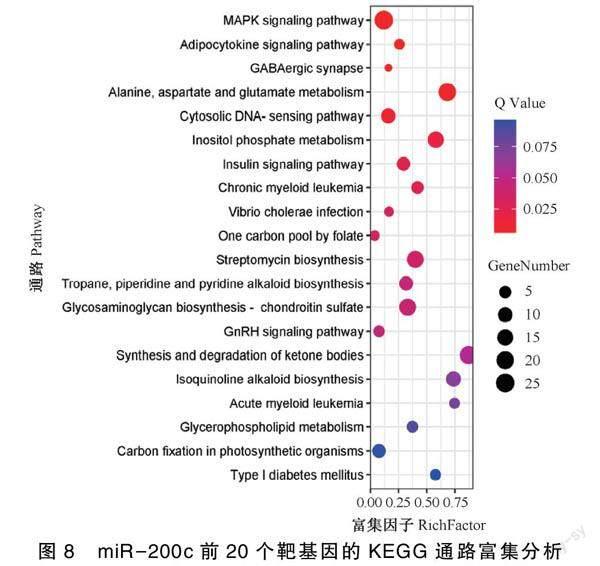
图7表明,GO分析发现富集的包括繁殖活动、代谢过程、生物调节、细胞过程等。在生物过程方面,单组织——占87.18%、生物正向调节——占80.19%、多细胞生物——占83.88%;细胞组分分类中,与细胞相关的条目占——63.55%,细胞突触占——72.92%、大分子化合物——占82.57%;分子功能方面,催化活性占——79.27%、抗氧化活性占——72.92%、受体活性——占76.22%。同时有63.55%和72.89%的靶基因参与了繁殖和生殖过程这些基因为:MAPK8、PAK2、SLC26A2、IGFBP1和DARS等。miR-200c共预测到27个靶基因。KEGG结果如图8所示:富集到的靶基因与细胞信号转导、代谢物、疾病有关。研究结果显示,靶基因所注释的通路数量为34个,靶基因在多个重要通路中发挥关键作用,MAPK信号通路(MAPK signaling pathway,ID:ko04010)——占12.95%,胰岛素信号通路(Insulin signaling pathway,ID: ko00564)——占10.88%,酮体的合成和降解通路占——10.36%。MAPK信号通路、甘油磷脂代谢信号通路(Glycerophospholipid metabolism,ID:ko04630)、GnRH信号通路(GnRH signaling pathway,ID:ko04912)、胰岛素信号通路等与卵巢细胞的分裂、增殖等过程有关。MAPK通路共富集了25个靶基因,为基因富集最多的通路。
2.4 野生型/突变型的psiCHECK2载体构建与鉴定
利用已提取的miR-200c靶向序列,通过选择目标引物,并扩增MAPK8基因,检测PCR产物序列,与预期设计相符,从而筛选出具有高特异性的目的基因,将该基因插入至psiCHECK2载体中,进而利用菌液PCR检测阳性菌。试验结果表明,PCR产物大小为548 bp,与预期设计产物大小一致。(图9)。
2.5 miR-200c对MAPK8表达的影响
按照分组(mimics+Wt、mimics+Mut、mimics+Wt NC+psiCHECK2、mimics+Mut NC+psiCHECK2),将mimics转染至293T细胞,检测荧光值。结果显示,mimics+Wt组的质粒荧光显著(P<0.05)低于mimics+Wt NC+psiCHECK2组。说明miR-200c和MAPK8 3UTR存在靶向关系(图10)。
3 討论
3.1 高通量测序及候选miRNA预测
高通量测序技术目前广泛用于动物miRNA组学研究。利用高通量测序,可以发现新miRNA,也可以鉴别已知的miRNA。本试验使用了对哈萨克母羊卵巢组织,2种不同阶段miRNA的表达情况,丰富了绵羊miRNA数据库的资源。OAN和OEN共鉴定出113个差异miRNA,其中9个为已知miRNA,104个为未知miRNA,在9个已知的miRNA中有6个miRNA显著(P<0.05)上调、3个下调。统计数据显示,104个候选miRNA序列的长度,都在21-23 nt的范围内。这个范围与哺乳动物成熟miRNA的典型长度范围相符,这一结论也得到了之前研究的支持[6]。因此,这些候选miRNA序列的长度特征,符合哺乳动物miRNA的一般规律。候选miRNA具有成熟miRNA的典型结构特征。绵羊卵巢miRNA荧光定量结果与测序结果一致,进一步证实了测序数据可靠。常卫华等[16]研究了单一性别羔羊的绵羊卵巢miRNA表达,预测到104条候选新miRNA,且sRNA主要集中在22、23及24 nt上。综上所述,不同物种筛选的miRNA类型和数量,可能因物种、品系、组织及发育阶段不同而异。
3.2 miRNA在生殖过程中的作用
绵羊卵巢中不同数量的miRNA可直接或间接调节发情行为,使绵羊在发情末期开始发情。非繁殖季节发情中表达量最多的miRNA为miR-10a、novel-miR-101、miR-148a、miR-200c等。这些结果提示miR-200家族可能参与了卵泡期颗粒细胞增殖的抑制。在绵羊繁殖季节,卵巢处于发情周期,包括卵泡期和黄体期,颗粒细胞miR-200水平可能较高。但在发情期,卵巢的生理活性相对降低,不存在卵泡期。因此,颗粒细胞的增殖明显减弱。除此之外一些表达丰富的miRNA如miR-20a、miR-133、miR-181a在牛、猪[17]、绵羊[18]的卵巢内表达也是非常丰富的。miR-20a通过抑制BMPR2表达,并加速卵丘细胞黄体酮合成,从而调控卵母细胞成熟[19]。miR-181a过表达下调Smad3的磷酸化并阻断TGF-β信号的激活miR-181a的表达上调TGFBR1和p-Smad3蛋白水平来调节猪卵巢颗粒细胞凋亡[17]。林嘉鹏等[20]利用双荧光素酶报告基因系统,发现miR-21与PIK3RI基因的3′UTR区域特异性结合,转染miR-21至绵羊卵巢颗粒细胞后,细胞增殖得到促进,同时PIK3R1的mRNA、蛋白质表达显著降低(P<0.05)。本研究表明,发情和乏情卵巢差异表达的miRNA(miR-200a、miR-200b、miR-200c)均属于miR-200家族。先前的文献中,对miR-200家族功能的研究主要集中在癌症方向[21],其对动物繁殖、发情、及卵巢发育方面的研究较少。研究表明miR-200s对于GnRH转换启动成年生育是必不可少的,研究敲除miR-200家族可导致雌性斑马鱼不育[22]。还有研究表明miR-200s通过调节垂体-性腺轴来促进卵母细胞的成熟和卵子排出[23]。实验室的前期研究也证明,miR-200a/b/c在下丘脑、垂体、子宫、卵巢和输卵管中的表达有所不同。此外,由于miR-200b对GNAQ基因的干扰效应,对绵羊发情调控机理也,产生了一定的影响[16]。
3.3 miR-200c-MAPK8与绵羊繁殖的关系
本试验结果显示,通过干扰miR-200c mimics,能另MAPK8基因Wt型质粒的,荧光作用受到miR-200c的调控,表达量显著下降(P<0.05),表明miR-200c对动物发情的调控机制,其中包括MAPK8基因的调控。段新崇等[24]的试验结果表明,oar-miR-200c、oar-miR-200b和oar-miR-200a,在小尾寒羊间情期和发情期,miRNA表达量,具有顯著差异(P<0.05),这也与本试验的研究结果相一致。本研究发现miR-200c下调倍数最高,且仅在乏情绵羊卵巢中差异表达,这些结果提示miR-n-145可能参与了卵泡期颗粒细胞增殖的抑制。使用TargetScan和RNAhybrid软件预测找到了miR-200c在卵巢组织中的27个靶点基因。GO注释发现miR-200c的靶基因有63.55%和72.89%的靶基因参与了卵巢组织中的繁殖和生殖过程,如MAPK8、PAK2、SLC26A2、IGFBP1和DARS等。KEGG信号通路富集表明这些靶基因在不同的通路中对卵巢活动起着调控作用。其中富集基因最多的通路为MAPK通路(12.95%),分析发现MAPK通路调节生物机体的生长、发育及细胞分化等相关生理过程。据郭永娟等[25]的研究,激活了MAPK通路后,会导致生发卵泡破裂(GVBD)和组蛋白Hl激酶的活化,进而刺激卵母细胞进行减数分裂,同样表明了MAPK通路在动物繁殖中的作用。卵泡发育的另一个重要途径是MAPK信号通路,miR-n-783、miR-n-791和miR-n-77的靶基因在该通路中得很丰富。MAPK通路的激活可以促进瘦素刺激的卵母细胞成熟,反之,当瘦素诱导的MAPK磷酸化被特定的MAPK激活抑制剂抑制时,成熟可以被阻断。此外,孕酮介导的卵母细胞成熟途径与卵母细胞的成熟有关,在该途径中,OAR-miR-200a-3p的靶基因很丰富。
分析发现在所有的把基因中,富集到通路最多的基因为MAPK8基因。MAPK8基因在GNAQ基因的下游,显著(P<0.05)地富集在催产素信号、卵巢类固醇合成和促性腺激素释放激素通路。姚晓磊等[26]的研究结果指出,相对于牛的次级卵泡,MAPK8是优势卵泡的下调基因,通过影响颗粒细胞当中,相关转录因子的数量,来调控基因的表达。Nan等[14]的试验结果表明,miR-200c过表达后,PRKCB和MAPK8基因的表达显著下调,MAPK8的下调导致GnRH合成途径和Wnt信号通路中对卵泡发育相关基因的表达起到反馈和调控作用,由此推测MAPK8是促进卵泡发育的重要基因。进一步分析发现miR-200c-MAPK8参与MAPK通路中靶基因的富集,可作为绵羊非繁殖季节发情关键miRNA-mRNA靶基因对。通过靶基因预测软件分析发现miR-200c可能调控MAPK8基因的表达,双荧光素酶报告系统检测进一步验证表明:miR-200c能明显抑制MAPK8基因3′UTR荧光素酶活性。这为进一步研究miR-200c-MAPK8在绵羊非繁殖期发情中的作用及其功能验证提供了试验基础。
4 结论
本试验成功建立了非繁殖季节发情&乏情绵羊卵巢miRNA文库。生物信息学分析发现共有113个miRNA差异表达,其中有9个已知miRNA和104个未知的miRNA;在筛选的表达量较高且差异显著(P<0.05)的miRNA中,miR-200c下调倍数最高且仅在乏情绵羊卵巢中差异表达;试验初步证实了miR-200c能使靶基因MAPK8表达下调,具体调控机制还需进一步研究。
参考文献(References)
[1]GREIVES T J, MASON A O, SCOTTI MELISSA-ANN L, et al. Environmental control of kisspeptin: implications for seasonal reproduction[J]. Endocrinology, 2007, 148(3): 1158-1166.
[2]CAHILL L P, OLDHAM C M, COGNIE Y, et al. Season and photoperiod effects on follicles and atresia in the sheep ovary[J]. Australian Journal of Biological Sciences, 1984, 37(2): 71-78.
[3]NETT T M,NISWENDER G D. Influence of exogenous melatonin on seasonality of reproduction in sheep-ScienceDirect[J]. Theriogenology, 1982, 17(6): 645-653.
[4]BARTEL D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297.
[5]刘世伟. MicroRNA-186-5p对髓核细胞外基质退变机制的研究[D]. 天津:天津医科大学, 2020.
[6]NAM E J, YOON H, KIM S W, et al. MicroRNA expression profiles in serous ovarian carcinoma[J]. Clin Cancer Res, 2008, 14(9): 2690-2695.
[7]ZOU Y X, WU Z H, FAN Z F, et al. Analyses of mRNA-seq and miRNA-seq of the brain reveal the sex differences of gene expression and regulation before and during gonadal differentiation in 17β-estradiol or 17α-methyltestosterone-induced olive flounder (Paralichthys olivaceus)[J]. Molecular Reproduction and Development, 2020, 87(1): 78-90.
[8]TESFAYE D,WORKU D,RINGS F,et al. Identification and expression profiling of microRNAs during bovine oocyte maturation using heterologous approach[J]. Molecular Reproduction & Development, 2010, 76(7): 665-677.
[9]苏倩, 郑宏, 王娟, 等. hsa-miR-200c-3p的靶基因预测及生物信息学分析[J]. 医学理论与实践,2022,35(24):4148-4152.
SU Q, ZHENG H, WANG J, et al. Target gene prediction and bioinformatics analysis of hsa-miR-200c-3p[J].Medical Theory and Practice,2022, 35(24): 4148-4152.
[10]HAYASHI K, LOPES SMCDS, KANEDA M, et al. MicroRNA Biogenesis Is Required for Mouse Primordial Germ Cell Development and Spermatogenesis[J]. PLoS ONE, 2008, 3(3): e1738 .
[11]崔宇平, 馬洪, 段晓峰. 口腔鳞状细胞癌中MAPK8基因的表达及意义[J]. 实用口腔医学杂志,2019,35(1):105-108.
CUI Y P, MA H, DUAN X F. Expression and significance of MAPK8 gene in oral squamous cell carcinoma[J]. Journal of Practical Stomatology, 2019, 35(1): 105-108.
[12]万智双, 熊丁, 曹宸. miR-433-3p靶向MAPK8对肝癌细胞MHCC97H增殖、凋亡和迁移的调控作用[J]. 中国免疫学杂志,2020,36(1):57-62.
WAN Z S, XIONG D, CAO C. Regulating effect of miR-433-3p targeting MAPK8 on proliferation, apoptosis and migration of hepatocellular carcinoma cell MHCC97H[J]. Chinese Journal of Immunology, 2020, 36(1): 57-62.
[13]WANG Y, BI Y, ZUO Q, et al. MAPK8 regulates chicken male germ cell differentiation through JNK signaling pathway[J]. Journal of cellular biochemistry, 2018, 119(2): 1548-1557.
[14]NAN Y, XIE Y F, ZHU M,et al. MicroRNA-200c mediates the mechanism of MAPK8 gene regulating follicular development in sheep[1][J]. KAFKAS NVERSTES VETERNER FAKLTES DERGS, 2021, 27(3): 279-284.
[15]CHENG H, SUN X, CHEN F, et al. Meiotic arrest with roscovitine and sexual maturity improve competence of mouse oocytes by regulating expression of competence-related genes[J]. The Journal of Reproduction and Development, 2021, 67(2): 115-122.
[16]常卫华, 王娟红, 崔子龙. 萨能奶山羊胎儿成纤维细胞miRNA文库的构建及生物信息学分析[J]. 中国畜牧兽医,2020,47(11):3436-3444.
CHANG W H, WANG J H, CUI Z L. Construction and bioinformatics analysis of miRNAs library of fetal fibroblasts in Saneng dairy goat[J]. China Animal Husbandry and Veterinary Medicine, 2020, 47(11): 3436-3444.
[17]ZHANG J Q, GAO B W, GUO H X, et al. miR-181a promotes porcine granulosa cell apoptosis by targeting TGFBR1 via the activin signaling pathway[J]. Mol Cell Endocrinol, 2020, 499: 110603.
[18]XIA J, LIU D, ZHOU W, et al. Comparative transcriptome analysis of brain and gonad reveals reproduction-related miRNAs in the giant prawn, Macrobrachium rosenbergii[J]. Front Genet, 2022, 13: 990677.
[19]GUO L, HUANG Q, ZHAO J, et al. microRNA-10b promotes the apoptosis of bovine ovarian granulosa cells by targeting plasminogen activator inhibitor-1[J]. Theriogenology, 2021, 176: 206-216.
[20]林嘉鹏. 绵羊卵巢颗粒细胞miRNA的鉴定和功能研究[D].石河子:石河子大学, 2019.
[21]FISCHER CHIARA, DEUTSCH THOMAS M., FEISST MANUEL, et al. Circulating miR-200 family as predictive markers during systemic therapy of metastatic breast cancer[J]. Archives of Gynecology and Obstetrics, 2022, 306(3): 875-885.
[22]熊舒婷. miR-200家族在斑马鱼生殖发育中的功能研究[D]. 武汉:华中农业大学, 2018.
[23]XIONG S, TIAN J, GE S, et al. The microRNA-200 cluster on chromosome 23 is required for oocyte maturation and ovulation in zebrafish[J]. Biology of Reproduction, 2020, (4): 4.
[24]段新崇, 魏彥辉, 李阳, 等. 小尾寒羊间情期和发情期microRNAs差异表达分析[J]. 畜牧兽医学报,2016,47(7):1324-1332.DUAN X C, WEI Y H, LI Y, et al. Differential expression analysis of microRNAs between estrus and estrus in small-tailed cold sheep[J]. Acta Veterinariaet Zootechnica Sinica, 2016, 47(7): 1324-1332.
[25]郭永娟, 郑亚琳, 张彩霞, 等. MAPK信号通路在动物繁殖中的研究进展[J]. 中国畜牧兽医,2015,42(5):1268-1273.
GUO Y J, ZHENG Y L, ZHANG C X, et al. Research progress of MAPK signaling pathway in animal reproduction[J]. China Animal Husbandry and Veterinary Medicine, 2015, 42(5): 1268-1273.
[26]姚晓磊, 李鹏飞, 姜晓龙, 等. 卵泡发育相关基因在牛优势和从属卵泡颗粒细胞中表达的研究[J]. 畜牧兽医学报,2014,45(12):1957-1963.
YAO X L, LI P F, JIANG X L, et al. Expression of follicular development-related genes in bovine dominant and dependent follicular granula cells[J]. Acta Veterinariaet Zootechnica Sinica, 2014, 45(12): 1957-1963.
(责任编辑:编辑唐慧)
收稿日期:中文收稿日期2023-02-05
基金项目:国家自然科学基金项目(32160770)
作者简介:谢梦婷(1997—),女,硕士研究生,专业方向为动物遗传育种与繁殖研究。
*通信作者:赵宗胜(1969—),男,教授,博士生导师,从事动物遗传育种与繁殖研究,e-mail:zhaozongsh@shzu.edu.cn。

