早期腹腔穿刺引流术对重症急性胰腺炎患者氧化应激指标、炎性因子及并发症的影响
张利丹,田伟华,张宏伟
急性胰腺炎(AP)是以全身炎症反应综合征为典型发病特征的急腹症,随病情进展,AP患者会逐步出现多器官功能衰竭症状[1]。相关研究[2]显示,轻度AP患者的病死率在2%左右,而重症急性胰腺炎(SAP)的死亡率可高达30%。胰腺炎相关腹水(PAAF)为SAP患者的常见并发症,可加快SAP患者的疾病进展[3]。针对合并PAAF的SAP,临床多以腹腔穿刺引流术(APD)为主要治疗措施,通过超声或CT定位病灶并实施穿刺引流可一定程度上缓解胰腺组织内压,并预防多器官功能衰竭、降低病死风险。目前认为,急性胰腺炎患者发病2周内不适合手术,对于发病72 h内有严重多器官衰竭且伴腹内压明显升高者,则应尽早进行穿刺引流以排空PAAF,目前关于ADP手术时间窗仍存在一定争议[4]。本研究主要探讨早期实施APD对改善SAP氧化应激反应及预后情况的影响,并分析其治疗机制。
1 资料与方法
1.1 一般资料 本文前瞻性选取2021年1月—2022年6月平顶山市第二人民医院接受APD治疗的120例SAP患者为研究对象,将其中60例发病至入院时间<72 h的患者列为早期组,将其余60例发病至入院时间≥72 h的患者列为对照组,早期组中男35例,女25例;年龄38~62(50.44±5.17)岁;其中22例合并高血脂、25例合并高血压、13例合并糖尿病。对照组中男40例,女20例;年龄35~65(51.25±5.132)岁;其中25例合并高血脂、23例合并高血压、12例合并糖尿病,2组患者一般资料比较,差异无统计学意义(P>0.05)。本研究已获得我院医学伦理委员会批准(PDQ12)。
1.2 入选标准 纳入标准:(1)入组患者均符合AP诊断要点[5],经临床评估确认为重症患者,均转入ICU接受治疗;(2)符合APD治疗指征[6]且自愿接受此手术治疗;(3)均已知悉此次研究试验目的及内容,同意且自愿参与研究。排除标准:(1)有严重血液系统疾病或免疫功能障碍者;(2)有其他感染性症状;(3)出现休克或意识昏迷者;(4)有精神、认知障碍性疾病者;(5)恶性肿瘤者。
1.3 方法 2组患者均术前常规治疗后接受APD手术治疗,对照组均在发病72 h后实施手术,早期组均在发病72 h以内实施手术。(1)术前常规治疗如下:入院后统一予以禁食、禁水,连接吸氧装置后予以针对性胃肠减压、抑酸、纠正水电解质紊乱及酸碱失衡;常规实施中心静脉穿刺后,将500 mL浓度为0.9%的生理盐水加入至OC-200(A)型一次性血液灌流器(四川成都,成都欧赛医疗器械有限公司,国械注准20193100567)中进行HP治疗,HP治疗速率为100~250 mL/min,2小时/次。(2)APD手术步骤如下:①嘱患者取仰卧位,连接心电监护设备及脑电双频指数以监测术中体征、调节麻醉深度,所有患者予以常规麻醉进行镇痛、镇静处理,待麻醉起效后开始手术;②应用腹部CT明确病灶位置,于胰腺坏死组织积聚处做好标记,将穿刺针角度、方向调整至最佳后实施穿刺,并将引流管顺势推进至腹腔积液最深位置;③待引流管位置调整满意后使用双针固定导管,吸出组织内脓液和坏死部分后经气孔向组织内注入浓度为0.9%的生理盐水对胰腺组织进行反复冲洗,并连接引流袋进行液体引流,待患者体征、症状恢复,影像学表现改善且每日引流量<20 mL、引流液体由混浊变为清亮时即可拔除引流装置。
1.4 观察指标 (1)氧化应激指标。术前24 h、术后7 d分别采集外周静脉血作抗凝处理后,按转速3 000 r/min,半径10 cm离心5 min后,经血清样本检测并评估2组患者的氧化应激反应改善情况,检测设备为美国BECKMANCOULTER公司提供的AU5800型全自动生化分析仪,检测方法为酶免法(ELISA),评估指标包括超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、丙二醛(MDA)。(2)炎症反应指标。术前24 h、术后7 d分别评估2组患者的炎症反应改善情况,检测样本、设备、方法同上,评估指标包括肿瘤坏死因子-α(TNF-α)、白细胞介素-4(IL-4)、IL-10。(3)内源性抗氧化因子。术前24 h、术后7 d内分别评估2组患者的内源性抗氧化因子表达情况,采用全蛋白、核蛋白试剂盒从胰腺组织中分别提取冻存组织及新鲜组织,通过Bradford法检测不同蛋白浓度;经电泳后进行转膜封闭,并将蛋白组织进行孵育后应用发光成像仪检测核蛋白、全蛋白表达情况,核蛋白为核因子E2相关因子(Nrf-2),内参物为抗增殖细胞核抗原抗体,全蛋白为血红素氧合酶-1(HO-1),内参物为β-肌动蛋白抗体。(4)手术相关并发症。随访期间,统计并比较2组患者的手术相关并发症发生情况,包括假性囊肿、胃肠功能障碍、继发感染、胰性脑病,短期随访时间为术后6个月。

2 结果
2.1 2组患者治疗前后氧化应激指标比较 术前24 h,2组患者的氧化应激指标比较差异无统计学意义(P>0.05);术后7 d,早期组SOD、GSH均高于对照组,MDA低于对照组,差异有统计学意义(P<0.05)。见表1。

表1 2组患者治疗前后氧化应激指标比较
2.2 2组患者治疗前后炎症因子水平比较 术前24 h,2组患者的炎症指标比较差异无统计学意义(P>0.05);术后7 d,早期组TNF-α水平低于对照组,IL-4、IL-10水平均高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 2组患者治疗前后炎症指标比较
2.3 2组患者治疗前后内源性抗氧化因子表达情况比较 术前24 h,2组患者的内源性抗氧化因子表达水平比较差异无统计学意义(P>0.05);术后7 d,早期组Nrf-2阳性表达率、HO-1水平均高于对照组,差异有统计学意义(P<0.05)。见表3。

表3 2组患者治疗前后内源性抗氧化因子表达情况比较
2.4 2组患者并发症发生率比较 在不同时期实施APD手术治疗后,随访期间,早期组的术后并发症发生率低于对照组,差异有统计学意义(P<0.05)。见表4。
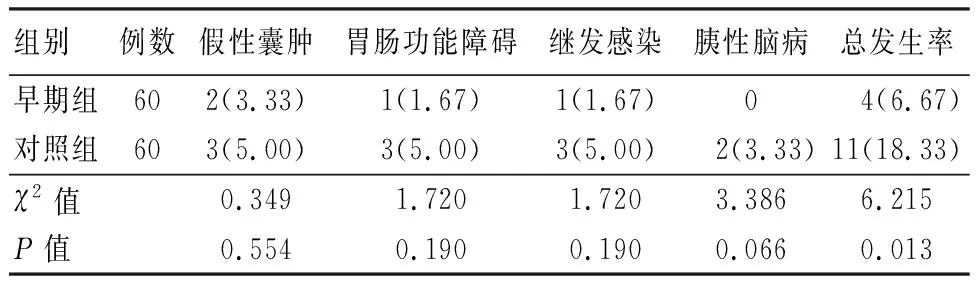
表4 2组患者并发症发生率比较
3 讨论
SAP是一种以高发病率、高病死率为主要特征的急腹症,研究[7]指出,与炎症相关的免疫病理反应对SAP患者病情进展有重要影响,炎症反应加剧、免疫功能下降可使胰蛋白酶原被异常激活,受损的腺泡细胞则会迅速启动炎症瀑布,并引发全身炎症反应综合征。对于合并PAAF的SAP患者来说,其胰腺组织内的腹水可对免疫系统中巨噬细胞的微环境产生直接影响,对此类患者实施APD可促使腹水持续排出,进而产生抗炎作用[8]。既往研究[9]表明,胰蛋白酶异常活化、累积以及自噬功能受损的自噬细胞堆积,导致腺泡细胞空泡化为AP的主要病理反应,也是导致患者病情进展为SAP的重要原因[10]。此前有学者[11]表示,APD手术对SAP患者的抗炎机制在于对患者肠道菌群的调节,该学者通过对比患者前后的肠道菌群数目变化情况证实了此论点。但也有研究[12]表明,氧化应激被认为是自噬细胞损失的重要中介因素,实施APD手术治疗可有效抑制机体抗氧化应激反应并改善巨噬细胞的吞噬功能,从而抑制炎症反应。
既往临床认为,急性胰腺炎患者发病2周内均不适宜接受相关手术治疗,但对发病后72 h已出现严重多器官衰竭且因PAAF导致腹腔压力升高者,则应尽快予以APD手术治疗。本研究结果显示,发病72 h内实施APD早期组术后7d的SOD、GSH水平均高于对照组,MDA水平低于对照组,提示在发病后72 h内早期实施APD对减轻患者氧化应激反应有积极作用,考虑原因如下:急性胰腺炎患者发病后因出现PAAF而发生不同程度氧化应激反应,若未及时进行干预,随病情加重,患者可能因腹腔压力过高而引发多器官功能障碍甚至衰竭,在确认符合手术指征基础上尽早实施APD治疗,能更快排出PAAF并缓解腹腔压力、减轻应激反应。氧化应激为机体自动防御机制,与炎症反应的发生及病情进展均有密切关联。早期实施APD排出PAAF并缓解氧化应激反应后,亦可上调T细胞分泌的IL-4、IL-10等抗炎因子、下调关键促炎因子TNF-α的表达[13]。故本研究中,早期组术后7 d 的TNF-α水平低于对照组,IL-4、IL-10水平均高于对照组。目前临床认为,通过氧化应激反应产生的活性氧物质可损伤自噬细胞功能,当细胞自噬功能损伤后,可促使胰腺组织内聚集大量毒性蛋白,从而加剧机体氧化应激损伤[14-15]。相关动物实验[16]表明,Nrf-2、HO-1信号通路在调节炎症、抗氧化和自噬功能方面具有重要介导作用,可避免多种器官发生氧化应激损伤和炎症损伤。本研究结果显示,早期组术后7d的Nrf-2阳性表达率、HO-1水平均高于对照组,提示通过实施APD引流腹水能有效增强Nrf-2的核转位效应,从而上调下游HO-1,从而减轻机体氧化应激损伤,并迅速缓解炎症反应[17-18]。当机体氧化应激反应、炎症反应均得到显著改善后,机体的免疫功能也能得到明显提升,这对降低患者手术并发症发生风险、改善患者预后均有重要意义。故观察组术后短期6个月随访期间的并发症发生率也低于对照组。
综上所述,APD可通过上调内源性抗氧化信号通路因子表达水平而一定程度上抑制氧化应激反应并缓解炎症反应,尽早对SAP患者实施APD治疗有利于降低并发症发生风险。但本研究也存在一定局限,观察指标仅局限于术后7d ,关于早期APD是否可以显著改善患者预后,尚有待于扩大样本量对患者术后生存情况进行远期随访,进一步深入研究。

