双歧杆菌三联活菌胶囊辅治晚期肝癌对患者疗效及免疫功能的影响
罗仕华,何良梅,范琳,范飞燕,刘威
肝癌可分为原发性与继发性两种,前者指肝细胞或肝内胆管上皮细胞发生的恶性肿瘤;后者多为转移瘤[1]。流行病学结果显示,我国是肝癌高发国家,每年约有新发病例46万,且患者病死率亦相对较高[2]。越来越多的研究结果证实:肠道菌群在促进肝癌发展中发挥了关键作用[3]。肠道菌群在病理状态下则会引起肠道菌群紊乱、失调,引起机体免疫功能受损,直接参与疾病的发生、发展[4]。研究证实,肠道菌群与恶性肿瘤存在紧密的联系,持续的胃肠道菌群紊乱,能影响肠道菌群的生态调节,为肿瘤的增殖创造条件[5]。故积极采取干预措施,调节机体肠道菌群,能预防疾病的发生。本研究观察双歧杆菌三联活菌胶囊辅治晚期肝癌对患者疗效及免疫功能的影响,报道如下。
1 资料与方法
1.1 临床资料 选取2018年4月—2020年6月赣南医学院第一附属医院收治的晚期肝癌患者60例,采用随机数字表法分为观察组和对照组,每组30例。观察组男19例,女11例;年龄43~82(65.97±5.91)岁;体质指数(BMI)17~29(23.58±3.32)kg/m2;肝功能分级:A级10例,B级14例,C级6例;巴塞罗那临床肝癌分期系统(BCLC)分期:C期25例,D期5例;肝硬化:是20例,否10例。对照组男17例,女13例;年龄46~81(63.26±5.68)岁;BMI 18~29(23.51±3.29)kg/m2;肝功能分级:A级12例,B级13例,C级5例;BCLC分期:C期26例,D期4例;肝硬化:是22例,否8例。2组患者临床资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会核准,患者及家属已知晓研究内容并签署知情同意书。
1.2 病例选择标准[6-7]纳入标准:(1)符合中晚期肝癌诊断标准;(2)BCLC分期C~D期,存在影像学可测量病灶;(3)预计生存期>6个月,符合索拉菲尼药物适应证,均无相关药物过敏史。排除标准:(1)存在靶向药物用药禁忌证者;(2)妊娠期或哺乳期女性;(3)血常规、凝血功能及心电图异常者;(4)合并心、脑、肺等非肿瘤性严重疾病者。
1.3 方法
1.3.1 治疗方法:2组均予常规治疗,包括补充维生素,予抗过敏、止吐等,患者接受治疗前至少进行1次系统的抗肿瘤治疗,即索拉非尼结合晚期肝癌综合治疗。甲苯磺酸索拉非尼片(Bayer AG生产)每次400 mg,每天2次,服药前2 h禁食。同时,治疗前对患者ECOG体力状况及临床症状等进行全面评估,治疗4周期间加强患者CT或MRI检查,记录所发现的可测量的病灶并将其作为基线资料,用药后第6周、12周分别完成上述影像学检查,后每8周进行1次影像学检查。观察组在上述基础上联合双歧杆菌三联活菌胶囊(上海上药信谊药厂有限公司生产,规格:0.21 g)治疗,每次2粒口服,每天3次,连续治疗4周(1个疗程)后随访6个月比较近期疗效差异。
1.3.2 肠道菌群标本采集与检测:采集患者治疗前、治疗后4周新鲜粪便及静脉血液标本,采用实时荧光PCR法(购自于美国ABI PCR扩增仪)测定双歧杆菌、乳酸杆菌、大肠杆菌、肠球菌水平,反应引物见表1[8]。

表1 引物设计
借助Blast在线完成特异性核实后,完成引物设计。参数测定:30 ℃下操作10 min;42 ℃处理30 min;99 ℃下处理5 min;5 ℃下处理5 min,合计完成循环35个,最终10 min延长,温度72 ℃。将上述反应得到的产物置于1.5%琼脂凝胶中电泳。
1.4 观察指标 比较2组近期疗效、治疗前后肠道菌群(双歧杆菌、乳酸杆菌、大肠杆菌、肠球菌)水平变化、炎性指标[内毒素、白介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)]差异,以及不良反应(恶心呕吐、脱发、白细胞异常、血压波动及肝肾异常)发生情况。治疗前与治疗4周后采集患者粪便样本,采用实时荧光PCR法测定双歧杆菌、乳酸杆菌、大肠杆菌、肠球菌水平;采集空腹静脉血液样本3 ml,采用酶联免疫吸附试验测定患者免疫指标水平。
1.5 近期疗效判定标准 (1)完全缓解(CR):患者症状体征消失,肿瘤消失;(2)部分缓解(PR):患者症状体征得到改善,肿瘤体积缩小;(3)稳定(SD):患者症状体征缓解,瘤体体积未见明显变化;(4)进展(PD):患者瘤体变大或出现新发病灶。客观缓解率(ORR)=(CR+PR)/总例数×100%。

2 结 果
2.1 近期疗效比较 观察组患者ORR为70.00%,高于对照组的43.33%,差异有统计学意义(χ2=4.343,P=0.037),见表2。
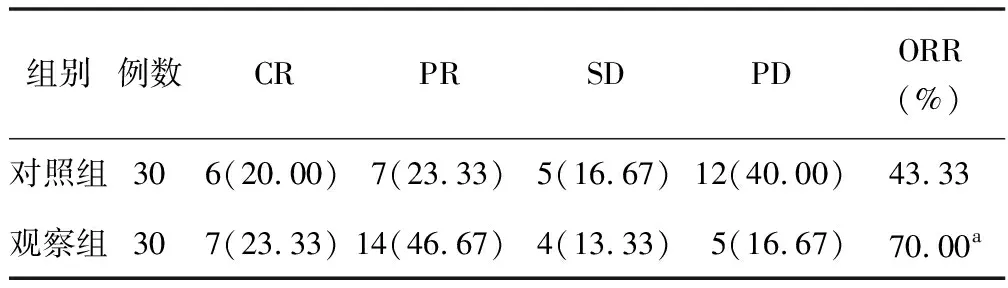
表2 对照组与观察组治疗效果比较 [例(%)]
2.2 肠道菌群比较 治疗前,2组患者双歧杆菌、乳酸杆菌、大肠杆菌、肠球菌水平比较差异无统计学意义(P>0.05);治疗后,2组双歧杆菌、乳酸杆菌水平均较治疗前上升,大肠杆菌、肠球菌水平下降,且观察组上升或下降的程度大于对照组,差异均有统计学意义(P均<0.01),见表3。

表3 对照组与观察组治疗前后肠道菌群比较对数/g粪便)
2.3 免疫指标比较 治疗前,2组患者内毒素、IL-10及TNF-α水平比较差异无统计学意义(P>0.05);治疗后,2组内毒素、IL-10及TNF-α水平均降低,且观察组低于对照组,差异均有统计学意义(P均<0.01),见表4。

表4 对照组与观察组治疗前后免疫指标比较
2.4 不良反应比较 观察组与对照组不良反应总发生率(26.67% vs. 30.00%)比较差异无统计学意义(χ2=0.082,P=0.774),见表5。

表5 对照组与观察组不良反应比较 [例(%)]
3 讨 论
索拉非尼是晚期肝癌患者常用的靶向治疗药物,能抑制肿瘤细胞的增生、促进肿瘤细胞凋亡,广泛用于治疗对标准疗法没有响应或难以耐受的胃肠道基质肿瘤和转移性肾细胞,能选择性的靶向某些蛋白受体。现代药理研究表明,索拉非尼能抑制肿瘤细胞增殖及抗血管生成,能作用于肿瘤细胞通路信号、血管生成与凋亡[9]。
近年来,益生菌在晚期肝癌患者靶向治疗过程中得到广泛应用,且效果较为理想。研究表明,内毒素位于细胞壁的最外层、覆盖在细胞壁的黏肽上,各种细菌的内毒素的毒力相对较弱,能引起微循环障碍、内毒素休克等。因此,内毒素水平能反映肠道菌群的定植及危害性。IL-10是一种多细胞源、多功能的细胞因子,能调节细胞的生长与分化,可参与机体炎性反应和免疫反应,属于临床公认的炎症与免疫抑制因子。TNF-α是肿瘤坏死因子的1种,能直接杀伤肿瘤细胞而对正常细胞无明显毒性的细胞因子,亦是人体炎性因子,其表达水平能反应机体的炎性状态。而益生菌有助于提升晚期肝癌患者靶向治疗的有效率,使获得良好预后。这主要是由于益生菌可抑制有害菌生长,刺激酵解作用,刺激肠黏膜细胞增生和激活免疫系统,从而能维持肠道微生态平衡,保证肠黏膜的完整性。由于肝脏炎性反应及肝硬化均能引发肝癌,而益生菌在肝脏炎症及肝硬化等治疗中发挥了积极的效果,能有效的预防肝癌的发生[10-11]。益生菌干预用于晚期肝癌患者靶向治疗过程中,能改善机体炎性免疫水平,巩固靶向药物治疗效果,可获得良好的预后,且安全性较好。
本研究结果显示,观察组患者ORR高于对照组;治疗后,2组双歧杆菌、乳酸杆菌水平均较治疗前上升,而内毒素、大肠杆菌、肠球菌水平和IL-10及TNF-α水平下降;观察组与对照组不良反应总发生率(26.67% vs. 30.00%)比较差异不明显。说明将益生菌用于晚期肝癌患者靶向治疗中,有助于调节机体免疫炎性因子水平,利于巩固药物效果,可获得良好的预后的同时其药物安全性较高。这与前述研究结果相一致。
综上所述,双歧杆菌三联活菌胶囊辅治晚期肝癌对患者疗效及免疫功能的影响较为积极,有助于提升患者免疫功能,降低炎性因子水平,值得临床推广应用。
利益冲突:所有作者声明无利益冲突。

