从微生态角度探讨分娩方式与抗生素对新生儿高胆红素血症发生和治疗的影响
唐炜, 金方强, 唐婷, 孙勤
新生儿高胆红素血症的发生率呈逐年上升趋势,是新生儿入院治疗的常见病之一。过高的血清胆红素可以通过血脑屏障干扰神经细胞的正常代谢,尤其是早期新生儿,其血脑屏障通透性较高,中枢神经系统对毒性物质十分敏感,在血清未结合胆红素水平较高的情况下极易造成神经系统功能紊乱产生胆红素脑病和胆红素脑损伤,是临床上新生儿致死残疾重要原因之一[1-2]。另一方面,人体肠道为菌群提供了良好的生长和栖息环境[3]。研究表明,超过350种菌群寄生在人体肠道内,包括致病性和共生性微生物,它们相互作用和影响以保持动态平衡,在营养、维持生命中起着重要的作用[4-7]。在胃肠道中,菌群与宿主间相互制约、相互依存,处于动态平衡状态[8-9],但是微生态系统失衡可导致细菌异位、免疫功能紊乱,使机体发生多种疾病[10-11]。新生儿肠道微生态始于母亲子宫内,但婴儿期是肠道菌群形成的关键时期,具有动态变化、对外敏感、易受刺激等特点[12]。包括早产、配方奶喂养、抗生素治疗、分娩方式等都对肠道微生态多样性和机体免疫功能的状况有直接的影响[13-14]。其中,抗生素使用可造成肠道微生物群改变致使菌群定植异常,影响肠黏膜屏障保护功能[15-17]。本研究拟通过16s rRNA高通量测序方法[18]为基础,比较不同分娩方式和不同抗生素使用情况下高胆红素血症新生儿肠道菌群分布特点,不同分娩方式高胆红素血症新生儿肠道菌群代谢产物变化,肠道微生态与新生儿高胆红素血症的发生发展存在相关性。基于此研究,通过早期分娩方式的宣传教育和治疗中抗生素应用的规范化,旨在为预防和更好地治疗新生儿高胆红素血症提供基础理论数据支撑和临床应用实践。
1 对象与方法
1.1 研究对象 选取江苏大学附属医院2021年1~12月新生儿科入院治疗的新生儿高胆红素血症患者90例作为研究对象,其中男47例,女43例;胎龄(38.8±1.3)周;出生体质量(3.35±0.41)kg。
按患儿出生方式又分为剖宫产组57例和顺产组33例。两组新生儿在性别、胎龄、出生体质量方面比较差异均无统计学意义(P>0.05),具有可比性,见表1。

表1 剖宫产组和顺产组患儿一般资料比较
患儿入新生儿科有部分高胆红素血症新生儿预防性使用了抗生素3 d,根据抗生素使用情况分为头孢地嗪组32例,头孢西丁组30例和空白对照组(未使用抗生素)28例。3组患儿在性别、胎龄、出生体质量方面比较差异均无统计学意义(P>0.05),具有可比性,见表2。

表2 头孢地嗪组、头孢西丁组和对照组患儿一般资料比较
同期选择我院产科母婴同室新生儿40例作为正常对照组。高胆红素血症组和正常对照组新生儿在性别、胎龄和出生体质量方面比较差异均无统计学意义(P>0.05),具有可比性。见表3。

表3 高胆红素血症和正常对照组新生儿一般资料比较
1.2 诊断标准 参照《新生儿高胆红素血症诊断和治疗专家共识》中新生儿高胆红素血症的诊断标准[19]。
1.3 纳入标准 (1)新生儿母亲为初产妇,年龄20~30岁,无妊娠高血压、肾脏疾病、贫血及糖尿病等妊娠期合并症。(2)胎儿出生时无产伤窒息,Apgar评分正常,出生体质量2 500~4 000 g,胎龄37~42周,生后半小时开奶。(3)产后3~5 d皮肤出现黄染,血清总胆红素超过Bhutani曲线95百分位数,以非结合胆红素增高为主。(4)患儿家属知情同意,且本研究已通过江苏大学附属医院生物医学研究伦理委员会审查(SWYXLL20200429-4)。
1.4 排除标准 出生时或生后伴有呼吸窘迫、头颅血肿、颅内出血、新生儿出血病、咽下综合征等。
1.5 研究方法
1.5.1 标本采集、保存和处理 采集高胆红素血症组新生儿入院第1天治疗前、治疗后第3天及产科正常对照组新生儿粪便标本,-80 ℃低温保存备用。
1.5.2 肠道菌群检测 (1)以16s rRNA高通量测序为检测依据。提取纳入研究的新生儿粪便标本gDNA,通过Onedrop检测gDNA浓度和纯度,琼脂糖凝胶检测其质量;检测合格后进行PCR扩增,琼脂糖凝胶检测PCR产物的浓度和质量,MD酶标仪检测产物浓度,QiagenQIAquick PCR purification kit回收产物,Aglient 2200 Bioanalyzer进行质控;合格后予IlluminaMiseq高通量测序仪进行测序。
(2)生物信息学分析:对原始数据进行拼滤后得到有效数据,基于有效数据进行operational taxonomic units(OTUs)聚类和物种分类分析,并将OTU和物种注释结合,从而得到每个样品的OTUs和分类谱系的基本分析结果。再对OTUs进行丰度分析,菌群属水平相对丰度计算公式=该菌的基因拷贝数/总拷贝数。
1.6 高未结合胆红素血症肠道细菌代谢产物的检测 操作人员戴无菌手套和口罩,用无菌离心管采集高胆红素血症和正常对照组新生儿纳入研究治疗前的粪便标本,每一例收集约10 g粪便,-80 ℃保存备用。采用液相色谱质谱联用技术检测粪便上清液中细菌代谢产物变化,比较高胆红素血症和正常新生儿肠道菌群代谢产物变化,分析与高胆红素血症相关的代谢标志物。
液相色谱为美国Thermo公司超高效液相色谱系统,色谱柱为(BEH)C18柱,流动相A为超纯水,流动相B为色谱纯乙腈,流动相中加入0.1%(V/V)甲酸,流速0.3 mL/min;以线性梯度洗脱,初始条件为2%的流动相B保持0.5 min,2%~50%流动相B(0.5~9 min);50%~98%流动相B(9~12 min),98%流动相B(12~13 min),98%~2%流动相B(13~14 min),平衡色谱柱1 min后采集下一个样品。每次进样量为4 μL,柱温40 ℃,自动进样器温度维持在4 ℃。电喷雾电离源正负离子电离模式。离子源温度120 ℃,脱溶剂温度300 ℃,脱溶剂氮气流速650 L/h,锥孔反吹氮气50 L/h。正离子和负离子模式毛细管电离电压分别为3.0 kV和2.8 kV,锥孔电压为27 eV,碰撞能为6 eV,四极杆扫描范围50~1 500 m/z。
运用非参数单变量检验方法——秩和检验筛选高胆红素血症和正常新生儿之间显著差异性代谢物;使用错误发生率检测法对结果进行检测,以降低上一步中筛选出的差异性代谢物假阳性率;运用主成分分析法和最小二乘判别分析法对差异性代谢物进一步筛选,结合人类代谢物数据库和京都基因和基因组百科全书数据库查找上述筛选出的代谢物来源及涉及的代谢通路,同时分析是否存在来源于人类肠道菌群参与的代谢通路。
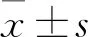
2 结果
2.1 新生儿肠道菌群主成分分析 高胆红素血症组新生儿肠道菌群属水平相对丰度前96%的菌属,比较正常新生儿和高胆红素血症新生儿肠道菌属之间的差异,结果显示,共检出46种差异有统计学意义的细菌,其中肠球菌属、埃希菌属、未分类的肠杆菌科等细菌在高胆红素血症新生儿肠道内含量明显高于正常新生儿,差异有统计学意义(P<0.05);拟杆菌属、未分类的毛螺菌科、普雷沃菌属等细菌在正常新生儿肠道内含量明显高于高胆红素血症新生儿,差异有统计学意义(P<0.05)。见表4。
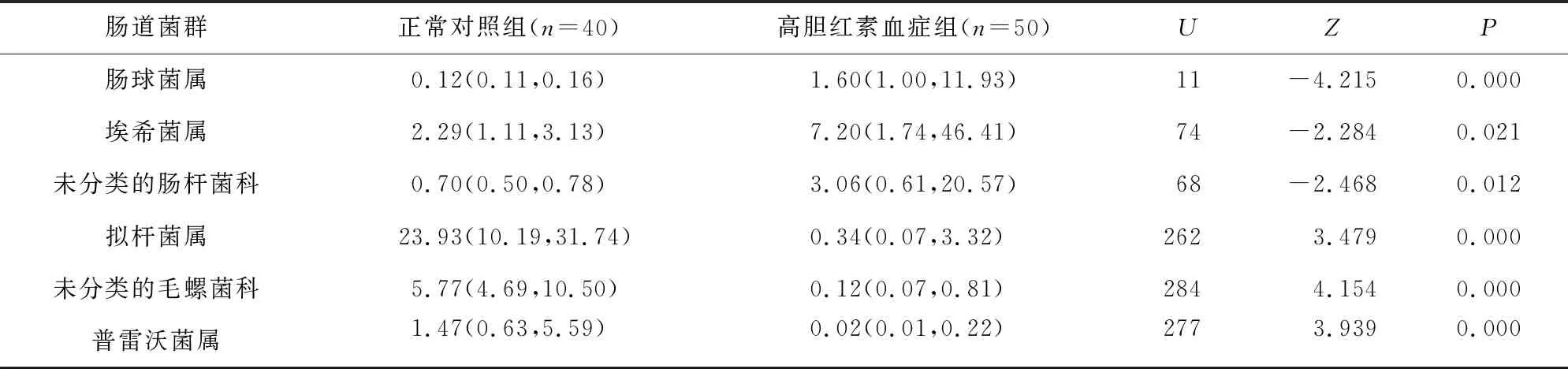
表4 高胆红素新生儿和正常新生儿肠道菌群分析[M(P25,P75)]
基于所有菌属,完成高胆红素血症新生儿肠道菌群主成分分析。结果显示,剖宫产出生和顺产出生高胆红素血症新生儿肠道菌群比较差异有统计学意义(P<0.05),且剖宫产出生的新生儿更容易发生高胆红素血症,差异有统计学意义(P<0.05)。入院治疗后,头孢地嗪组、头孢西丁组和空白对照组高胆红素血症新生儿肠道菌群比较差异有统计学意义(P<0.05)。见图1。
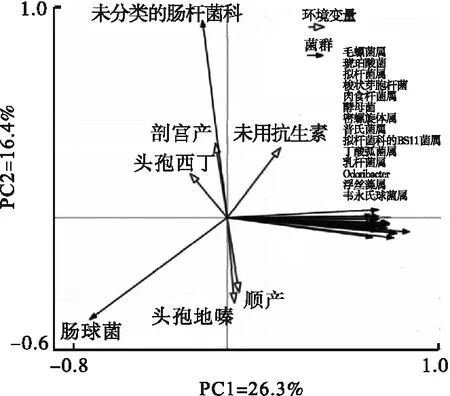
图1 不同分娩方式和不同抗生素干预高胆红素血症
2.2 不同分娩方式高胆红素血症新生儿肠道菌群分析 剖宫产组和顺产组高胆红素血症新生儿肠道菌群属水平相对丰度前96%的菌属,比较两组新生儿肠道菌属之间的差异,结果显示,高胆红素血症新生儿中顺产组与肉食杆菌属、紫单胞菌科呈正相关(P<0.05),剖宫产组与未分类的肠杆菌科呈正相关(P<0.05)。见图1和表5。

表5 剖宫产组和顺产组高胆红素血症新生儿组肠道差异菌群相关性分析
2.3 不同抗生素使用组高胆红素血症新生儿肠道菌群分析 头孢地嗪组、头孢西丁组和空白对照组高胆红素血症新生儿肠道菌群属水平相对丰度前96%的菌属存在明显差异。结果显示,高胆红素血症新生儿中头孢地嗪组、头孢西丁组与双歧杆菌呈负相关(P<0.05),空白对照组与肉食杆菌属、肠球菌和乳杆菌属呈负相关(P<0.05),空白对照组与浮丝藻属和韦永球菌属呈正相关(P<0.05),头孢地嗪组与未分类的肠杆菌科和韦永球菌属呈负相关(P<0.05)。见图1和表6。

表6 头孢地嗪组、头孢西丁组和空白对照组高胆红素血症新生儿组肠道差异菌群相关性分析
2.4 抗生素使用高胆红素血症新生儿肠道代谢产物特征 与正常对照组新生儿相比,抗生素使用组高未结合胆红素血症新生儿代谢变化主要在磷酸戊糖途径(P<0.01),主要代谢通路是丙氨酸、天门冬氨酸和谷氨酸代谢(P<0.01)。肠球菌和肉食杆菌属与差异代谢产物琥珀酸呈正相关(rs=0.692 3,0.521 7,P<0.01)。
3 讨论
本研究显示,剖宫产和顺产出生高胆红素血症新生儿肠道菌群存在明显差异,肉食杆菌属、紫单胞菌科与顺产组高胆红素血症新生儿存在正相关性,未分类的肠杆菌科与剖宫产组高胆红素血症新生儿存在正相关性。剖宫产出生的新生儿更容易发生高胆红素血症,差异具有统计学意义。顺产分娩的新生儿肠道菌群的多样性明显多于剖宫产分娩的新生儿。研究表明,婴儿出生前肠道呈无菌状态,出生第1周内,其肠道菌群的首次演替受母体肠道微生态、分娩方式、喂养类型[20-21],因此在新生儿肠道定植的微生物来源于母体的产道和肠道[22]。相比较,顺产分娩的新生儿肠道有益微生物总占比更高,肠道菌群具有更高的多样性,但剖宫产的新生儿要相对单一。进一步研究发现,剖宫产新生儿肠道差异菌群未分类的肠杆菌科属于医院环境中常见的微生物,几乎从临床各科感染标本中都能分离培养出肠杆菌科的细菌。其中,革兰阴性杆菌感染近年来呈现增长趋势,约占医院感染的60%~65%。同时,肠杆菌科在院内感染中除自身感染或医疗过程中导管、插管、输液、手术等交叉感染外,与医院环境中医护人员手、物体表面等可能也有一定关系,具有潜在的致病性,抗生素耐药性的可能性也更高。因而我们可以预判,超过80%的剖宫产婴儿都会携带那些在医院中广泛存在的机会性致病菌,且伴随时间变化,婴幼儿肠道内菌群种类由需氧菌和兼性厌氧菌向厌氧菌转变,肠道菌群从无到有、从简单到复杂、从不稳定到稳定发生进一步转变。另一方面,本研究通过入院治疗中使用头孢地嗪组,头孢西丁组和对照组相比较,高胆红素血症新生儿肠道菌群存在明显差异,双歧杆菌与头孢地嗪组和头孢西丁组高胆红素血症新生儿存在负相关性,肉食杆菌属、肠球菌和乳杆菌属与对照组高胆红素血症新生儿存在负相关性,浮丝藻属和韦永球菌属与对照组高胆红素血症新生儿存在正相关性,未分类的肠杆菌科与头孢地嗪组高胆红素血症新生儿存在负相关性。根据前期研究,约47%的新生儿接受过一种及以上抗生素,其使用合理性仍然存疑[23-24]。例如,抗生素的早期使用与炎症性肠病有相关性[25-26],新生儿即使只接受一次阿莫西林疗程也会扰乱肠道微生物群的组成[27]。本研究表明,抗生素使用会使大便菌群多样性降低,增加肠道潜在致病的肠球菌、肉食杆菌等的百分比,同时降低益生菌双歧杆菌的比例[28-29],新生儿期抗生素暴露与肠道微生态存在密切联系[30]。同时,肠道微生物在胆红素的肠肝循环和胆红素的排泄中起着重要的作用。在剖宫产出生和抗生素使用的新生儿肠道微生物群中,益生菌明显减少,有害细菌明显增加。这些有害细菌可能通过半乳糖代谢途径参与胆红素代谢,导致微生物群失衡[31]。在胆红素代谢中,新生儿正常肠道菌群可以转化偶联胆红素转化为粪胆红素原,其中大部分随粪便排出。当新生肠道菌群发生失衡,胆红素肠肝循环加速,导致新生儿高胆红素血症。微生物多样性减少是生态失调的主要特征。肠道物种多样性的降低会影响胆红素代谢。代谢组学分析发现,与空白对照组新生儿相比,抗生素使用组高胆红素血症新生儿代谢变化主要在磷酸戊糖途径,丙氨酸,天门冬氨酸和谷氨酸代谢。肠球菌和肉食杆菌属与差异代谢产物琥珀酸呈正相关。新生儿血清胆红素水平的升高可出现患儿全身多器官的功能损害,肠道菌群在胆红素的代谢过程中起到了至关重要的作用,肠道菌群代谢需要的碳水化合物主要来自食物和机体蛋白质、肽和消化酶,机体葡萄糖、氨基酸和脂肪的代谢会影响肠道菌群的代谢;同时,肠道细菌同时又能参与机体代谢,完成数种宿主细胞不能催化进行的酶反应,肠道菌群及其代谢产物影响宿主的代谢稳态,机体代谢功能的障碍与肠道菌群的变化密切相关。肠道菌群还可通过改变肝功能调节胆红素的代谢,完善免疫系统,提高肝酶活性,促进胆红素的结合和排泄。
综上,本研究显示了高胆红素血症和正常新生儿肠道菌群存在差异,顺产组和剖宫产组高胆红素血症新生儿以及头孢地嗪组、头孢西丁组和空白对照组高胆红素血症新生儿肠道菌群存在差异,且不同抗生素使用后高胆红素血症新生儿肠道菌群代谢产物变化。肠道微生物及其代谢产物对于维持血清胆红素水平有很大的作用,加强肠道代谢有助于降低新生儿血清胆红素水平。抗生素使用组高胆红素血症肠道内的差异菌群参与或影响机体葡萄糖、氨基酸等重要物质的代谢,而机体本身的各种相关代谢又可以影响肠道菌群的变化,这些代谢过程的变化可能直接或间接影响胆红素代谢。本研究显示了高胆红素血症和正常新生儿差异肠道菌群、分娩方式和抗生素的使用对高胆红素血症新生儿肠道菌群及其代谢产物产生的影响,这些研究结果是证明人体肠道菌群可以影响血清胆红素水平的有力证据,探讨了肠道微生态与新生儿高胆红素血症的发生发展存在相关性,对于预测新生儿高胆红素血症的发生具有指导意义,通过早期分娩方式的宣教和治疗中抗生素应用的规范化,以及标志性肠道菌群在新生儿以及高胆红素血症新生儿预防和治疗中的使用,为新生儿高胆红素血症的早期发现、早期预防和早期治疗提供了有力的数据支撑。

