高抗氧化活性黑皮鸡枞优良菌株筛选
李春兰 李佳欢 胡开辉 梁鹏







摘 要 通过观察8株黑皮鸡枞菌株固体、液体发酵过程中菌丝生长情况,比较其发酵液营养成分,以ABTS自由基清除率、DPPH自由基清除率、羟自由基清除率等抗氧化能力指标对菌株进行筛选。结果:菌株HP1的菌絲活力强,菌球干重大,为0.827 1 g·(100 mL)-1;发酵液还原糖含量为50.29 mg·mL-1,可溶性蛋白含量为38.47μg·mL-1;抗氧化物质含量高,总酚、总黄酮含量为240.12、23.23 μg·mL-1;抗氧化能力最强,其稀释液对ABTS自由基、DPPH自由基、羟自由基的清除率为54.28%、78.08%、66.06%,对铁离子的还原能力最强,吸光度为0.598。结果表明,黑皮鸡枞HP1菌株长势优良、菌丝浓密,富含黄酮、总酚等活性物质,抗氧化能力强,可用于后续黑皮鸡枞抗氧化产品的开发利用。
关键词 黑皮鸡枞;菌株筛选;菌种培养;抗氧化活性
中图分类号:Q939.99 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2023.15.006
黑皮鸡枞(Hymenopellis raphanipes)是长根菇的商品名,又名长寿菇、露水鸡枞、卵孢小奥德蘑、二孢拟奥德蘑,俗称黑皮鸡枞菌,是近年来食用菌工厂化栽培的热门菌种之一。其在分类学上属担子门伞菌纲伞菌目膨瑚菌小奥德蘑属[1]。由于黑皮鸡枞菌香味馥郁,肉质鲜嫩,含有丰富的氨基酸、维生素、多糖及矿物质元素等多种营养成分,并有抗氧化[2]、保护肝脏[3-4]、调整肠道菌群[5]、抑制病原菌[6]等生物活性,具有极高的食药用价值,受到众多消费者的喜爱。卢彩会等人测定黑皮鸡枞水提物和醇提物的抗氧化活性,证实了2种提取物对DPPH自由基、羟自由基和ABTS自由基均有较好的清除能力,对铁离子的还原能力随着添加量的增加而逐渐提高,且水提物比醇提物的抗氧化能力更强[2];安晓雯等则通过比较分析黑皮鸡枞、平菇、海鲜菇、白玉菇、香菇和金针菇等6种食用菌的营养成分、抗氧化活性等,得出黑皮鸡枞的抗氧化能力最高[7]。因此,选育高抗氧化活力的菌株对于黑皮鸡枞产业的高质量发展具有重要意义。目前,国内外研究人员对黑皮鸡枞的研究重点在其营养成分和培养条件优化等方面,鲜见关于对不同黑皮鸡枞菌株抗氧化活性的报道。本试验通过比较8个黑皮鸡枞菌株筛选出高抗氧化活性的优良菌株,以期对黑皮鸡枞的深加工提供理论指导。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
供试8个黑皮鸡枞菌株编号分别为HP1、HP2、HP3、HP4、HP5、HP6、HP7、HP8,全部由福建农林大学生命科学学院生物工程专业实验室馈赠。
1.1.2 培养基
斜面培养基(PDA):土豆200 g、葡萄糖20 g、琼脂20 g,蒸馏水定容至1 L,pH自然。115 ℃灭菌30 min,缓慢冷却。
加富培养基:葡萄糖20 g、蛋白胨2 g、酵母粉2 g、KH2PO4 2.5 g、MgSO4·7H2O 1 g、琼脂20 g,蒸馏水定容至1 L,pH自然。115 ℃灭菌30 min。
液体培养基:葡萄糖20 g、蛋白胨2 g、酵母粉2 g、KH2PO4 2.5 g、MgSO4·7H2O 1 g,蒸馏水定容至1 L,pH自然。115 ℃灭菌30 min。
1.1.3 试剂和仪器
试剂:葡萄糖、蛋白胨、酵母粉、KH2PO4、MgSO4·7H2O、牛血清白蛋白、考马斯亮蓝G-250、ABTS、DPPH、无水乙醇、水杨酸、FeSO4·7H2O、无水碳酸钠、过氧化氢等。
仪器:超净工作台、水浴锅、酶标仪、紫外分光光度计、电磁炉、制冰机、离心机、分析天平、高压灭菌器等。
1.2 试验方法
1.2.1 菌株活化
将4 ℃保藏的黑皮鸡枞菌株接种于PDA固体斜面培养基进行活化,置于25 ℃生化培养箱内培养10 d左右;选取已活化好的试管菌株进行扩大培养,用接种钩挑取0.5 cm×0.5 cm接种块接种于加富培养基平皿中心,于25 ℃恒温培养,48 h后倒置培养。
1.2.2 液体菌种的制备
将200 mL液体培养基装入500 mL摇瓶中,115 ℃灭菌30 min,冷却备用。将已经活化好的平皿刮去气生菌丝,再使用8 mm打孔器在距旧接种块相同距离处进行打孔,取25个接种块于液体培养基中,25 ℃培养24 h,再放入25 ℃、150 r·min-1摇床中培养。第3天开始用磁力搅拌器搅拌20 min·d-1,培养5 d。
1.2.3 摇瓶发酵
250 mL摇瓶装100 mL液体培养基,115 ℃灭菌30 min,冷却备用。液体菌种接种,接种量为5%,25 ℃、150 r·min-1摇床发酵6 d。培养完成后将发酵液进行过滤,测定菌球湿重、干重,再将发酵液9 000 r·min-1离心15 min,测定还原糖、总酚等活性物质含量及发酵液的抗氧化活性。
1.3 测定指标及方法
1.3.1 菌丝生长性状
观察各菌株菌丝在加富培养基上的生长状态,采用“十”字交叉法测定菌落半径(R),用游标卡尺测量生长长度,单位为mm;液体发酵,观察菌球生长情况,发酵结束测定生物量。菌丝生长速度按以下公式计算。
1.3.2 还原糖含量测定
发酵液中还原糖含量测定采用3,5-二硝基水杨酸法[8],稍作修改。以葡萄糖为标准品。取适当稀释的发酵液0.5 mL,再加入0.75 mL DNS试剂,混匀,沸水浴7 min后立即放入冰水混合物中冷却,然后定容至5 mL,于540 nm处测定吸光度(A)。
1.3.3 可溶性蛋白含量测定
发酵液中可溶性蛋白含量测定采用考马斯亮蓝染色法[9],稍作修改。以牛血清白蛋白为标准品。取适当稀释的发酵液1 mL,加入5 mL Bradford工作液,显色10 min后在595 nm下测定吸光度(A)。
1.3.4 总酚含量测定
发酵液中总酚含量测定采用 Folin-Ciocalten法[10],稍作修改。以没食子酸(Gallic acid)为标准品。25 μL适当稀释的发酵液加入96孔板中,然后加入125 μL福林酚试剂,室温下反应10 min后加入125 μL饱和Na2CO3溶液,振荡器上摇1 min,摇匀后室温下放置反应30 min,然后在765 nm下测定吸光度。
1.3.5 总黄酮含量测定
采用氯化铝络合分光光度法测定发酵液总黄酮含量[11],稍作修改。以芦丁为标准品。取适当稀释的发酵液50 μL于96孔板中,依次加入100 μL的AlCl3和50 μL醋酸-醋酸钠缓冲液,摇匀40 ℃反应15 min,于400 nm处测定吸光度。
1.3.6 ABTS自由基清除活性测定
参照Re R等[12]测定ABTS抗氧化能力方法并稍作修改。以VC作阳性对照。取250 μL发酵液于10 mL容量瓶中,蒸馏水定容。在96孔板中加入75 μL稀释的发酵液,再加入125 μL的ABTS工作液,缓慢摇匀,避光放置15 min,在734 nm下测定吸光度(As),同时取75 μL蒸馏水代替稀释液测得空白吸光度(Ac),以无水乙醇代替ABTS工作液测得稀释液本底吸光度(Aj)。每个样品做4个平行,取其平均值。
1.3.7 DPPH自由基清除活性测定
参照赵琳琳等[13]测定DPPH清除自由基能力方法并稍作修改。以VC作阳性对照。取2.5 mL发酵液于10 mL容量瓶中,蒸馏水定容。在96孔板中加入100 μL稀释液,再加入100 μL的DPPH溶液,室温避光震荡30 min,在517 nm下测定吸光度(As),取100 μL水代替稀释液测得空白吸光度(Ac),以无水乙醇代替DPPH溶液测得稀释液本底吸光度(Aj)。每个样品做4个平行,取其平均值。按公式(2)计算清除率。
1.3.8 羟自由基清除活性测定
参照Liu Y等[14]测定羟自由基清除能力时采用的水杨酸法并稍作修改。以VC做阳性对照。取250 μL发酵液于10 mL容量瓶中,蒸馏水定容。在96孔板中加入50 μL稀释液,依次加入50 μL的FeSO4(现配现用)、50 μL的水杨酸-乙醇溶液、50 μL的H2O2,37 ℃反应30 min,然后于510 nm处测定吸光度(As);取50 μL水代替稀释液测得空白吸光度(Ac),不加H2O2溶液为稀释液本底吸光度(Aj)。每个样品做4个平行,取其平均值。按公式(2)计算清除率。
1.3.9 还原能力测定
参照Liu Q等[15]测定还原能力方法并稍作修改。吸光值越大,还原力越强。取100 μL适当稀释的发酵液于2 mL 离心管,依次加入250 μL磷酸钠缓冲液和250 μL的K3Fe(CN)6,50 ℃水浴20 min,加入100 μL的TFA终止反应,4 000 r·min-1离心10 min。取上清100 μL和去离子水混合,加入20 μL的FeCl3室温孵育15 min,于700 nm下测定吸光度(A)。水代替发酵液作空白对照,以0.25 mg·mL-1的VC作为阳性对照。
2 结果与分析
2.1 不同菌株的菌丝形态特征比较
2.1.1 菌丝生长情况
由表1可知,不同黑皮鸡枞菌株在加富培养基上的菌丝长势存在差异,其中HP1、HP6、HP7、HP8的菌絲长势较强,菌丝粗壮浓密;HP2、HP3、HP4、HP5长势弱,菌丝纤细稀疏。同时不同黑皮鸡枞菌的菌丝生长速度间差异明显,其中以HP5生长速度最快,达5.09 mm·d-1,与HP3、HP4无显著性差异,但是显著快于其他菌株;其次是HP6、HP1,生长速度为4.80、4.60 mm·d-1;生长速度最慢的是HP8,为4.36 mm·d-1。
2.1.2 菌株液体发酵生物量
由表2可知,不同黑皮鸡枞菌株摇瓶发酵培养生物量存在差异,其中以HP6的菌球干重最大,达1.308 8 g·(100 mL)-1,显著高于其他菌株;其次是HP8、HP1,分别为0.848 0、0.827 1 g·(100 mL)-1,显著高于剩余菌株;HP2的生物量最低,菌球干重仅0.182 8 g·(100 mL)-1。
2.2 不同菌株的营养成分比较
2.2.1 还原糖含量
由表3可看出,黑皮鸡枞菌株HP2、HP5发酵液中还原糖含量最高,为56.71 、54.62 mg·mL-1,显著高于其他6个菌株;其次是HP1,为50.29 mg·mL-1;其余菌株的还原糖含量均低于50.00 mg·mL-1。
2.2.2 可溶性蛋白含量
由表3可看出,黑皮鸡枞菌株HP6发酵液中可溶性蛋白含量最高,达47.44 μg·mL-1,显著高于其他7个菌株;其次是HP3、HP8、HP1,分别为42.29、39.06、38.47 μg·mL-1;其余菌株的可溶性蛋白含量均低于35.00 μg·mL-1。
2.3 不同菌株的抗氧化活性比较
2.3.1 抗氧化活性物质含量
2.3.1.1 总酚含量
总酚具有清除自由基、抗氧化的作用,其含量越高,抗氧化能力越强。由表4看出,黑皮鸡枞菌株HP1发酵液中总酚含量最高,达240.12 μg·mL-1,显著高于其他7个菌株;其余依次为HP2、HP6、HP7、HP3、HP5、HP8、HP4,分别是229.80、223.85、223.85、212.55、207.19、207.09、198.52 μg·mL-1。
2.3.1.2 总黄酮含量
黄酮是一种强抗氧化剂,可有效清除多种自由基,黄酮含量高说明其抗氧化能力强。由表4可知,比较8个黑皮鸡枞菌株的总黄酮含量发现,HP6的含量最高,达24.72 μg·mL-1;其次是HP1,总黄酮含量为23.23 μg·mL-1;最低的是HP4,含量仅为18.79 μg·mL-1。
2.3.2 抗氧化活性分析
2.3.2.1 ABTS自由基清除能力
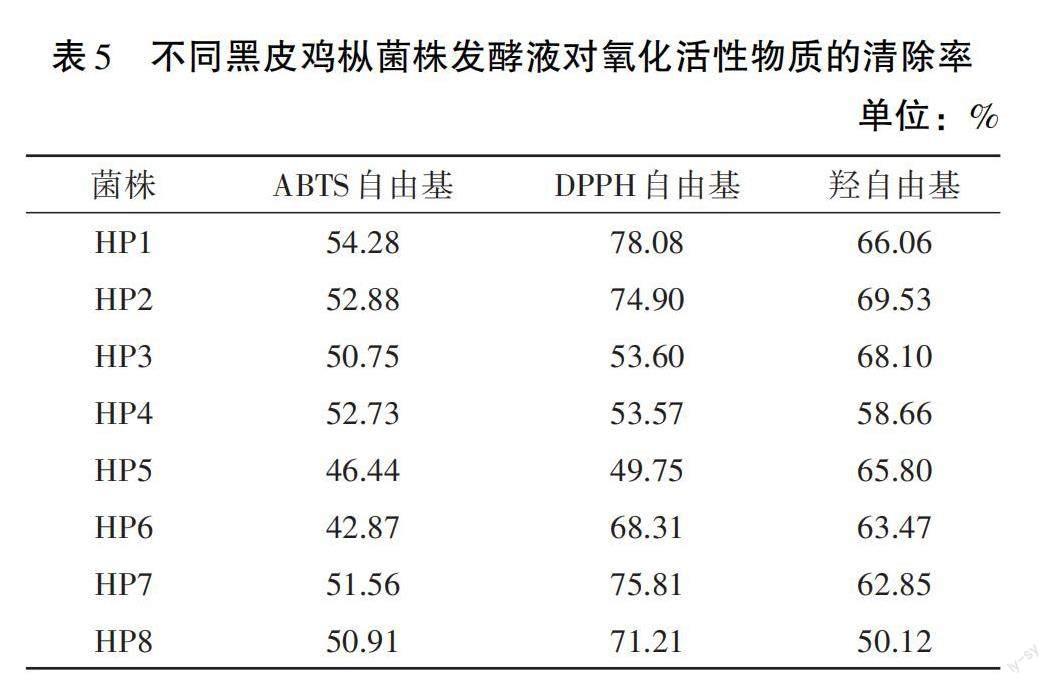
由表5可知,黑皮鸡枞菌株发酵液对ABTS自由基有一定的清除能力。在相同稀释倍数下,菌株HP1发酵液的清除率最高,为54.28%;其次是HP2、HP4菌株,清除率为52.88%、52.73%;其余菌株的清除率均低于52%。
2.3.2.2 DPPH自由基清除能力
由表5可知,黑皮鸡枞菌株发酵液对DPPH自由基有一定的清除能力。在相同稀释倍数下,菌株HP1发酵液的清除率最高,为78.08%,明显高于其他菌株;其次是HP7、HP2菌株,清除率为75.81%、74.90%;其余菌株的清除率均低于74%。
2.3.2.3 羟自由基清除能力
由表5可知,黑皮鸡枞菌株发酵液对羟自由基有一定的清除能力。在相同稀释倍数下,菌株HP2、HP3发酵液的清除率最高,分别为69.53%、68.10%,两者略有差异,但差异不显著;其次是HP1、HP5菌株,清除率为66.06%、65.80%;其余菌株的清除率均低于65%。
2.3.2.4 还原能力分析
由图1可知,黑皮鸡枞菌株发酵液对铁离子有一定的还原能力,其中菌株HP1的吸光度最大,为0.598,显著高于其他7个菌株,还原力最强;其次是HP3、HP7,吸光度为0.560、0.555;其余菌株的吸光度均低于0.550。
3 小结与讨论
本研究结果表明,不同黑皮鸡枞菌株的菌丝生长速度、菌球干重、抗氧化成分含量及抗氧化活性存在差异,这与张越野对不同灵芝诱变菌株抗氧化活性研究结果一致,诱变菌株A14、A19的DPPH自由基清除率、铁离子还原能力、ABTS自由基清除能力显示出较强的抗氧化活性[16];也与曲德辉筛选桑黄优良菌株的研究结果一致,在7个桑黄菌株中筛选出了1株菌丝生长活力、发酵生物量、抗氧化能力均优于其他6个菌株的优良菌株SH1[17]。综合不同菌株的菌丝生长速度、菌球干重、抗氧化成分及活性结果,HP1菌丝活力强,菌球干重大,为0.827 1 g·(100 mL)-1,还原糖含量为50.29 mg·mL-1,可溶性蛋白含量为38.47 μg·mL-1;抗氧化物质含量高,总酚、总黄酮含量为240.12、23.23 μg·mL-1,抗氧化能力最强,其稀释液对ABTS自由基、DPPH自由基、羟自由基的清除率为54.28%、78.08%、66.06%,对铁离子的还原能力最强,吸光度为0.598。研究结果表明黑皮鸡枞HP1菌株是8株黑皮鸡枞菌株中抗氧化能力最强的菌株,可用于后续黑皮鸡枞抗氧化产品的开发利用。
参考文献:
[1] 李玉,李泰辉,杨祝良,等.中國大型菌物资源图鉴[M].北京:中国农业出版社,2015.
[2] 卢彩会,郭晓萌,牟德华.黑皮鸡枞菌水提物和醇提物的主要成分及抗氧化性研究[J].食品工程,2016(3):35-40,57.
[3] 郭慧.黑皮鸡枞菌糠多糖的结构分析及其对LPS诱导的小鼠肝肠保护作用[D].泰安:山东农业大学,2022.
[4] 赵化杰.黑皮鸡枞菌菌丝体多糖的结构表征及慢性肝损伤修复研究[D].泰安:山东农业大学,2020.
[5] 石露露.黑皮鸡枞菌多糖ORP-1改善肠道粘膜屏障功能的机制研究[D].合肥:安徽大学,2021.
[6] 郭艳芳,门晓艺,高山雪,等.卵孢小奥德蘑提取物对人参立枯病等病原菌的抑制作用[J].吉林农业大学学报,2020,42(6):633-637.
[7] 安晓雯,王彦立,杨子怡,等.黑皮鸡枞菌营养与质构特性分析及其抗氧化活性评价[J].食品工业科技,2021,42(5):236-242,249.
[8] 尹建雄,卢红,谢强,等. 3,5-二硝基水杨酸比色法快速测定烟草水溶性总糖、还原糖及淀粉的探讨[J].云南农业大学学报,2007(6):829-833,838.
[9] 牛建峰,王广策,曾呈奎,等.带形蜈蚣藻多糖和可溶性蛋白含量测定及藻红蛋白分析鉴定[J].海洋科学,2006(8):50-53.
[10] ZHANG Q, ZHANG J, SHEN J, et al. A simple 96-well microplate method for estimation of total polyphenol content in seaweeds[J]. Journal of Applied Phycology, 2006, 18(3-5): 445-450.
[11] 张小娜.茯砖茶化学成分及抗氧化活性研究[D].北京:北京中医药大学, 2014.
[12] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology &Medicine,1999, 26(9/10): 1231-1237.
[13] 赵琳琳,张鑫喆,徐方旭,付楚溪,柳叶飞,王升厚.蛹虫草多肽的提取及体外抗氧化活性研究[J].山东工业技术,2018(19):49,51.
[14] LIU Y, QIANG M, SUN Z, et al. Optimization of ultrasonic extraction of polysaccharides from Hovenia dulcis peduncles and their antioxidant potential[J]. International Journal of Biological Macromolecules, 2015, 80: 350-357.
[15] LIU Q, YAO H. Antioxidant activities of barley seeds extracts[J]. Food Chemistry, 2007, 102(3):732-737.
[16] 张越野,张赫男,谭贻,冯杰,唐庆九,唐传红,张劲松.筛选高抗氧化能力的灵芝诱变菌株[J].食用菌学报,2021,28(03):47-54.
[17] 曲德辉,杨焱,张赫男,冯杰,张忠,颜梦秋,唐传红.桑黄菌株活力评价及优良菌株筛选[J].菌物学报,2016,35(10):1187-1198.
(责任编辑:易 婧)

