SIRT6 与衰老的关系及其在运动促进健康中的作用机制研究进展
蒋辰欣 才让三木知 王一晴 傅力
天津医科大学医学技术学院康复医学系(天津 300070)
1 SIRT6 的结构与功能
Sirtuin 蛋白属于第 III 类组蛋白去乙酰化酶(histone deacetylase,HDAC),因其依赖 NAD+,区别于以锌离子作为催化辅因子的第Ⅰ、Ⅱ、Ⅳ类HDAC[1]。在哺乳动物中,目前已鉴定出Sirtuins 蛋白家族SIRT1-SIRT7 七种蛋白,它们共享一个高度保守的催化核心,由大约250 个氨基酸残基构成,分为 Rossmann 结构域与 Zn2+结合域,前者是结合 NAD+/NADH 或 NADP+/NADPH 酶中典型的结构域,后者在Sirtuin 蛋白中仅发挥结构作用[2]。Sirtuins 蛋白家族成员具有不同的亚细胞定位,如 SIRT1、SIRT6、SIRT7 定位于细胞核,SIRT3、SIRT4、SIRT5 定位于线粒体,SIRT2 优先定位于胞浆[3]。有研究发现,SIRT6 在应激状态下可出现在胞浆应激颗粒中[4]。SIRT6 因具有独特的酶活性而受到关注,其具有HDAC、单-ADP-核糖基转移酶(mono-ADP-ribosyl transferase)以及长链脂肪酸脱酰酶(long-chain FA deacylase)三种酶活性[5]。SIRT6 多效的酶活性和灵活的细胞定位,提示其可在多种生物过程中发挥作用。
动物实验发现,缺乏SIRT6 的突变小鼠体型瘦小且有严重代谢障碍,在2~3 周龄时即表现出早衰表型,包括淋巴细胞显著减少、皮下脂肪丢失、脊柱后凸和严重代谢障碍[6],并且SIRT6 缺乏导致的衰老表型较Sirtuins 家族其他成员缺乏更为严重[7]。而过表达SIRT6 的雄性转基因小鼠相较于对照组小鼠表现出寿命显著延长,并伴随调控细胞生长与凋亡的胰岛素样生长因子-1(insulin- like growth factors-1,IGF-1)信号通路的信号改变:降低血清 IGF-1 水平,提高IGF 结合蛋白-1(insulin-like growth factors binding protein-1,IGFBP-1)表达水平,影响IGF-1 信号通路中其他关键节点的磷酸化水平[[8]。由此可知,SIRT6在小鼠健康寿命的维持中发挥重要作用,其缺失会显著加剧衰老进程。
2 SIRT6 延缓衰老的潜在机制
衰老是涉及机体组织细胞形态与机能改变的多因素过程。《细胞》杂志最新文章总结了衰老的12 项特征:基因组失稳、端粒缩短、表观遗传学改变、蛋白质稳态失衡、巨自噬失能、营养感知失调、线粒体功能障碍、细胞衰老、干细胞耗竭、细胞间通讯改变、慢性炎症和微生态失调[9]。Sirtuins 蛋白家族可在以上多个过程中发挥调控作用[9],其中SIRT6 主要通过提高基因组稳定性直接延缓衰老进程,并可参与调节衰老过程中机体能量代谢与氧化应激状态的改变。此外,SIRT6 在心血管疾病的防治中也发挥重要作用。
2.1 SIRT6 提高基因组稳定性
基因组不稳定是衰老的特征之一。SIRT6 在胞核的亚细胞定位有助于其发挥去乙酰化功能促进DNA修复、调节染色质开放性、维持端粒完整性等机制提高基因组稳定性,并且SIRT6 对基因组稳定性的维持是其延缓衰老的核心机制。
细胞DNA 不断受到外界环境和内在生物过程造成的损伤,如果没有及时修复或修复不当,DNA 损伤的积累将导致细胞死亡和组织功能障碍,最终加速衰老进程。真核生物的DNA 修复主要包括碱基切除修复(base excision repair,BER)、核苷酸切除修复(nucleotide excision repair,NER)、碱基错配修复(mismatch repair, MMR) 和双链断裂(doublestrand break,DSB)修复[10]。
其中,DSB 是最严重的DNA 损伤类型。在啮齿动物中发现,DSB 修复的能力与最长寿命存在共进化关系,并且SIRT6 活性与长寿存在显著正相关[11]。以往研究认为SIRT6 是最早被招募至DSB 损伤部位的因子之一,SIRT6 通过招募染色质重塑蛋白SNF2H 使DNA 损伤部位附近的染色质结构松弛,促进其后续修复[12]。最新研究发现,SIRT6 可作为DSB损伤的直接感应器,启动包括同源重组(homologous recombination,HR)与非同源末端链接(non-homologous end joining,NHEJ)在内的下游DNA 损伤修复机制[13]。值得注意的是,在氧化应激反应导致的DSB中,应激活化蛋白激酶(c-Jun N-terminal kinase,JNK)可磷酸化修饰SIRT6 的S10 位点,S10 磷酸化促进SIRT6 在损伤部位招募并单-ADP-核糖基化激活 DNA 修复因子PARP1 (poly (ADP-ribose)polymerase 1),从而促进DSB 修复[14]。SIRT6 在其他类型DNA 修复过程中亦发挥重要作用。SIRT6 过表达后,显著提高衰老细胞BER 效率,并以PARP1 依赖的方式减轻衰老细胞的 BER 功能下降[15](见图1),亦有研究认为 SIRT6 可能通过调节 DNA 聚合酶 β(polymerase β,polβ)活性影响 BER[6]。NER主要与紫外线导致的DNA 损伤有关,SIRT6 可通过去乙酰化DNA 损伤结合蛋白2(damage specific DNA binding protein 2,DDB2),促进其泛素化以及与染色质的分离,最终导致损伤部位周围的核小体松弛,启动NER[16](图1)。SIRT6 参与BER、NER 进程的研究结果更新了以往对SIRT6 主要影响DSB 修复的认识局限,进一步确定了SIRT6 在维持基因组稳定性中的重要作用。
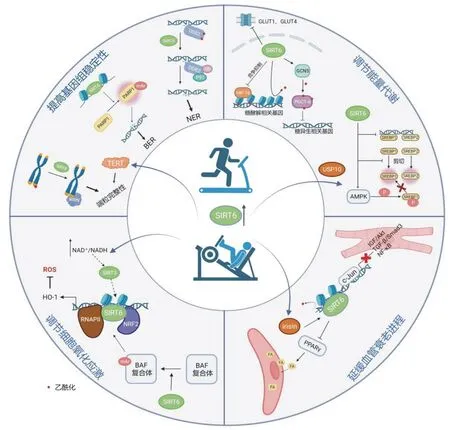
图1 SIRT6 介导运动健康效益的可能机制
端粒是位于染色体末端的重复DNA 序列,随细胞分裂次数增加不断缩短,当其缩短达临界长度时,细胞会功能失调,失去增殖能力,进入衰老进程[17]。SIRT6与端粒完整性的维持密切相关,在S 期与端粒结合后,在端粒上去乙酰化H3K9 并促进WRN 解旋酶与端粒染色质的结合,从而防止端粒序列异常丢失[18](图1)。此外,SIRT6 在端粒位置效应(telomere position effect,TPE)中发挥重要作用,可通过维持端粒近端基因沉默,防止端粒序列丢失和染色体末端融合[19]。
2.2 SIRT6 调节能量代谢
针对衰老过程中常出现的能量稳态失衡,SIRT6可通过调节糖、脂代谢优化对能量底物的利用,改善能量代谢。作为真核细胞重要能量感受因子腺苷酸激活蛋白激酶 AMPK (AMP activated protein kinase,AMPK)的上游蛋白[20],SIRT6 正在逐步成为代谢性疾病的治疗靶点[21]。
SIRT6 在代谢领域作用的研究,始于发现SIRT6基因敲除小鼠表现出致死性低血糖[6]。其后的研究发现,这种致死性低血糖状态是由于SIRT6 缺乏引起多组织/器官胰岛素受体底物 1(insulin receptor substrate,IRS1)和IRS2 磷酸化水平增加并激活AKT信号通路,葡萄糖转运体 1(glucose transporter 1,GLUT1)和GLUT4 膜结合显著增加,最终导致血糖严重下降[22]。而有研究报道,过表达SIRT6 可提高骨骼肌与肝组织的胰岛素敏感性[23],提示SIRT6 对血糖的影响可能存在组织特异性调节。在7~8 周龄年轻小鼠肝脏的糖异生过程中,SIRT6 可通过去乙酰化组蛋白乙酰转移酶 GCN5 (general control nonrepressed protein 5),增强GCN5 对过氧化物酶体增殖物激活受体γ 共激活因子1α(peroxisome proliferatoractivated receptor γ coactiva-tor-1α,PGC-1α)的乙酰化修饰,从而抑制PGC-1α 下游糖异生基因的表达[24]。而Roichman 等发现SIRT6 对老年小鼠的糖异生过程发挥促进作用,由于衰老过程中更易出现能量缺乏,因此,促进合成代谢更有助于维持正常血糖水平[25]。SIRT6 对青年与老年小鼠糖异生过程的不同影响提示其作用并非单一的升高或降低血糖,而是针对不同年龄段的血糖波动发挥特定作用最终维持血糖水平在正常范围。在糖分解代谢方面,SIRT6 可通过竞争抑制缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α),在包括GLUT1、丙酮酸脱氢酶激酶4(pyruvate dehydrogenase kinase 4,PDK4)、乳酸脱氢酶等多个糖酵解基因启动子处去乙酰化H3K9,避免糖酵解过度激活[26](图1)。
此外,SIRT6 对脂代谢的作用亦有动物实验验证。当肝脏特异性敲除SIRT6 后,小鼠表现出甘油三酯合成增加,β 氧化减弱,并导致脂肪肝形成[27];而过表达SIRT6 的小鼠,在高脂喂养的条件下,内脏脂肪、血浆低密度脂蛋白胆固醇和血清甘油三酯的积累显著低于野生型小鼠[28]。该表型的出现可能由于 SIRT6抑制过氧化物酶体增殖物激活受体 γ(peroxisome proliferators-activated receptor γ,PPARγ)下游血管生成素样蛋白4(angiopoietin-like protein 4,ANGPTL4)以及降低甘油三酯合成过程中关键酶二酰甘油酰基转移酶1 (diacylglycerol acyltransferase 1,DGAT1)的表达,促进血清甘油三酯的清除并减少其合成[28]。目前已有研究证实,在胆固醇合成过程中,SIRT6 可通过直接抑制转录,抑制其剪切为活性形式以及激活 AMPK 三种途径抑制固醇调节元件SREBP1 (Sterol regulatory element binding protein 1)和SREBP2,最终减少脂质积累[29](图1)。而最新研究结果显示,除上述三种机制外,SIRT6 还可能通过激活 PPARα 促进脂肪酸 β 氧化并且抑制 SREBP依赖的胆固醇合成途径[30]。以上结果表明,SIRT6 在糖、脂代谢的多个过程中发挥的重要作用是其参与实现健康衰老的重要环节。
2.3 SIRT6 调节细胞氧化应激
氧化应激是多项疾病发生发展过程中的重要病理机制,其特征是活性氧(reactive oxygen species,ROS)的产生和清除间的失衡[31]。近年研究发现,SIRT6 可通过多条信号通路减轻细胞氧化应激反应[32-34],其中SIRT6-Nrf2-HO-1 通路最具代表性。以往认为,SIRT6 通过发挥去乙酰化酶活性,在血红素氧合酶1(heme Oxygenase-1,HO-1)启动子上去乙酰化组蛋白H3K56,触发核因子相关因子2-RNA 聚合酶Ⅱ(Nrf2-RNAP Ⅱ)转录复合体的形成,上调HO-1 的表达,进而发挥其抗氧化作用[35]。而最新观点认为SIRT6 依赖其单-ADP-核糖基转移酶活性,在氧化应激状态下,催化BAF 复合体(BRG1/BRM associated factor complexes)的单-ADP 核糖化,促进其招募至HO-1 启动子,引发染色质重塑,进而有助于Nrf2 招募RNAPII[36](图1),最终减轻氧化应激反应。此外,SIRT6 可直接使烟酰胺磷酸核糖转移酶(nicotinamide phosphoribosyl transferase,NAMPT)去乙酰化,提高NAD+和NADPH 水平,提高细胞抵御氧化应激能力[37]。由此,SIRT6 可从氧化和抗氧化两方面调控衰老过程中氧化应激反应的过度激活,为靶向SIRT6 实现延缓衰老的干预手段提供了新的理论依据。
2.4 SIRT6 延缓血管衰老
在增龄相关疾病中,心血管疾病是常见且致残、致死率最高的疾病。血管功能和表型的改变是诸多心血管系统疾病发生发展的始动因素。此外,由于微循环存在于机体每个组织中,其对多数组织和器官的微环境均可产生影响,因此,增龄导致的微循环功能与结构改变还可能影响其他系统疾病的发生发展,如血管性认知障碍、阿尔茨海默病、肌减症、以及部分肾脏和眼部疾病[38]。因此,研究与控制血管衰老进程,对于预防和缓解与衰老相关的多种疾病具有重要意义。
血管衰老涵盖血管内皮细胞和血管平滑肌细胞的衰老进程,二者在心血管疾病发生发展过程中出现复制衰老(replicative senescence)和压力诱导早熟型衰老(stress induced premature senescence,SIPS)两种细胞衰老表型[39]。内皮细胞中 SIRT6 有较高表达,SIRT6 缺失会加剧内皮细胞复制衰老[40]。而在血管内皮细胞中特异性过表达SIRT6 的糖尿病小鼠表现出射血分数保留型心力衰竭症状减轻,耐力运动能力提高,其机制可能与SIRT6 抑制PPARγ 表达,减少内皮细胞脂肪酸摄取,降低心脏脂质积累相关[41]。SIRT6 可通过去乙酰化血管平滑肌细胞端粒的组蛋白H3K9,保护端粒免受损伤,从而延缓血管平滑肌细胞衰老和炎症反应[42](图1)。在心血管疾病方面,SIRT6 可通过抑制 c-Jun 活性负调控心肌细胞中IGF/AKT 信号通路,阻止其异常激活,从而延缓心肌肥大向心力衰竭发展[43]。此外,SIRT6 可通过去乙酰化组蛋白H3K9 和H3K56 抑制转化生长因子-β(transforming growth factor-β,TGF-β)/ Smad3 信号通路[44],以及阻断核因子κB(nuclear factor kappa-B,NFκB)信号通路[45],抑制心脏纤维化中心脏成纤维细胞向肌成纤维细胞的转变(图1),从而延缓病理性心脏重构和心力衰竭的发展。SIRT6 还可通过前述维持脂质动态平衡的功能,发挥保护血管、防止动脉粥样硬化的作用。
3 SIRT6 与运动的关系
3.1 运动提高SIRT6 表达
研究发现,小鼠经4 周有氧运动干预后骨骼肌SIRT6 表达显著增加[46]。同时,多项研究表明运动干预亦会影响人体SIRT6 水平:GEO 数据分析结果显示,相较于静坐少动组,长期有氧运动组人群骨骼肌SIRT6 表达显著提高[46];近年三项人群研究结果显示12 周抗阻运动、8 周高强度间歇运动、8 周耐力与抗阻混合运动等不同运动方式均可显著提高老年男性血清SIRT6 与端粒酶的表达水平[47-49]。由此可见,有氧运动、抗阻运动以及两者联合均可提升机体SIRT6 的表达水平,虽然距离将SIRT6 视为运动因子仍需更多实验证据,但现有成果提示SIRT6 可能介导了运动对机体的有益效应。
针对运动增加SIRT6 表达机制的相关研究目前较少,Cardus 等初步实验发现给予肌管细胞白细胞介素6(interleukin-6,IL-6)干预或给予小鼠腓肠肌电刺激均可促进 SIRT6 表达[46],提示运动过程中SIRT6 表达水平的提高可能由内分泌/旁分泌信号和/或兴奋-转录偶联(excitation-transcription coupling)等多种刺激协调作用产生。除IL-6 外,研究发现纤维连接蛋白Ⅲ型结构域蛋白5(fibronectin type Ⅲdomain- containing protein 5,FNDC5) 也可提高SIRT6 表达[50],而上述IL-6 和FNDC5 均为目前已被广泛认可的运动因子。因此,未来对运动影响SIRT6 水平及SIRT6 介导运动效应的研究或可从运动因子的中介作用角度展开。此外,氧化应激状态下泛素连接酶Hsp70 相互作用蛋白的羧基末端(carboxyl terminus of Hsp70-interacting protein,CHIP) 表达减少,使其对SIRT6 降解的抑制作用减弱[51],降低机体包括心脏、肝脏在内的多个组织SIRT6 蛋白水平。由此推测,运动可能通过发挥其标志性的抗氧化作用[52],间接提升机体SIRT6 水平,但这一推论有待深入研究证实。
3.2 SIRT6 介导运动有益效应的可能机制
运动过程伴随机体SIRT6 水平的提高,不仅有助于 SIRT6 发挥前述延缓衰老的各项作用,还提示SIRT6 可能与已知运动激活的信号通路相连接,参与介导运动对机体的部分有益效应。现有研究发现SIRT6 在运动调节机体能量代谢、血管功能、氧化应激和端粒稳态中发挥一定作用。
SIRT6 在运动调节机体代谢功能的过程中发挥作用。研究发现,在高脂饲料诱导小鼠肥胖模型中,小鼠肝脏特异性去泛素化酶10(ubiquitin specific peptidase 10,USP10)与SIRT6 蛋白表达水平下降,而急性或慢性运动干预均可提高肝脏 USP10 与 SIRT6表达、调节胰岛素信号转导、抑制过度糖异生,发挥运动改善胰岛素抵抗的作用[53]。由于USP10 可去泛素化并激活 AMPK[54],结合前述 SIRT6 去泛素化AMPK,提示运动可能同时通过USP10 与SIRT6 发挥对能量代谢的调节作用(图1)。在骨骼肌代谢方面,运动后SIRT6 水平的提高,可通过促进环磷腺苷效应元件结合蛋白(cAMP response element-binding protein,CREB)的转录,下调慢肌纤维特异基因的关键抑制因子Sox6,从而提高慢肌纤维比例和线粒体活性,增加骨骼肌有氧代谢水平[46],最终改善肥胖与2 型糖尿病的症状[55]。
在血管功能方面,运动促进骨骼肌释放的运动因子FNDC5/irisin 通过影响分子伴侣HSP40 和泛素-蛋白酶体通路抑制剂MG132 提高SIRT6 在血管平滑肌细胞的表达及稳定性,延缓血管衰老进程[50](图1)。另一项研究发现,母鼠孕前和孕期进行高强间歇运动可通过增加SIRT6 与降低胰岛素样生长因子2(insulinlike growth factor 2,IGF-2)在子代小鼠心脏的表达,提高雄性子代的运动表现并降低其对心血管疾病的易感性[56]。提示运动可直接或间接提高SIRT6 的蛋白表达,发挥其在延缓血管衰老方面的作用。
运动干预可激活线粒体低毒兴奋效应(mitohormesis)[57],即对线粒体稳态的轻度干扰有助于促进机体产生适应性反应,延长预期寿命[9]。在此过程中,运动通过提高NAD+/NADH 率,激活NAD+依赖的组蛋白去乙酰化酶SIRT3[58],SIRT3 可促进SIRT6 表达,进而发挥前述SIRT6 激活Nrf2-HO-1 通路的作用,维持细胞氧化还原稳态[57](图1)。提示SIRT6 可能参与运动干预调节抗氧化系统活性、改善细胞氧化应激环境的作用。此外,单次有氧运动后血浆SIRT6 水平的提高,伴随免疫细胞中端粒酶逆转录酶(telomerase reverse transcriptase,TERT)转录水平提高,TERT 在端粒酶表达与端粒稳态的维持中发挥重要作用[59],提示SIRT6 可能参与运动对端粒稳态的调控(图1)。
4 总结
作为近年广受关注的“长寿蛋白”,SIRT6 具有的多效酶活性有助于其广泛参与衰老相关生物过程的调节。在基因组稳定性层面,SIRT6可提高DNA 修复效率与端粒稳定性;在能量代谢层面,SIRT6 可在糖、脂的合成与分解代谢的多个通路中发挥调节作用促进能量代谢稳态;针对氧化应激失衡,SIRT6 可从氧化与抗氧化两方面综合发挥调控作用;此外,SIRT6 可调节血管内皮细胞和平滑肌细胞在增龄过程中异常激活的通路,并结合其调节脂代谢和氧化应激的作用,可降低衰老伴发心血管疾病的风险。现已确认,运动可增加机体组织SIRT6 的表达并激活SIRT6 在上述生物过程中的作用。鉴于目前对SIRT6 参与介导运动延缓衰老过程的具体机制研究尚不明确,后续相关研究可考虑针对不同运动方式对SIRT6 表达及其分子机制影响的深入探究,以期未来以SIRT6 为靶点开发延缓衰老的“运动模拟(exercise mimetics)”药物。

