海洋真菌Aspergillus terreus次生代谢产物研究
李思敏,周金彩,何 蓉,唐颖楠,周思倩,王雅静,龙红萍*
1湖南科技职业学院药学院,长沙 410004;2湖南中医药大学第一附属医院,长沙 410007;3湖南中医药大学,长沙 410208
近年来,海洋天然产物吸引了全世界的化学家和生物学家的关注,目前已从海洋生物中分离鉴定出1.6万多种海洋天然产物,海洋微生物被认为是生产新型抗生素、抗肿瘤和抗炎药物的宝贵来源[1]。海洋真菌特别是与海洋藻类、海绵、无脊椎动物和沉积物相关的真菌是生物活性次代谢产物的有效生成者,由于它们在温度、营养物质、竞争和盐度等方面的特性,与陆生真菌相比形成了特定的次级代谢途径,能产生丰富的新活性天然产物[2],这些新颖结构次生代谢物在药物发现过程中发挥着重要作用[3,4]。
曲霉属真菌是地球上分布最广泛的真菌群之一,包含约300~350多种真菌[5]。目前从曲霉属真菌中发现了多种结构类型的次生代谢产物,如生物碱类、萜类、木质素类、甾体、聚酮类、环肽类等,且具有抗肿瘤、抗菌、抗炎、抗病毒等多种生物活性[6]。土曲霉广泛存在于自然界中,常被从土壤的根际[7]、腐烂的有机物[8]和海洋环境[9]中分离出来,除能够产生降脂药洛伐他汀及其中间体外,土曲霉还能产生多种具有经济意义的次生代谢物。同一种菌,因来源不同,所处环境不同,其次生代谢产物亦不相同。本研究选取来源于南沙群岛海域海泥中分离得到的一株土曲霉为研究对象,并采用大米固体培养基进行大规模发酵,对其次生代谢产物进行分离纯化和结构鉴定,并进行低氧/复氧诱导的PC12细胞损伤的体外神经保护活性评价,以期发现结构新颖和活性较好的代谢产物,进一步丰富曲霉属真菌的次生代谢产物。
1 材料与方法
1.1 仪器和材料
质谱数据由Agilent 6500 Q-TOF质谱仪测定(美国安捷伦科技有限公司);旋光数据由Autopol II型自动旋光仪测定(美国鲁道夫公司);核磁数据由Bruker AV-500 MHz和AV-600 MHz核磁共振仪测定(美国布鲁克仪器有限公司),以TMS作为内标;分析型HPLC为Agilent 1260(美国安捷伦科技有限公司);制备型HPLC为EClassical P3500(大连依利特仪器有限公司);LDZM-60L高压灭菌锅(上海申安仪器有限公司);Enspire多功能酶标仪(美国珀金埃尔默仪器有限公司);IX71荧光显微镜(日本奥林巴斯株式会社);LSM800激光共聚焦(德国卡尔·蔡司有限公司);Sephadex LH-20凝胶(瑞典法玛西亚公司);D101大孔吸附树脂(天津浩聚树脂有限公司);柱层析硅胶200~300目(青岛海洋化工厂);HS-GF254薄层层析硅胶板(烟台江有硅胶开发有限公司);PC12细胞(批号:CL-0481,武汉普诺赛生命科技有限公司);RPMI 1640培养基(批号:61870036,美国赛默飞世尔科技有限公司,);Gibco胎牛血清(批号:10100147,美国赛默飞世尔科技有限公司);CCK-8试剂盒(批号:BA00208,北京博奥森生物技术有限公司);胰酶(批号:25200114,美国赛默飞世尔科技有限公司)。
1.2 菌种来源
菌株土曲霉是从中国南沙群岛海域海泥中分离纯化得到,其DNA扩增和ITS序列由北京擎科生物科技有限公司测定,并经过BLAST对比,发现与菌株Aspergillusterreus(Genbank accession No.MF152908.1)的18S rRNA序列和ITS序列99.31%相似,结合形态学特征,将该菌株鉴定为土曲霉,并保藏于湖南中医药大学附属第一医院医学创新实验中心(编号:CXJ-38)。
1.3 菌种的发酵与提取分离
将目标菌株接种到PDA平板上活化,室温下培养5~7 d,活化的真菌用刀片切取适量接种于马铃薯葡萄糖液体培养基中,在室温和150 r/min培养5 d后作为种子液。取500 mL锥形瓶50个,每瓶装100 g大米和100 mL水,于121 ℃灭菌30 min作为固体发酵培养基。向每瓶固体培养基中加入10 mL种子液,室温下,静置避光培养30 d。
固体发酵物用乙酸乙酯提取3次,减压浓缩得浸膏71 g。浸膏用大孔吸附树脂(D101)分段,分别用水、80%甲醇水、甲醇洗脱。80%甲醇水洗脱部位进一步用硅胶柱分离,分别用石油醚-乙酸乙酯-甲醇洗脱(10∶1∶0、7∶1∶0、5∶1∶0、2∶1∶0、1∶1∶0、1∶1∶0.2),合并后得10个组分(Fr.A~J)。组分Fr.D 通过凝胶柱色谱和半制备液相(40%甲醇水等度洗脱,流速3 mL/min)纯化得到化合物5(5.2 mg,tR=18.8 min)、6(3.8 mg,tR=21.2 min)、7(4.5 mg,tR= 24.0 min)和13(3.6 mg,tR= 25.7 min)。组分Fr.E通过凝胶柱色谱和半制备液相(25%甲醇水等度洗脱,流速3 mL/min,进样量为0.1 mL,检测器为VWD,检测波长为254 nm)纯化得到化合物10(2.5 mg,tR=10.6 min)、11(3.0 mg,tR=11.6 min)、12(3.5 mg,tR=13.0 min)。组分Fr.F 通过凝胶柱色谱和半制备液相(35%甲醇水等度洗脱,流速3 mL/min,进样量为0.1 mL,检测器为VWD,检测波长为254 nm)纯化得到化合物1(3.5 mg,tR=18.6 min)、3(3.2 mg,tR=23.8 min)和8(4.3 mg,tR=26.9 min)。组分Fr.G 通过凝胶柱色谱和半制备液相(30%甲醇水等度洗脱,流速3 mL/min,进样量为0.1 mL,检测器为VWD,检测波长为254 nm)纯化得到化合物2(3.3 mg,tR=19.2 min)、4(2.8 mg,tR=20.5 min)和9(3.6 mg,tR=25.4 min)。
1.4 神经保护活性评价
对化合物1~13进行低氧/复氧诱导的PC12细胞损伤保护作用的活性评价,取PC12细胞,在37 ℃、1640培养液、5% CO2培养箱中适应性培养,接种于24孔板中,培养24 h。将PC12细胞进行低氧/复氧处理后(缺氧3 h后,复氧同时给药干预24 h,给药剂量为1 μmol/L和0.1 μmol/L)。PBS轻轻润洗2次,每孔加入细胞固定液0.3 mL,室温固定细胞45 min。弃液,用PBS洗2次,每孔加入0.25%Triton-100液0.2 mL,室温处理10 min。弃液,用PBS洗2次,每孔加入0.2 mL Hoechst染色液(1∶400),室温浸染细胞15 min。弃液,PBS洗涤细胞3次,于激光共聚焦显微镜下观察细胞凋亡情况。通过CCK-8法检测细胞存活率,向每孔加入10 μL CCK-8溶液,混合均匀,在37 ℃孵育3 h,采用酶标仪检测各组细胞在450 nm下的吸光度。
1.5 统计学分析
采用SPSS 21.0软件进行数据处理,采用t检验确定显著性水平,若P<0.05则具有统计学意义。
2 实验结果
2.1 结构鉴定
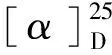
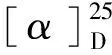
化合物3白色粉末;HR-ESI-MS:m/z383.146 8[M+H]+,分子式为C22H22O6;1H NMR(600 MHz,CD3OD)δ:7.45(2H,d,J=8.8 Hz,H-2′/H-6′),6.93(1H,d,J=8.3 Hz,H-6′′),6.92(1H,s,H-2′′),6.79(2H,d,J=8.8 Hz,H-3′/H-5′),6.65(1H,d,J=8.2 Hz,H-5′′),6.51(1H,s,H-4),3.75(2H,s,H-5),3.72(1H,dd,J= 7.3,5.4 Hz,H-8′′),2.92,(1H,dd,J=16.6,5.4 Hz,Ha-7′′),2.64(1H,dd,J=16.6,7.2 Hz,Hb-7′′),1.29(3H,s,H-10′′),1.22(3H,s,H-11′′);13C NMR(150 MHz,CD3OD)δ:175.3(s,C-1),125.3(s,C-2),158.5(s,C-3),100.0(d,C-4),30.1(t,C-5),122.6(s,C-1′),131.7(d,C-2′/C-6′),117.0(d,C-3′/C-5′),162.2(s,C-4′),130.6(s,C-1′′),130.3(d,C-2′′),121.4(s,C-3′′),152.9(s,C-4′′),118.1(d,C-5′′),128.3(d,C-6′′),32.1(t,C-7′′),70.5(d,C-8′′),77.9(s,C-9′′),25.8(q,C-10′′),21.1(q,C-11′′)。以上数据与文献[12]报道基本一致,其旋光值为零,推测为外消旋体,因此鉴定化合物为(±)-asperteretal F。
化合物4白色粉末;HR-ESI-MS:m/z365.164 3[M+H]+,分子式为C22H22NO4;1H NMR(500 MHz,CD3OD)δ:7.42(2H,d,J=8.7 Hz,H-2′/H-6′),6.83(1H,s,H-2′′),6.82(2H,d,J=8.7 Hz,H-3′/H-5′),6.81(1H,d,J=7.5 Hz,H-6′′),6.65(1H,d,J=7.7 Hz,H-5′′),5.24(1H,m,H-8′′),3.76(2H,s,H-6),3.20(1H,d,J=7.4 Hz,H-7′′),1.71(3H,s,H-10′′),1.65(3H,s,H-11′′);13C NMR(125 MHz,CD3OD)δ:174.1(s,C-2),139.4(s,C-3),138.4(s,C-4),174.8(s,C-5),29.5(t,C-6),121.5(s,C-1′),132.4(d,C-2′/C-6′),116.4(d,C-3′/C-5′),160.4(s,C-4′),129.6(s,C-1′′),130.3(d,C-2′′),129.4(s,C-3′′),154.7(s,C-4′′),115.9(d,C-5′′),127.5(d,C-6′′),28.9(t,C-7′′),123.7(d,C-8′′),133.3(s,C-9′′),17.8(q,C-10′′),25.9(q,C-11′′)。以上数据与文献[13]报道基本一致,因此鉴定化合物为asperimide A。
化合物5白色粉末;HR-ESI-MS:m/z405.263 0[M+H]+,分子式为C24H36O5;1H NMR(500 MHz,CDCl3)δ:5.97(1H,d,J= 9.6 Hz,H-4),5.76(1H,dd,J=9.6,6.0 Hz,H-3),5.51(1H,br s,H-5),5.36(1H,br d,J=3.4 Hz,H-8),4.61(1H,m,H-11),4.35(1H,m,H-13),2.72(1H,dd,J= 17.7,5.2 Hz,Hb-14),3.20(1H,d,J=17.7 Hz,Ha-14),2.44(1H,m,H-6),2.35(2H,m,overlapped,H-2/H-2′),2.25(1H,br d,J=12.3 Hz,H-8a),1.81~1.97(4H,m,overlapped,Hb-10,Hb-12,Ha-7,Hb-7),1.61~1.71(3H,m,overlapped,Hb-3′,H-1,Ha-12),1.34~1.51(3H,m,overlapped,Ha-9,Hb-9,Ha-3′),1.27(3H,m,Ha-10),1.09(3H,d,J=6.9 Hz,2′-CH3),1.06(3H,d,J=7.4 Hz,6-CH3),0.88(3H,d,J= 7.0 Hz,2-CH3),0.87(3H,t,J=7.5 Hz,H-4′);13C NMR(125 MHz,CDCl3)δ:36.7(d,C-1),30.8(d,C-2),14.0(q,2-CH3),133.2(d,C-3),128.4(d,C-4),131.7(s,C-4a),129.8(d,C-5),27.6(d,C-6),23.0(q,6-CH3),32.8(t,C-7),68.0(d,C-8),37.4(d,C-8a),24.4(t,C-9),33.1(t,C-10),76.5(d,C-11),36.2(t,C-12),62.7(d,C-13),38.7(t,C-14),170.7(s,C-15),177.1(s,C-1′),41.6(d,C-2′),26.9(t,C-3′),11.9(q,C-4′),16.4(q,2′-CH3)。以上数据与文献[14]报道基本一致,因此鉴定化合物为洛伐他汀。
化合物6白色粉末;HR-ESI-MS:m/z489.211 0[M+H]+,分子式为C26H32O9;1H NMR(600 MHz,CDCl3)δ:6.15(1H,s,6-OH),5.46(1H,s,Ha-22),5.08(1H,s,Hb-22),3.79(3H,s,H-1′),3.54(1H,s,H-14),2.95(1H,br d,J=13.9 Hz,Ha-11),2.69(1H,dd,J=19.1,8.5 Hz,Ha-2),2.52(1H,m,Hb-2),2.35(1H,m,Ha-1),2.26(1H,br d,J=14.4 Hz,Hb-11),1.93(3H,s,H-20),1.76(1H,m,Hb-1),1.71(3H,s,H-24),1.47(3H,s,H-23),1.47(3H,s,H-18),1.44(3H,s,H-19),1.21(3H,s,H-21);13C NMR(150 MHz,CDCl3)δ:28.0(t,C-1),32.6(t,C-2),214.1(s,C-3),47.8(s,C-4),131.5(s,C-5),138.6(s,C-6),196.9(s,C-7),52.3(s,C-8),77.5(s,C-9),43.0(s,C-10),34.8(t,C-11),139.7(s,C-12),49.4(s,C-13),44.5(d,C-14),167.7(s,C-15),85.4(s,C-16),201.4(s,C-17),21.1(q,C-18),23.5(q,C-19),19.7(q,C-20),18.5(q,C-21),117.1(t,C-22),23.3(q,C-23),21.2(q,C-24),168.5(s,C-25),53.7(q,25-OCH3)。以上数据与文献[15]报道基本一致,因此鉴定化合物为terretonin。
化合物7白色粉末;HR-ESI-MS:m/z466.160 5[M+H]+,分子式为C24H23N3O7;1H NMR(600 MHz,CD3OD)δ:9.23(1H,s,H-2′),8.83(1H,d,J=8.4 Hz,H-3),8.71(1H,d,J=3.9 Hz,H-4′),8.26(1H,d,J=8.0 Hz,H-6′),7.91(1H,d,J=7.8 Hz,H-6),7.61(1H,m,H-4),7.38(1H,dd,J= 7.8,4.7 Hz,H-5′),7.28(1H,s,H-6′′),7.24(1H,m,H-5),3.98(3H,s,4′′-OCH3),3.92(3H,s,3′′-OCH3),3.91(3H,s,5′′-OCH3),3.83(3H,s,7′′-OCH3);13C NMR(150 MHz,CD3OD)δ:120.1(s,C-1),140.1(s,C-2),121.5(d,C-3),133.4(d,C-4),123.6(d,C-5),127.7(d,C-6),168.0(s,C-7),130.4(s,C-1′),149.0(d,C-2′),152.3(d,C-4′),123.4(d,C-5′),135.0(d,C-6′),163.8(s,C-7′),118.8(s,C-1′′),125.5(s,C-2′′),148.6(s,C-3′′),146.6(s,C-4′′),151.2(s,C-5′′),108.5(d,C-6′′),167.0(s,C-7′′),61.0(q,3′′-OCH3),61.0(q,4′′-OCH3),56.2(q,5′′-OCH3),52.5(q,7′′-OCH3)。以上数据与文献[16]报道基本一致,因此鉴定化合物为methyl-3,4,5-trimethoxyl-2-(2-(nicotinamide)benzamido) benzoate。
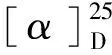
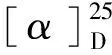
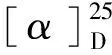
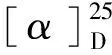
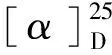
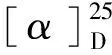
化合物1~13的化学结构见图1。
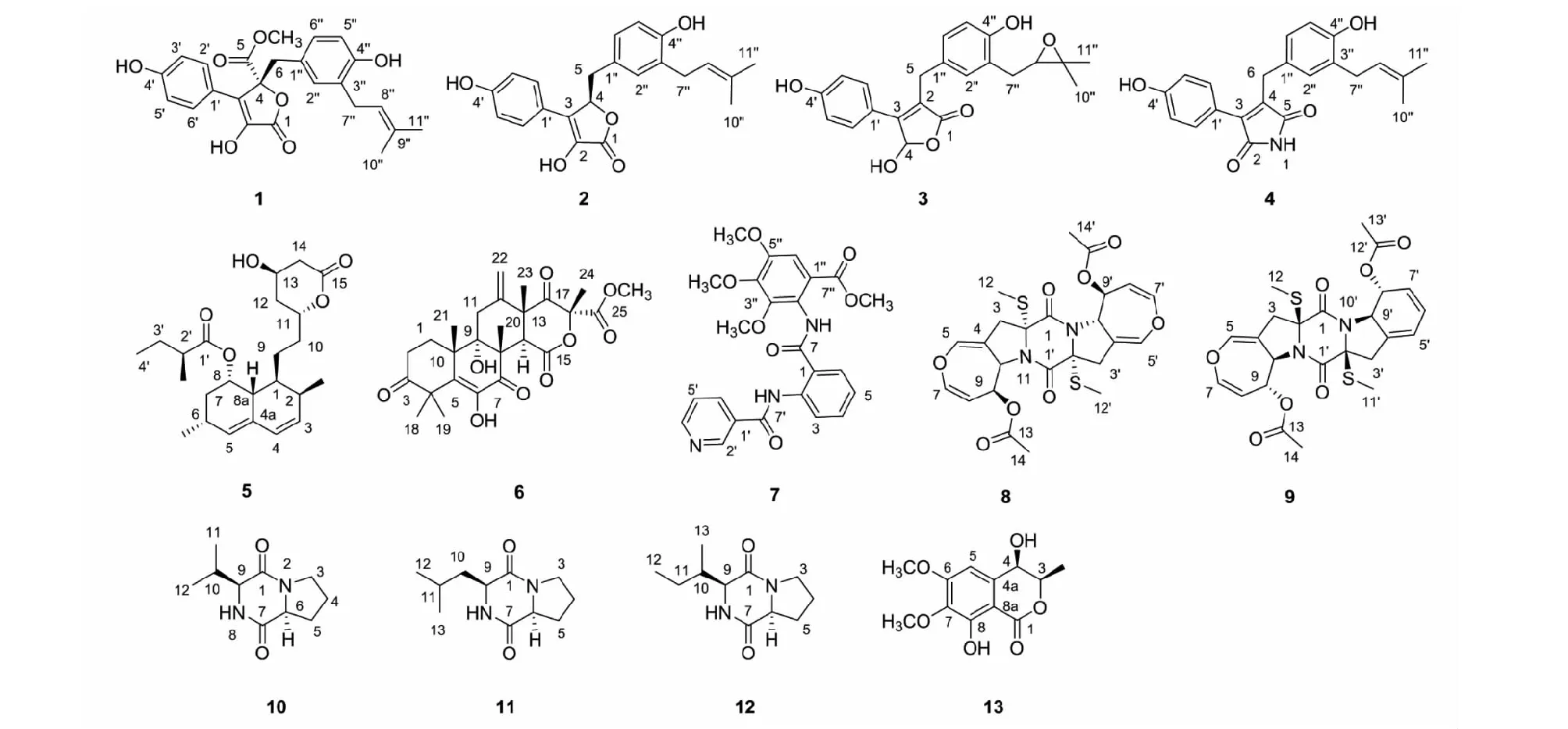
图1 化合物1~13的化学结构
2.2 活性评价结果
化合物1~13对低氧/复氧诱导的PC12细胞损伤的保护作用活性评价结果显示,与模型组相比,当药物浓度为1 μmol/L和0.1 μmol/L,化合物1、3、5、6和7能显著降低细胞凋亡率和提高细胞存活率,化合物8、12和13具有明显地抑制细胞生长和促使其凋亡的作用,均具有统计学意义(P<0.01);化合物2、9和11未表现出对细胞生长和凋亡的影响,无显著性差异(见图2和图3)。土曲霉次生代谢产物1、3、5、6和7能显著减少氧化应激产生的细胞损伤,呈现出一定的神经保护的活性。
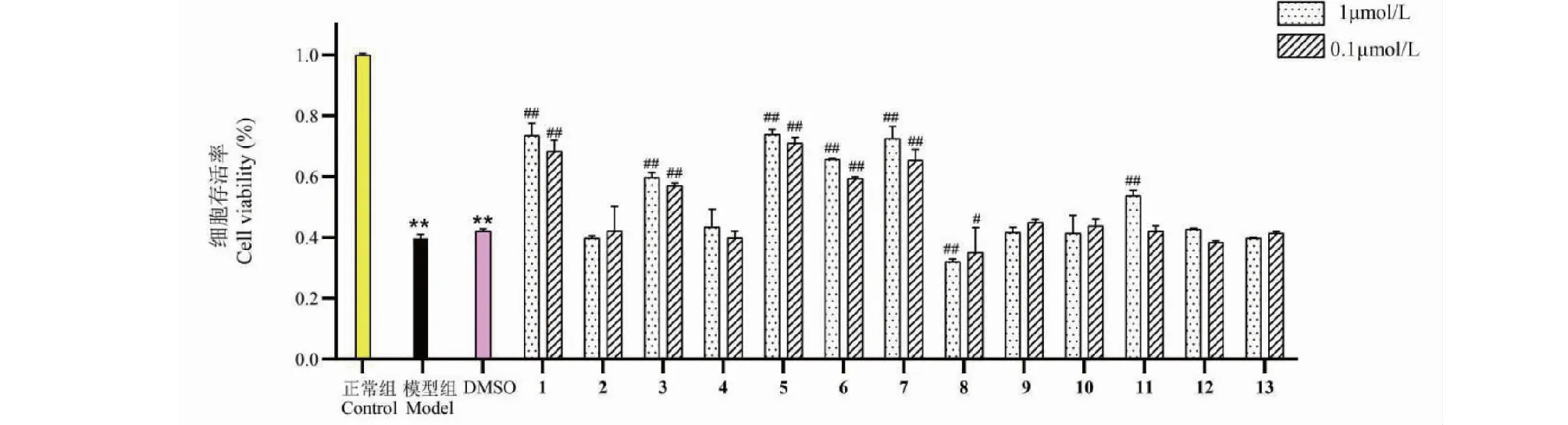
图2 不同浓度化合物1~13对OGD/R处理的PC12细胞活力的影响
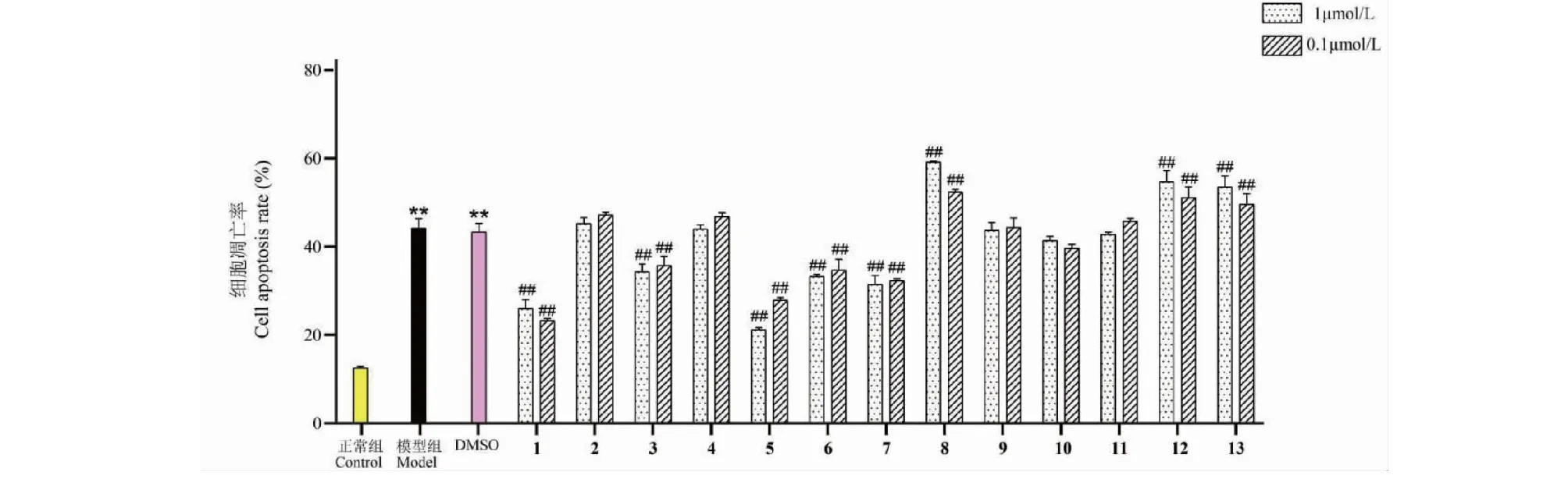
图3 不同浓度化合物1~13对OGD/R处理的PC12细胞凋亡的影响
3 结论
本研究利用大孔吸附树脂、硅胶、凝胶柱色谱及半制备液相等方法对海洋来源土曲霉的次生代谢产物进行了分离纯化,从中分离鉴定出13个化合物,其中化合物1~3是γ-丁内酯衍生物,化合物4是一类海洋天然生物碱马来酰亚胺(2,5-吡咯二酮)衍生物,化合物5是他汀类药物洛伐他汀,化合物6是萜类化合物,化合物7是苯甲酸甲酯类化合物,首次报道了它的核磁数据,化合物8~12是5个二酮哌嗪类化合物,其中化合物8和9为硫代二酮哌嗪,化合物13是苯并吡喃酮类化合物。初步的体外神经保护活性测试表明化合物1、3、5、6和7能显著减少氧化应激产生的细胞损伤,本文研究了土曲霉大米发酵物的次生代谢产物及单体化合物的神经保护活性,为后期深入挖掘土曲霉次生代谢产物的化学多样性提供了科学参考依据。

