γ-聚谷氨酸的制备及其酪氨酸酶抑制活性研究
李 想,吴金芳,韩冠英*
1锦州医科大学药学院,锦州 121000;2山东丰金生物医药有限公司,烟台 264000
均聚氨基酸一类的高分子聚合物具有生物学功能广泛、生物相容性和分子量分布分散等特性。目前通过微生物得到的均聚氨基酸主要包括三种:聚谷氨酸(聚-γ-谷氨酸,poly-γ-glutamic acid,γ-PGA)、ε-聚赖氨酸(ε-poly lysine,ε-PL)和藻青素(cyanophycin)[1]。γ-PGA作为其中的一种,同样具有其优良的生物学特性。从1913年起,研究人员相继从纳豆食品的黏液中和枯草芽孢杆菌(B.subtilis)、地衣芽孢杆菌(B.licheniformis)、巨大芽孢杆菌(B.megaterium)以及炭疽芽孢杆菌(B.anthracis)等的发酵培养基中分离得到了γ-PGA[2,3]。γ-PGA的构象结构随溶液的pH值、浓度和离子强度变化而显著变化。由枯草芽孢杆菌生产γ-PGA在酸性溶液中具有平行的β-折叠结构,在接近中性时具有无规则卷曲结构,在碱性环境中具有伸展的随机结构[4]。
γ-PGA成品为白色无味粉末状物质,其分子量在100~10 000 kDa之间,相当于50~50 000个左右的谷氨酸单体[5]。γ-PGA及其衍生物在诸多领域具广泛的研究及应用前景。如作为食品保鲜剂[6]、化妆品补水保湿成分[7]、药物缓释载体[8]、重金属吸附剂及用于水处理的絮凝剂[9]等。2013年,有研究学者发现,γ-PGA通过降低B16细胞内活性氧和一氧化氮水平,提高过氧化氢酶活性,抑制Forsklin诱导的酪氨酸酶活性和黑素生成。这是首次报道γ-PGA的抗黑素化作用。
分子量是聚合物的重要特征参数,分子量的大小决定其应用领域和应用效果[10]。因此,为了扩展γ-PGA的应用范围制备不同分子量γ-PGA,并研究不同分子量之间的活性差异具有重要意义。目前,微生物发酵法是常用的γ-PGA发酵方法。采用该法制备所得的γ-PGA分子量及产量受产生菌的影响。根据发酵过程中是否添加谷氨酸,将γ-PGA的生产菌株分为谷氨酸依赖性菌株和非谷氨酸依赖性菌株两类。有研究表明采用谷氨酸依赖型菌株作为产生菌,γ-PGA产量更高[11]。因此,本文以枯草芽孢杆菌为发酵菌株,通过微生物发酵法生产γ-PGA。结合化学降解手段制备了五组不同分子量的γ-PGA,并对其胞内胞外抑制酪氨酸酶活性进行了研究。为不同分子量的γ-PGA作为美白剂在化妆品领域的应用奠定基础。
1 材料与方法
1.1 材料与仪器
枯草芽孢杆菌(Bacillussubtilis),山东丰金生物医药有限公司提供;酵母提取物(yeast extract,YE,100%,批号4345161-02,OXIOD);谷氨酸钠(纯度99%,批号C13501406,上海Macklin公司);MgSO4·7H2O(AR,批号20200827,天津市永大化学试剂制造有限公司);K2HPO4(AR,批号B2109241,西陇科学股份有限公司);琼脂粉(BR,批号20190706,青岛海博生物技术有限公司);氯霉素(纯度99%,批号No.821G046,北京Solarbio公司);酪氨酸酶(500 units/mg,批号C14384601,上海Macklin公司);Na2SO4(纯度99%,批号L2117166,上海Aladdin公司);左旋多巴(纯度99%,批号C14100281,上海Macklin公司);L-酪氨酸(纯度99%,批号C13364528,上海Macklin公司);B16-F10小鼠黑色素瘤细胞,中国科学院细胞库;胎牛血清(批号P2104403,上海泰坦科技股份有限公司);DMEM培养基(批号2428676,美国Gibco公司);青霉素-链霉素双抗(批号2441834,美国Gibco公司);PBS磷酸盐缓冲液(AR,批号No.20220728,北京Solarbio公司);0.25%胰蛋白酶(批号No.20221009,北京Solarbio公司);MTT(纯度99%,批号NO.530R058,美国Gibco公司);Triton X-100(纯度98%,批号No.404R022JH,北京Solarbio公司);曲酸(纯度99%,批号RH328769,北京Solarbio公司); 葡萄糖(AR,批号20150630,国药集团);NaOH(AR,批号20211102,国药集团);DMSO(AR,批号20220614,国药集团);无水乙醇(AR,批号20210518,国药集团)。
Vi-CELL XR型细胞计数仪(美国Beckman Coulter公司);超声波细胞粉碎机(宁波新芝生物科技有限公司);酶标仪(美国Molecular-Devices公司);HPLC(美国Waters公司);凝胶渗透色谱仪(英国Malvern公司)。
1.2 实验方法
1.2.1γ-PGA发酵工艺
以枯草芽孢杆菌为产生菌,以一定比例配制固体、种子及发酵培养基,通过菌种的平板活化、液体种子摇瓶、液体发酵摇瓶,得到γ-PGA发酵液。通过无水乙醇沉淀后,经进一步纯化除杂,最终得到固体γ-PGA。
1.2.2 培养基组分及培养方法
固体培养基:葡萄糖 25 g/L,谷氨酸钠 10 g/L,YE 15 g/L,MgSO4·7H2O 0.25 g/L,K2HPO42 g/L,琼脂 20 g/L;种子培养基:葡萄糖 25 g/L,谷氨酸钠 10 g/L,YE 15 g/L,MgSO4·7H2O 0.25 g/L,K2HPO42 g/L;发酵培养基:葡萄糖 25 g/L,谷氨酸钠 10 g/L,YE 15 g/L,MgSO4·7H2O 0.25 g/L,K2HPO42 g/L;pH 6.8~7.0;装液量40%;灭菌条件:121 ℃高温高压湿热灭菌20 min,其中葡萄糖需单独灭菌,待灭菌完成后取出与其他成分混合均匀,在固体、种子及发酵培养基中分别加入氯霉素抗性至终浓度为10 μg/mL。
培养方法:按照“Z”字划线法将菌种划在固体培养基上,在37 ℃的生化培养箱中恒温倒置培养14 h。挑单菌落至装有种子培养基的摇瓶中,在37 ℃,200 r/min的培养条件下,恒温振荡培养18 h,达到对数生长期得到种子培养液。以5%的接种量将种子培养液接种至装有发酵培养基的摇瓶中,相同培养条件下,接续恒温振荡培养24 h,得到γ-PGA发酵液。
1.2.3 产物纯化与表征
1.2.3.1 产物纯化
将γ-PGA粗品按照一定比例复溶于水溶液中,调节pH为5.0,以30 g/L加入活性炭搅拌混匀,50 ℃水浴保温2 h,在1 000 r/min、20 min的条件下离心去除活性炭,经500目硅藻土、200目珍珠岩吸附除杂,再经0.45 μm滤膜过滤后,加入无水乙醇沉淀,4 ℃静置过夜,去上清,加无水乙醇反复脱水2次后,过滤收集沉淀,60 ℃烘干至恒重,得到γ-PGA纯品。
1.2.3.2 产物表征
参考Kambourova等[12]的方法,采用薄层色谱法,通过分析产物完全水解后的单体进行产物鉴别。精确称取0.5 g干燥的γ-PGA纯品,放入具塞试管中,然后加入10 mL 6 mol/L的HCl,振荡使其充分混匀,密封,110 ℃水解24 h,待其冷却后调pH至6.8,定容至100 mL,配制成5 mg/mL的样品水解液。另外分别取0.5 g干燥的谷氨酸标准品和γ-PGA纯品,用纯化水充分溶解,定容至100 mL,配制成5 mg/mL的谷氨酸标准品溶液和样品溶液。
本实验中,采用酸性溶剂系统。展层剂的配置比例为正丁醇∶80%甲酸∶水=15∶3∶2(V/V/V)。在薄层层析硅胶板板上依次等距离点样样品溶液、谷氨酸标准溶液及样品水解液,冷风吹干,反复点样三次。展层50~60 min,以0.1%茚三酮-丙酮溶液做显色剂均匀喷洒层析板,热风吹干对比氨基酸斑点。
1.2.4γ-PGA产量测定
采用干重法测定产量,向等量的γ-PGA发酵液中,加入4倍体积无水乙醇沉淀,4 ℃静置过夜后抽滤取沉淀,60 ℃烘干至恒重称量,计算产量。
1.2.5γ-PGA纯度测定
以Na2SO4作为流动相,以含量高于99% 的γ-PGA作为标准品,对不同含量γ-PGA标准溶液紫外吸收值进行检测。在检测柱温为30 ℃,检测波长为210 nm,流速为0.5 mL/min,进样量20 μL的色谱条件下,采用高效液相色谱法测定,记录峰面积,并根据标准曲线计算得到样品溶液中γ-PGA的浓度(c),以质量分数表示的γ-PGA含量按照公式(1)计算。
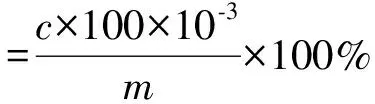
(1)
式中,c:根据标准曲线计算得到的样品溶液中γ-PGA的浓度,g/L;100:γ-PGA样品溶解的体积,mL;m:精确称取的γ-PGA样品的质量,g。
1.2.6γ-PGA降解
γ-PGA的结构易受温度和pH值的影响。因此,采用高温酸降的方式降解γ-PGA。配制4%的γ-PGA水溶液调节pH值为3.0,将其置于90 ℃的水浴锅中进行酸性条件下的高温降解,分别降解15、30、45、60、75、90、105和120 min,降解结束后迅速冰浴使样品冷却至室温,调pH至中性(6.8~7.2),加4倍无水乙醇,以500 r/min的转速边搅拌边加醇,沉淀静置2~4 h,弃上清后再加2倍无水乙醇进行脱水,过滤收集沉淀,于60 ℃烘干至恒重以除去乙醇残留,收集沉淀样品。
1.2.7γ-PGA分子量测定
以0.3 mol/L Na2SO4作为流动相,通过窄分布标准品获取仪器常数,宽分布标准品验证仪器常数。在检测柱温为30 ℃,流速为0.5 mL/min,进样量100 μL的条件下通过检测γ-PGA样品在示差折光检测器下的出峰时间,利用GPC测定γ-PGA样品的分子量。
1.2.8 不同分子量γ-PGA胞外酪氨酸酶活性抑制率的测定
人体内各类色素分布情况是影响人体皮肤正常状态的主要因素之一,其中黑色素的合成、分泌、转移以及脱落对于皮肤状态发挥着尤为重要的影响[13]。而酪氨酸酶是黑色素的合成途径中的关键酶。酪氨酸酶(tyrosinase,TYR)是一种活性中心包含3个组氨酸(His)残基和2个Cu离子的多功能酶,广泛存在于真菌、植物和动物中。它不仅可以氧化酪氨酸形成多巴,也可以继续氧化多巴形成多巴醌。多巴醌是一种高活性的物质,它可以和氨基酸或蛋白质发生反应形成高分子复合物或褐色素,最终形成黑色素。在TYR参与催化反应过程中,两步催化反应分别体现了酪氨酸酶单酚酶和二酚酶活性。
1.2.8.1 胞外酪氨酸酶活性抑制率的测定
参考Wang[14]的方法。将5组不同分子量的γ-PGA用0.05 mol/L PBS缓冲液配成10 mg/mL的样品溶液,酪氨酸酶提前温浴5 min后,按照表1依次添加各组分,其中A1为空白背景组、A2为空白组、A3为样品背景组、A4样品组。28 ℃水浴恒温10 min后,利用酶标仪测定其在475 nm处的吸光度值,酪氨酸酶的抑制率按照公式(2)进行计算。
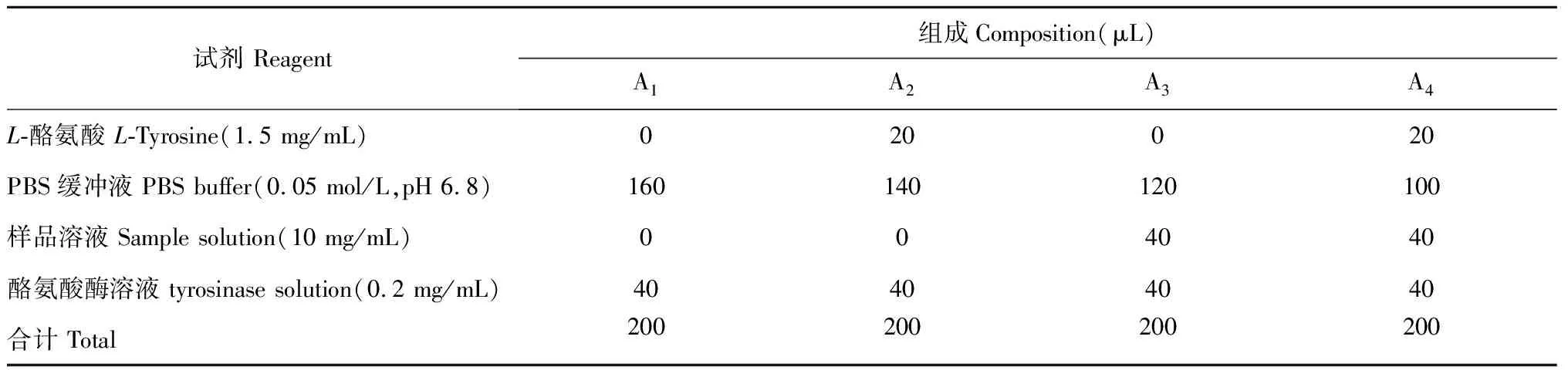
表1 酪氨酸酶活性抑制率测定
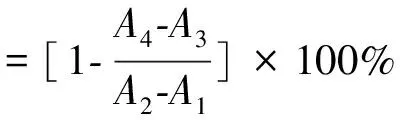
(2)
1.2.8.2 胞外酪氨酸单酚酶抑制率测定
参考Chen等[15]的方法并稍做改动测定酪氨酸酶单酚酶抑制率。用0.05 mol/L PBS缓冲液将5组不同分子量的γ-PGA配成10 mg/mL的样品溶液,采用200 μL的反应体系,酪氨酸酶溶液提前温浴5 min后,按照表2依次加入除酪氨酸酶溶液以外的各组分,酶标仪恒温28 ℃,加入酪氨酸酶溶液后立刻在475 nm处连续测定吸光度值直至稳定不变。其中(A4-A3)为添加样品的吸光度曲线,(A2-A1)为未添加样品的吸光度曲线。反应速率恒定阶段的直线与横轴截距为迟滞时间。酪氨酸单酚酶抑制率按照公式(3)计算。
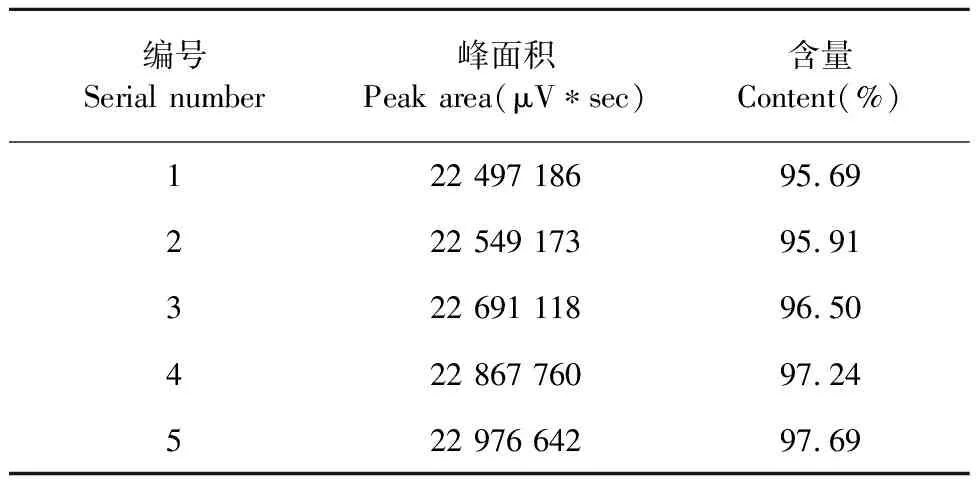
表2 降解产物含量测定
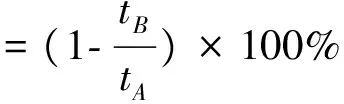
(3)
式中,tA:添加样品的迟滞时间,min;tB:未添加样品的迟滞时间,min。
1.2.8.3 胞外酪氨酸二酚酶抑制率测定
参考Ochiai等[16]的方法并稍做改动。用0.05 mol/L PBS缓冲液将5组不同分子量的γ-PGA配成10 mg/mL的样品溶液,将表2中单酚酶的反应底物L-酪氨酸置换为二酚酶的反应底物左旋多巴,其余组分和条件保持不变,测定酪氨酸酶二酚酶抑制率。酶标仪恒温28 ℃,加入酪氨酸酶溶液后立刻在475 nm处连续测定吸光度值直至稳定不变。以每分钟475 nm处吸光度值变化表示反应速率。酪氨酸二酚酶抑制率按照公式(4)计算。
(4)
式中,VA:添加样品的反应速率;VB:未添加样品的反应速率。
1.2.9 不同分子量γ-PGA胞内酪氨酸酶活性抑制率的测定
B16-F10细胞是小鼠黑色素瘤细胞,呈上皮细胞样,贴壁生长。因其与人体黑色素细胞的结构和生理活动相似,相比人体黑色素细胞更易培养,因此被用于美白活性物质的细胞评价模型。
1.2.9.1 B16-F10细胞毒性试验
参考Wu[17]的方法并稍作改动。采用MTT法对不同分子量γ-PGA的细胞毒性进行测定,以得到后续细胞实验的安全浓度范围。取对数生长期的B16细胞,以1×104个/孔的密度接种于96孔板,每孔100 μL,置于37 ℃、5% CO2的培养箱中静置培养24 h,使细胞完全贴壁。移去旧培养基,加PBS清洗两遍,加入由含有0.1%DMSO培养基稀释的不同浓度的样品溶液,空白组及阳性对照组由培养基和曲酸替代,置于37 ℃培养箱中继续培养24 h。移去旧培养基后,向各孔内加入以培养基稀释的5 mg/mL的MTT溶液10 μL和90 μL的新培养基,继续在37 ℃培养箱中孵育2 h,弃去旧培养基后,向各孔中加入150 μL的DMSO溶剂,震荡10 min,使紫色甲臜晶体完全溶解。采用酶标仪在490 nm波长处测定96孔板中每孔细胞的吸光度值,设定空白组细胞存活率为100%,细胞存活率按公式(5)计算。

(5)
1.2.9.2 抑制B16细胞内酪氨酸酶活性实验
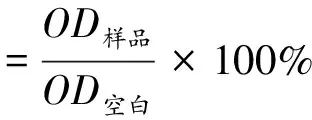
为了测定样品对B16细胞内TYR活性的抑制能力,采用酪氨酸形成多巴醌的速率对细胞内的TYR活性进行评价[18]。取对数生长期的B16细胞,以1×104个/孔的密度接种于96孔板,每孔100 μL,置于37 ℃、5% CO2的培养箱中静置培养24 h,使细胞完全贴壁。移去旧培养基,加PBS清洗,加入由培养基稀释的不同浓度的样品溶液,以曲酸为阳性对照,空白组用培养基替代,37 ℃培养箱中孵育24 h。向各孔内加入10 μL的1 mg/mL的L-酪氨酸溶液和90 μL含1%体积分数的TritonX-100溶液。超声破碎7 min(功率20%,超声3 s,间隔10 s,重复30次)。37 ℃水浴1 h后,采用酶标仪测定各孔在475 nm处的吸光度值,细胞内的TYR活性抑制率按照公式(6)计算。
(6)
1.3 数据处理
使用SPSS 27.0软件对数据进行单因素显著性分析(ANOVA),P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 产物表征
γ-PGA属于均聚氨基酸的一种,其由单一氨基酸,即谷氨酸聚合而成。因此采用薄层色谱法对产物进行表征,通过上行展开法,从左至右依次点样γ-PGA样品溶液、谷氨酸标准溶液和γ-PGA样品水解液,显色结果如图1所示,水解前γ-PGA样品溶液显色后无层析斑点,水解后的样品水解液与谷氨酸标准溶液在同一水平上有且只有一个层析斑点,说明γ-PGA水解后只含有谷氨酸一种氨基酸,充分说明了γ-PGA是由谷氨酸聚合而成。

图1 薄层层析结果
2.2 γ-PGA产量测定
采用干重法进行产量测定,取发酵液加入一定体积倍数的无水乙醇,置于4 ℃静置过夜,经重复脱水2次后,过滤取沉淀,60 ℃烘干至恒重称量,计算产量。
2.3 γ-PGA纯度测定
采用高效液相色谱法测定γ-PGA样品的含量。首先以标准溶液中γ-PGA的浓度为横坐标,峰面积为纵坐标绘制标准曲线如图2所示,测定γ-PGA样品峰如图3所示。将峰面积代入公式计算得γ-PGA样品的含量为97.69%。
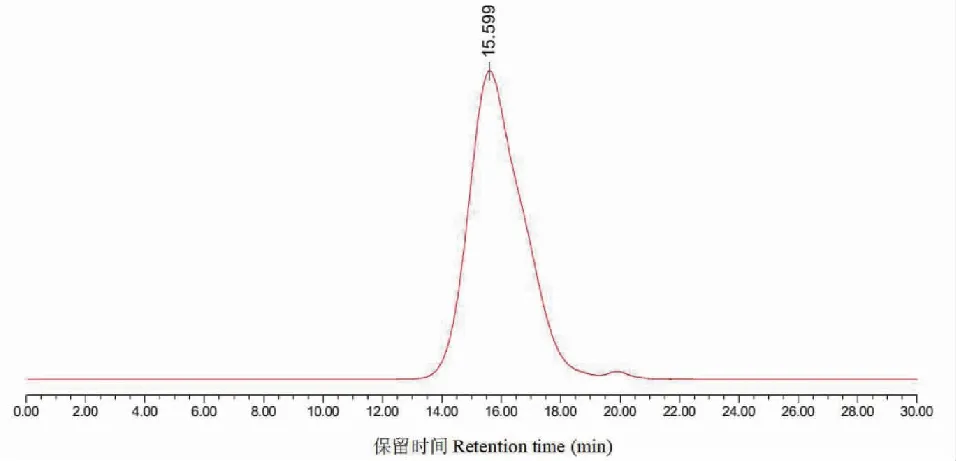
图3 γ-PGA样品紫外检测色谱图
2.4 γ-PGA降解产物纯度测定
采用HPLC法对5组降解产物进行了含量测定。具体方法同上。测定5组降解产物含量如表2所示。点
2.5 γ-PGA降解产物分子量测定
采用GPC法,使用凝胶色谱柱,利用空间排阻原理,分子量大的先流出,对5组降解产物进行了重均分子量测定。测定5组降解产物分子量如表3所示。
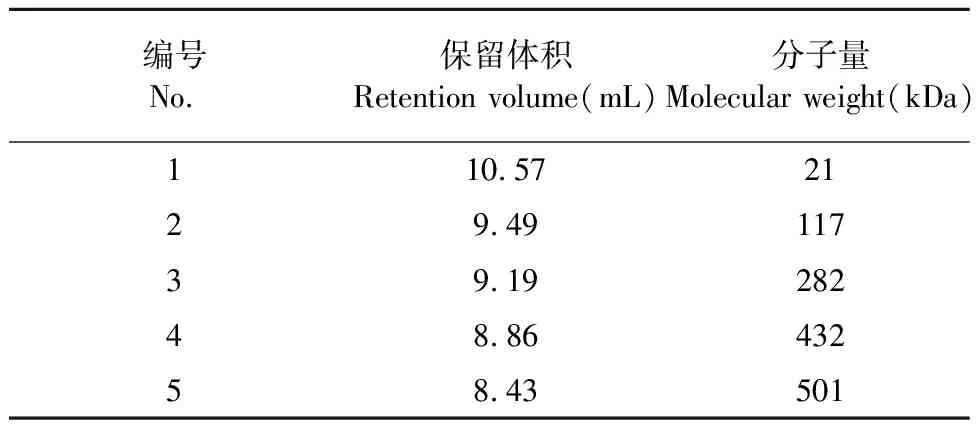
表3 降解产物的分子量分布
2.6 不同分子量γ-PGA胞外酪氨酸酶活性抑制率的测定
2.6.1 胞外酪氨酸酶活性抑制率的测定
由图4可知,γ-PGA对蘑菇酪氨酸酶的抑制效果随分子量的增加而增大,抑制率随作用时间的增加,呈现先升高后逐渐降低至平缓状态,在10 min时抑制效果明显,分子量由低到高,γ-PGA对蘑菇酪氨酸酶的抑制率分别达到15.61%、41.08%、63.05%、79.57%和90.97%。
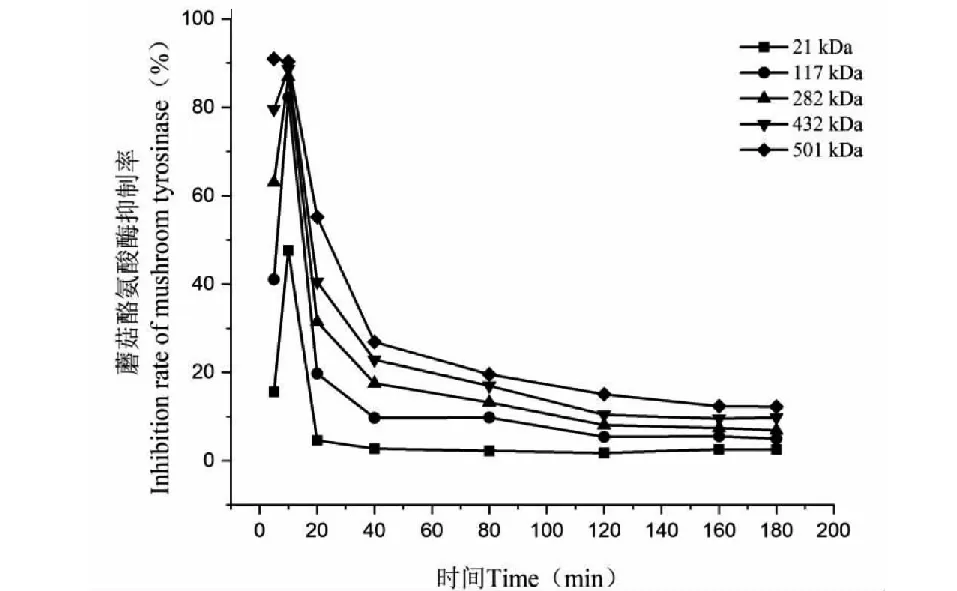
图4 不同分子量γ-PGA对蘑菇酪氨酸酶的抑制效果
2.6.2 胞外酪氨酸单酚酶抑制率的测定
以L-酪氨酸为底物,测定5组分子量的γ-PGA样品抑制酪氨酸单酚酶的活性。迟滞效应是单酚酶的特征反应,以直线反应部分外推与横轴的截距表示迟滞时间,迟滞时间越长,表示样品抑制单酚酶的活性越强。由图5A可知,随着γ-PGA分子量的增加单酚酶活力逐渐减弱且均弱于空白曲线,表示5组分子量的γ-PGA均具有一定的抑制效果且迟滞效应越来越明显。如图5B所示,5组样品的迟滞时间随分子量的增大而增加,表示γ-PGA抑制酪氨酸单酚酶的活性随分子量的增加而增大。
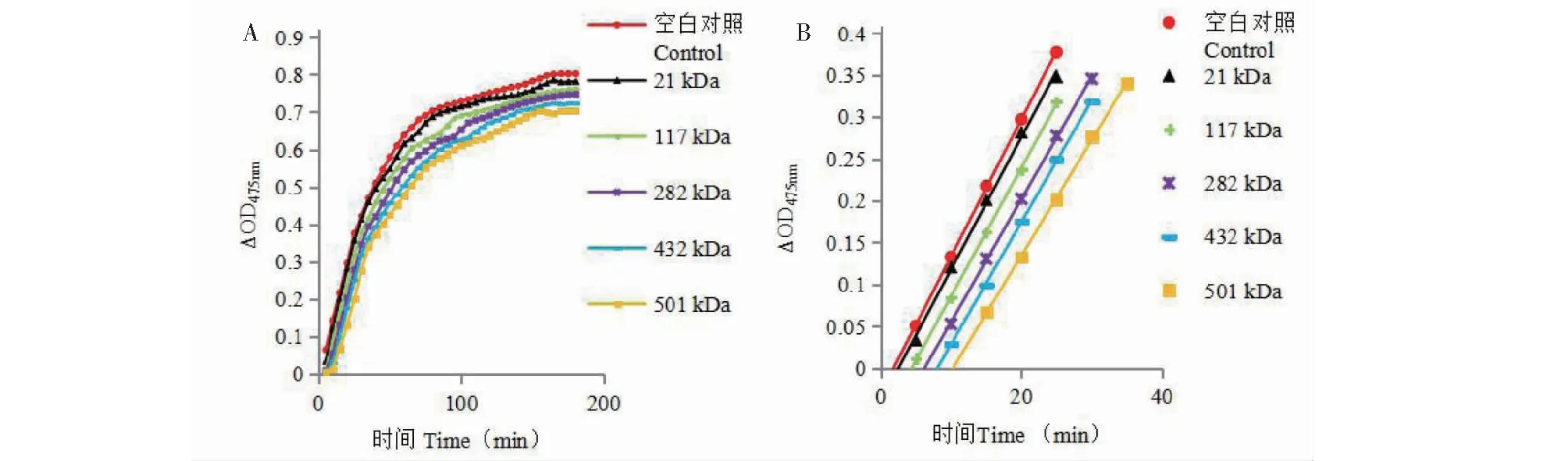
图5 不同分子量γ-PGA对酪氨酸单酚酶的抑制效果
2.6.3 胞外酪氨酸二酚酶抑制率的测定
以左旋多巴为底物,测定5组分子量的γ-PGA样品抑制酪氨酸二酚酶的活性。二酚酶的抑制效果通过催化反应速率进行表征,以直线反应部分的斜率表示反应速率,反应速率越慢,表示样品抑制二酚酶的活性越强。由图6A可知,随着γ-PGA分子量的增加二酚酶活力逐渐减弱且均弱于空白曲线,表示5组分子量的γ-PGA均具有一定的抑制效果且反应速率逐渐降低。如图6B所示,5组样品的反应速率随着分子量的增大而降低,表示γ-PGA抑制酪氨酸二酚酶的活性随分子量的增加而增大。
图6 不同分子量γ-PGA对酪氨酸二酚酶的抑制效果
2.7 不同分子量γ-PGA胞内酪氨酸酶活性抑制率的测定
2.7.1 B16-F10细胞毒性实验
为了更加准确地测定不同分子量γ-PGA的皮肤美白效果,使其可以作为美白活性物质解决色素沉积等问题,确保其使用安全性是研究的首要前提。因此,本研究采用MTT法对不同分子量γ-PGA作用于B16细胞的安全浓度进行了实验,为后续实验的进行奠定基础。以曲酸作为阳性对照,本实验共设立了5种样品浓度(0.05、0.1、0.5、1和5 mg/mL)进行测定。
如图7所示,5组分子量的γ-PGA对B16细胞存活率的影响无明显差别,但在分子量增大至501 kDa时,在5 mg/mL的浓度下细胞存活率出现明显降低。而当样品浓度低于或等于1 mg/mL时,5组分子量γ-PGA的作用下,细胞存活率均超过90%,对B16细胞无明显毒性,因此,以低于或等于1 mg/mL作为后续实验的安全浓度范围。
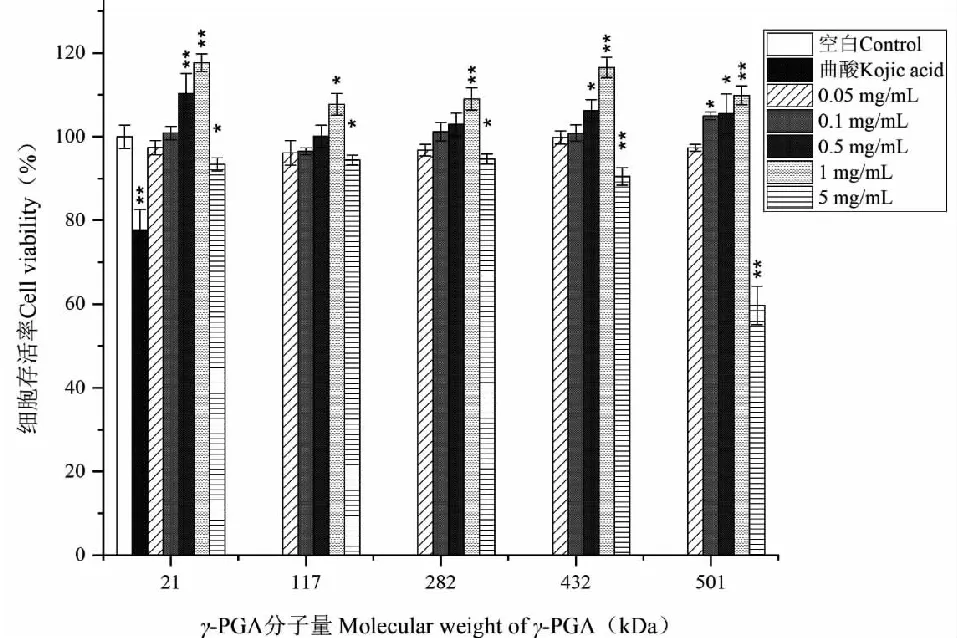
图7 不同分子量γ-PGA的B16细胞毒性
2.7.2 抑制B16细胞内酪氨酸酶活性实验
如图8所示,经5组分子量γ-PGA处理后,细胞内TYR活性均显著降低,且不引起细胞毒性。其中21 kDa的γ-PGA在0.05 mg/mL的浓度下,对细胞内TYR的抑制率最高,达到41.77%。
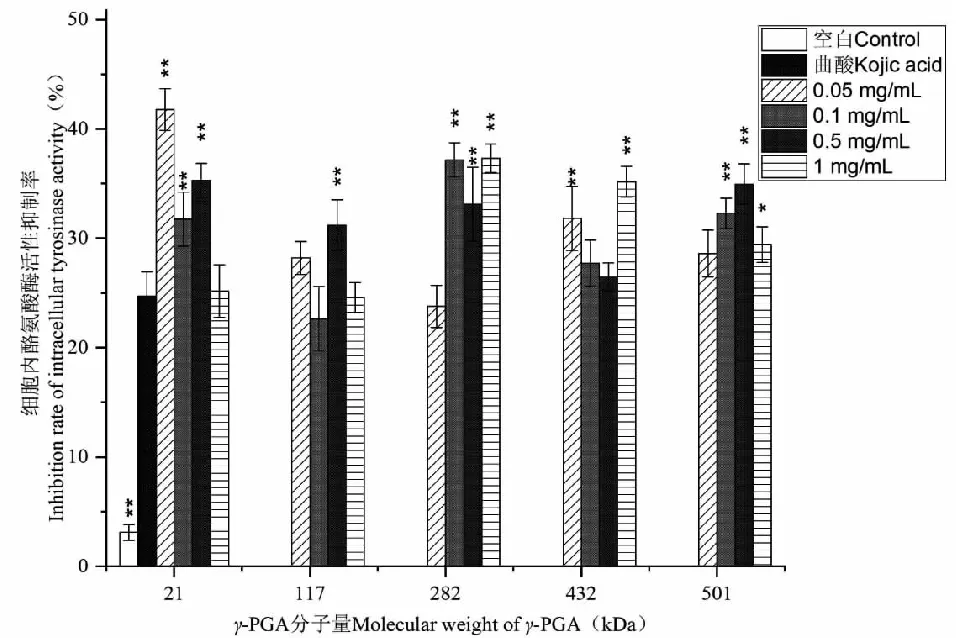
图8 不同分子量γ-PGA对B16细胞内酪氨酸酶活性的影响
3 讨论与结论
γ-PGA是一种胞外分泌型产物。长期以来人们对其性质、产生菌改良和基因特性、发酵过程以及提取纯化进行了大量研究[19-22]。γ-PGA的分子量直接影响着其在诸多领域中的应用[23]。随着研究人员发现γ-PGA具有抗黑素化的作用,γ-PGA逐渐成为了一种潜在的美白剂成分。
减少黑色素的生成量是发挥美白效果的关键一步。积累的研究表明,酪氨酸酶是参与黑色素生成过程中的重要限速酶,其表达水平和活性决定着黑色素合成的速度和产量[24]。因此,其抑制剂通常被筛选为美白剂。2004年Sasaki等[25]发现金属硫蛋白可通过直接抑制黑素体中的酪氨酸酶活性,有效抑制NO和其他黑素原刺激的黑素生成。2013年Jeong等[26]发现人参皂苷Rh4苷元(A-Rh4)通过蛋白激酶A途径抑制了B16黑色素瘤细胞的黑色素合成。在黑素合成中观察到酪氨酸酶活性增加,它的下调可以抑制黑素生成。因此,寻找具有抗酪氨酸酶活性的天然生物材料已被认为是开发新的皮肤色素沉着调节产品的重要策略。
本文选用谷氨酸依赖型杆菌-枯草芽孢杆菌作为菌种发酵制备γ-PGA,γ-PGA的产量为8 g/L,含量为97.69%。利用其在结构上对物理化学条件敏感的特性,结合化学降解手段,制备了重均分子量依次为21、117、282、432和501 kDa五组不同分子量的γ-PGA。为保证细胞生物安全性,对细胞可使用的安全浓度范围首先进行了评估。后以酪氨酸酶活性抑制率为指标,测定了五组不同分子量的γ-PGA在胞内及胞外的酪氨酸酶活性抑制率。综合细胞毒性和酪氨酸酶的抑制活性结果显示,5组分子量的γ-PGA均具有酪氨酸酶活性抑制作用,且胞外对酪氨酸酶的抑制活性随分子量的增加而增大,为未来γ-PGA作为潜在美白成分的应用提供理论基础。
通过微生物发酵法制备的γ-PGA分子量是有限的。Jiang等[27]通过构建了一种含γ-PGA降解酶基因簇pgsBAE的重组枯草芽孢杆菌,能够合成低分子量(约10 kDa)的γ-PGA。乔长盛等采用发酵罐发酵,通过调控发酵过程,优化发酵条件,制备了1 000 kDa的γ-PGA。因此,下一步,可结合基因工程等手段通过导入降解酶或合成酶的关键基因片段构建工程菌株以制备更高或更低分子量的γ-PGA,以进一步研究其美白活性。
目前,已有天然成分作为美白剂添加在化妆品配方中使用,常见的包括曲酸、熊果苷、烟酰胺、虾青素以及水杨酸、果酸等,不同的美白成分因其发挥美白作用机制的不同,其美白活性也不同,相同的美白成分,因其添加的浓度不同,其在化妆品中发挥的作用也有所差异。因此,通过对不同分子量聚谷氨酸美白活性的研究,不仅为化妆品领域提供了一个潜在的美白成分,并且根据不同分子量之间发挥美白活性的差异,或可添加到化妆品配方中发挥不同的效果,适配不同的人群,满足不同人群所需的美白效果。未来,通过改进天然提取物的提取技术,可以对提取物的活性成分进行定性和定量分析,确定活性成分的作用,并找到在自然生物中具有最佳美白效果的活性物质[28,29]。

