基于不同配体的NSE检测方法研究进展
梁展玮,彭 涛,胡亚琳,屈子裕,路 欣,焦学诗玛,王一楠,俞晓平
(1.中国计量大学 生命科学学院,浙江 杭州 310018;2.中国计量科学研究院,北京 100029;3.长春市计量检定测试技术研究院,吉林 长春 130012)
肺癌号称“第一癌症杀手”,分为小细胞肺癌和非小细胞肺癌两大类,具有隐匿性强、恶化程度高、预后差等特点,是目前全球死亡率最高的恶性肿瘤疾病。血清肿瘤标志物的检测具有取样方便、检测快捷、创伤小等特点,在恶性肿瘤诊断和预后等方面应用广泛。临床检验与研究中,常用的肺癌血清标志物包括癌胚抗原(CEA)、细胞角蛋白19片段(CYFRA21-1)、糖类抗原125(CA-125)、鳞状细胞癌抗原(SCC)和神经元特异性烯醇化酶(NSE)。其中,NSE是目前诊断小细胞肺癌最可靠的血清肿瘤标志物,同时在肺癌的发展监测、预后判断和疗效评估等方面也具有重要的参考价值。
1 NSE的基本性质
脊椎动物体内存在3种烯醇化酶亚基,包括主要存在于肝肾组织、肌肉组织、神经组织的α亚基、β亚基和γ亚基,3种亚基以二聚体形式组成了5种不同的烯醇化酶同工酶。其中,特异性存在于神经元和神经内分泌细胞中的αγ、γγ型同工酶为神经元特异性烯醇化酶(NSE)[1]。
NSE是一种蛋白质大分子物质,具有相对分子质量(约78 000 u)、酸性强、性质稳定、催化活性及在正常人体液中含量极低等特点[2-3]。它是一种“金属活化的金属酶(辅因子为Mg2+)”[4],能够在糖酵解途径中催化2-磷酸-D-甘油酸(PGA)脱水为磷酸烯醇丙酮酸(PEP),以及催化糖异生中PEP水合为PGA。糖酵解可以为神经元提供足够的能量以维持神经元代谢,因此NSE几乎存在于所有类型的神经元中[5]。
NSE是神经元、外周神经内分泌组织、胺前体摄取和脱羧细胞的高度特异性标志物,体液和组织中NSE水平升高可能伴随这些组织的恶性增殖。虽然NSE作为一种通用的神经内分泌标志物并不能区分不同亚型的神经内分泌肿瘤(NETs),但其升高与肿瘤分化不良有关[6-9]。NSE是目前诊断小细胞肺癌(SCLC)的首选肿瘤标志物,75%的SCLC患者伴有NSE水平升高[10],NSE在非小细胞肺癌(NSCLC)[11]、NET[12]、神经母细胞瘤[13]、肾细胞癌[14]等肿瘤病理条件下也有表达(表1)。此外,NSE已被证明可作为脑损伤的潜在候选生物标志物,例如脑缺血[15-16]、脑出血[17]、癫痫发作[18]、心肺后昏迷患者心脏骤停[19-20]和创伤性脑损伤的恢复[21-23]等。因此,准确定量检测体液中NSE水平,对肺癌等疾病的临床诊断、发展程度和治疗效果有重要意义。
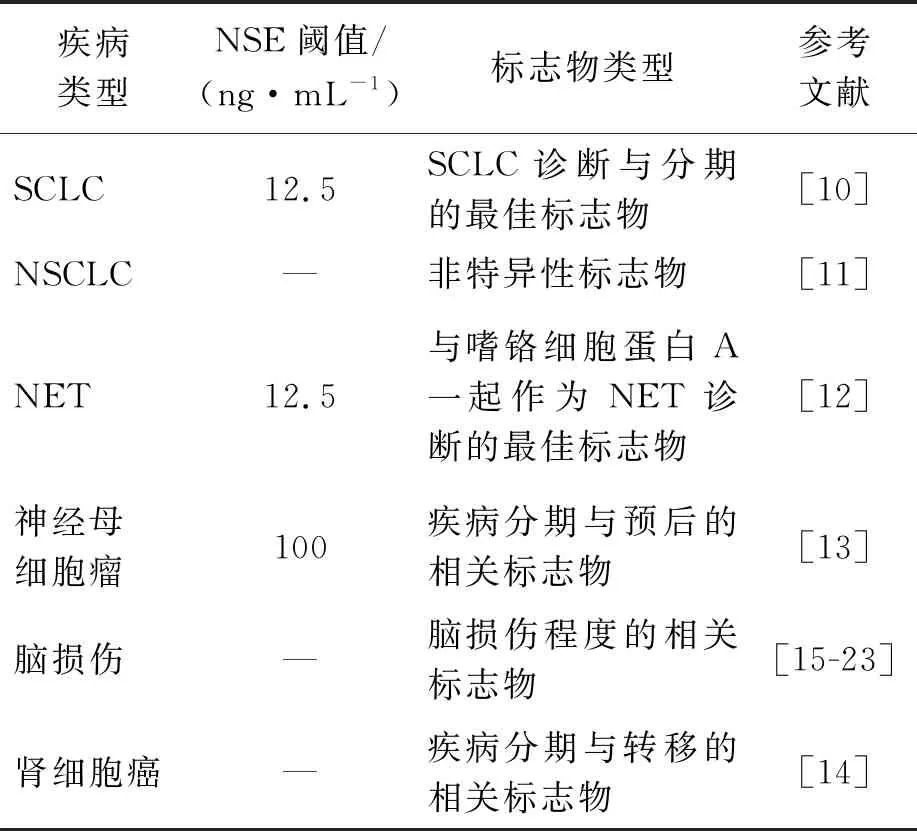
表1 与NSE相关的疾病
2 NSE的检测方法
NSE的体外检测主要有3种方式:1)依赖NSE部分肽段结构特征的质谱分析方法[24-27];2)依赖于NSE本身烯醇化酶活性的酶活性测量方法[28];3)依赖于NSE识别位点的配体测定方法。对于NSE而言,质谱检测方法虽然准确度和灵敏度高,但受限于复杂的样本前处理过程和对大型设备的需要,难以满足高通量、高效率检测的要求。而酶活性测量方法的特异性较差,导致检测结果准确度不高。然而依赖于配体特异性结合的检测方法却是目前NSE常用的临床检验技术,该类方法中的配体主要包括抗体、分子印迹聚合物、核酸适配体。
2.1 基于抗体的免疫检测方法
使用抗原-抗体反应原理的免疫检测方法因具有检测速度快、操作简便、成本低、易于推广等优点,是临床检验中蛋白质分析的首选方法[29]。然而免疫分析法存在稳定性差、灵敏度相对较低、假阳性率高等问题。NSE和NSE前体NNE之间基本没有免疫交叉反应性[30],可以减少交叉反应引起的假阳性结果。基于抗体的免疫方法检测NSE主要有“三明治”夹心模式与竞争模式两种形式。
2.1.1 放射免疫测定法(RIA)
RIA是临床检测NSE最早使用的免疫测定技术,其基本原理是:将放射性元素标记抗原/抗体作为检测探针,采用夹心模式或竞争模式,通过测量探针上放射性元素的放射强度,实现对样本中NSE的定量检测。基于3H放射性元素标记的竞争模式RIA可以在总体积为0.55 mL加标血清中检出1 ng至100 ng的NSE[31]。将具有更强放射性的125I作为标记元素,能够有效提高RIA检测NSE的灵敏度[32-33]。虽然RIA具有灵敏度高、特异性好等优点,但使用放射性同位素易造成放射线辐射和污染等问题,应用发展受到限制。
2.1.2 酶联免疫吸附测定法(ELISA)
1972年Engvall和Perlmann[34]首次建立了ELISA,极大地简化了免疫测定程序,迅速成为临床检验的金标准。用于NSE检测的ELISA包括直接法和夹心法。Aghajanian G[35]开发了直接法ELISA,用碱性磷酸酶标记的NSE抗体直接特异性识别NSE,通过直接测量酶标抗体催化底物产生的信号实现检测,但该方法准确度和灵敏度不高。基于夹心模式的ELISA经过抗体固定—抗原捕获—杂质洗涤—检测抗体识别—洗涤—酶标抗体结合等步骤,在酶标板上形成“抗体-NSE-抗体-酶标抗体”复合物,最后通过测量酶标抗体催化底物产生的信号实现NSE检测,抗体特异性的捕获与识别以及干扰物的去除,大大提高了NSE检测的灵敏度和准确度[36],可用于复杂基质分析。Abcam公司生产的ELISA试剂盒(货号ab233626)可以在90 min内检出50.8 pg/mL的NSE。然而,ELISA方法操作繁琐且耗时。
2.1.3 电化学免疫传感器


图1 电化学免疫传感器示意图Figure 1 Schematic diagram of electrochemical immunosensors
在电化学免疫传感器中,免标记电化学传感器具有结构和检测步骤更简单、检测时间更短等优点。光电化学(PEC)传感器是一种常见的免标记电化学传感器,有光电转换能力的电极产生光电流,当NSE被电极上的抗体特异性结合后,电极的阻抗变大,光电流减弱,光电流的变化与NSE质量浓度相关。Soomro等[42]以抗体修饰钨酸镍电极,尿酸作电子供体,构建了PEC免疫传感器,光电流反应随着NSE的质量浓度增加而逐渐减弱,在最佳条件下的检出限为120 pg/mL。Liu等[43]构建了基于金纳米星-二硫化钼复合纳米材料的PEC免疫传感器检测NSE,其检出限可低至3.5 pg/mL。
但PEC传感器的灵敏度受光电流大小的限制,直接的电化学阻抗谱测量可以提高其灵敏度。Zhang等[44]将氧化石墨烯和苯胺通过电化学共沉积到多孔金电极上,构建了一种免标记电化学免疫传感器用于NSE检测,其检出限可低至0.1 pg/mL,这种使用贵金属改性电极的方法提高了检测灵敏度,但同时也提高了制造成本。因此,Aydin等[45]开发了一种基于环氧取代聚吡咯聚合物涂层一次性锡-铟氧化物电极的低成本免标记电化学免疫传感器如图1(b),通过阻抗测量来反映NSE质量浓度,在最佳条件下的检出限为6.1 fg/mL,且每次检测成本仅$0.05,远低于ELISA方法的$5.42。
电化学免疫传感器在肿瘤标志物检测方面已取得了很大进展,但高阻抗的抗原、抗体、阻断剂等非目标物可能会在电极表面产生绝缘层,阻碍电子转移而降低信号响应,在一定程度上会限制其分析性能。
2.1.4 荧光免疫层析方法
荧光免疫层析方法是将特异性免疫学反应和高灵敏荧光技术结合起来的一种快速检测技术,在临床诊断和基础研究中具有重要作用。其基本原理是:将含有NSE的样品滴加到样品垫上,NSE与荧光检测探针形成复合物继续在NC膜上层析,被检测线上的抗体捕获并聚集形成荧光信号[46],NSE质量浓度与荧光信号呈正相关。近年来,有机荧光染料[47]、荧光微球[48]、半导体量子点[49]等荧光材料的应用,丰富了荧光免疫层析方法体系,同时也提高了检测灵敏度。Xiao等[49]以量子点为标记材料制备检测探针,开发了一种能在15 min内同时定量检测NSE和癌胚抗原(CEA)的荧光免疫层析方法,检测的质量浓度为5~50 ng/mL,检测NSE的检出限为42.6 pg/mL。相较于荧光ELISA方法[50],荧光免疫层析方法将捕获抗体和探针整合在同一体系中,复杂的洗涤、加样等步骤也被NC膜上的层析作用所取代,因此具有检测速度快、操作简单、成本低等优点,能够实现NSE的即时检测。然而,免疫层析法存在较大的批内差和批间差;此外,荧光信号需要紫外光源来激发获取,增加了检测的成本和复杂度。
2.1.5 化学发光免疫分析方法
化学发光免疫分析方法是将高灵敏化学发光技术与特异性免疫反应相结合的一种新型免疫分析方法,其发光能量来自化学反应。Mao等[51]用碱性磷酸酶(ALP)标记抗NSE抗体作检测探针,成功构建了夹心模式的化学发光免疫传感器,当样品中存在NSE时,形成“探针-NSE-捕获抗体”免疫复合物,经洗涤加入发光底物,在ALP的催化作用下迅速发光如图2(a),其检出限为44 pg/mL,完成检测需要至少200 min。该方法易于扩展实现高通量检测,用于临床血清样品的大规模筛选,但较繁琐的操作过程和较长的分析时间限制了其广泛应用。
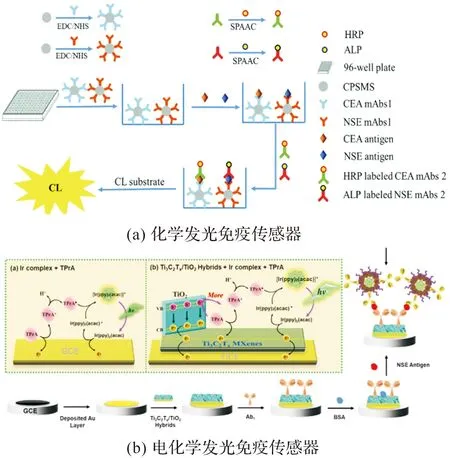
图2 化学发光免疫传感器示意图Figure 2 Chemiluminescence immunosensors for NSE detection
提高ECL免疫分析方法灵敏度的方式包括:1)更强发光体系的引入,Yang等[53]在沉积有高电活材料Ti3C2Tx/TiO2的玻碳电极上修饰捕获抗体,在修饰有双(2-苯基吡啶)(乙酰丙酮)铱(III)的聚乙二醇化脱铁蛋白上包被抗体组装成发光探针,成功构建了ECL免疫传感器如图2(b),在最佳条件下,NSE的检出限可低至35 fg/mL;2)生物酶催化,Aydin等[54]成功建立了基于酶促生物催化沉淀(BCP)的发光阻遏ECL传感器,检测NSE时,电极上的HRP催化底物4-氯-1-萘酚被H2O2氧化产生不溶性沉淀物,形成不导电的不溶性层,从而有效地阻碍共反应物的界面质量和电子转移,使电极上的ECL信号减弱,该方法检测NSE的检出限为6.1 fg/mL;3)加大ECL传感器的比表面积,Zhang等[55]在高比表面积的银-半胱氨酸纳米线上固定捕获抗体,将检测抗体与还原氧化石墨烯-氮掺杂碳量子点复合材料偶联制备检测探针,建立的ECL传感器检测NSE的检出限能低至0.18 fg/mL。
2.1.6 表面增强拉曼光谱免疫分析方法
SERS(surface-enhanced Raman sepectroscops)免疫传感器是以拉曼散射和免疫反应为基础发展的一种技术方法,具有灵敏度高、特异性强、分辨率高、稳定性好等优点。Wang等[56]建立了基于尼罗蓝修饰的纳米金球SERS免疫传感器如图3,检测NSE的检出限为100 pg/mL,但检测时间需要2 h且操作繁琐。Song等[57]将免疫层析技术与SERS结合,成功建立了基于免疫层析原理的SERS免疫传感器,由于背景干扰极低,检测信噪比高,可在10 min内检测到低至0.01 pg/mL的NSE。此外,随着便携式SERS光谱仪[58]的开发与应用,使SERS免疫传感器兼具有便携、经济、快速等优点。

图3 检测NSE的SERS免疫传感器[56]Figure 3 SERS immunosensors for NSE detection
2.1.7 光纤免疫传感器
光纤免疫传感器是将光纤探测与特异性免疫反应相结合的一种新兴传感技术,它兼具光学探测和生物反应的优点[59]。Zhou等[60]开发了一种基于黑磷纳米片的光纤生物传感器,检测NSE时,样品中的NSE被光纤表面的黑磷-抗体探针捕获形成免疫复合物,格栅所反射的光将发生共振波长偏移,光信号的波长偏移与样品中NSE质量浓度的对数呈正相关。由于黑磷纳米片独特的光调制效应和光纤的优异光传输特点,该方法在最佳条件下仅需35 min,检出限可达1.0 pg/mL,定量检测范围为0.01~100 ng/mL。光纤免疫传感器具有灵敏度高、抗磁干扰强、特异性好、体积小、实时监测等特点[61],为NSE新型免疫传感器的开发提供了新的思路。
2.2 基于分子印迹聚合物的免疫检测方法
分子印迹聚合物(molecular imprinted polymer, MIP)是通过功能单体围绕模板聚合交联成三维矩阵,模板去除后,形成具有目标分子特定形状的空腔聚合物。MIP表面具有与目标分子互补的化学功能,能特异性识别并结合目标分子[62]。与抗体分子相比,MIP具有廉价、易于获得、稳定性强的特点[63-64],有望代替传统抗体作为生物识别元件用于检测方法的建立。根据模板类型的不同,通常将MIP分为全蛋白印迹的MIP和表位印迹的MIP。
利用全蛋白印迹的MIP拥有多个“立体”识别位点,可以提供对目标物更强亲和力和特异性。Wang等[65]采用模板辅助电化学沉积技术,成功开发了基于全蛋白MIP的免标记电化学传感器,能检测低至2.6 pg/mL的NSE,定量范围为0.01~1.0 ng/mL,检测时间少于15 min。在全蛋白MIP的合成过程中,完整的NSE蛋白质在有机溶剂中的溶解度有限,从而极大地限制了MIP上“模板空腔”的数量,所以当含有较高质量浓度的NSE时,传感器上的MIP空腔会迅速饱和,导致检测范围较窄。
表位印迹的MIP是印迹短肽序列,形成特定空腔充当抗体作为识别位点[66]。制备表位印迹MIP使用短肽作模板,大大降低了成本,而且短肽序列在有机溶剂中有良好的溶解度,从而有效增加了靶标蛋白的识别位点。因此,表位印迹的MIP拥有针对同一抗原的多个识别位点[67],有利于低丰度蛋白质的灵敏检测。Xing等[68]成功构建了表位分子印迹拉曼光学传感器,能在15 min内完成NSE的检测,定量范围为100 pg/mL至10 μg/mL,检出限为10 pg/mL。
目前,MIP作为识别蛋白质的配体还存在以下问题:1)有机溶剂的使用导致模板分子变性而使印迹效率低;2)功能单体和模板分子之间的相互作用较弱,导致传质和印迹位点不足[69];3)结合动力学较慢[70];4)印迹靶标蛋白分子的去除难易程度与功能单体选择相关[71]。因此,在一定程度上限制了MIP的应用。
2.3 基于核酸适配体的检测方法
核酸适配体(Aptamer)是短的单链RNA或DNA分子(大约12~80个核苷酸),它能够通过改变其三维构象以非共价相互作用与特定分析物以高亲和力结合。核酸适配体可以通过指数富集配体系统进化(SELEX)技术筛选获得,与抗体相比,具有合成简单、成本低、稳定性好、易功能化修饰等特点,但其与目标物的结合动力学较慢[72]。目前基于核酸适配体的电化学传感器[73]、化学发光分析方法[74]与表面等离子体共振(SPR)生物传感器[75]已被设计并应用,在NSE的检测中显示出良好的性能。尽管适配体具有许多优势、但是它本身血清稳定性较差,这限制了其在临床检测上的应用。因此,必须通过化学修饰或纳米载体包裹等手段来保护适配体,使其能够在复杂的生物环境中发挥作用。
3 结论与展望
NSE是目前诊断小细胞肺癌最可靠的血清肿瘤标志物。目前,常见的检测NSE的配体有抗体、MIP、核酸适配体,常用的NSE检测方法有RIA、ELISA、化学发光法等,它们的检测性能汇总于表2。然而,NSE检测方法还存在一些问题和挑战,如标准化、敏感性、特异性、干扰因素等。目前尚无统一的金标准方法来检测NSE。准确快速、灵敏便携、低成本是对NSE检测方法开发的进一步要求。
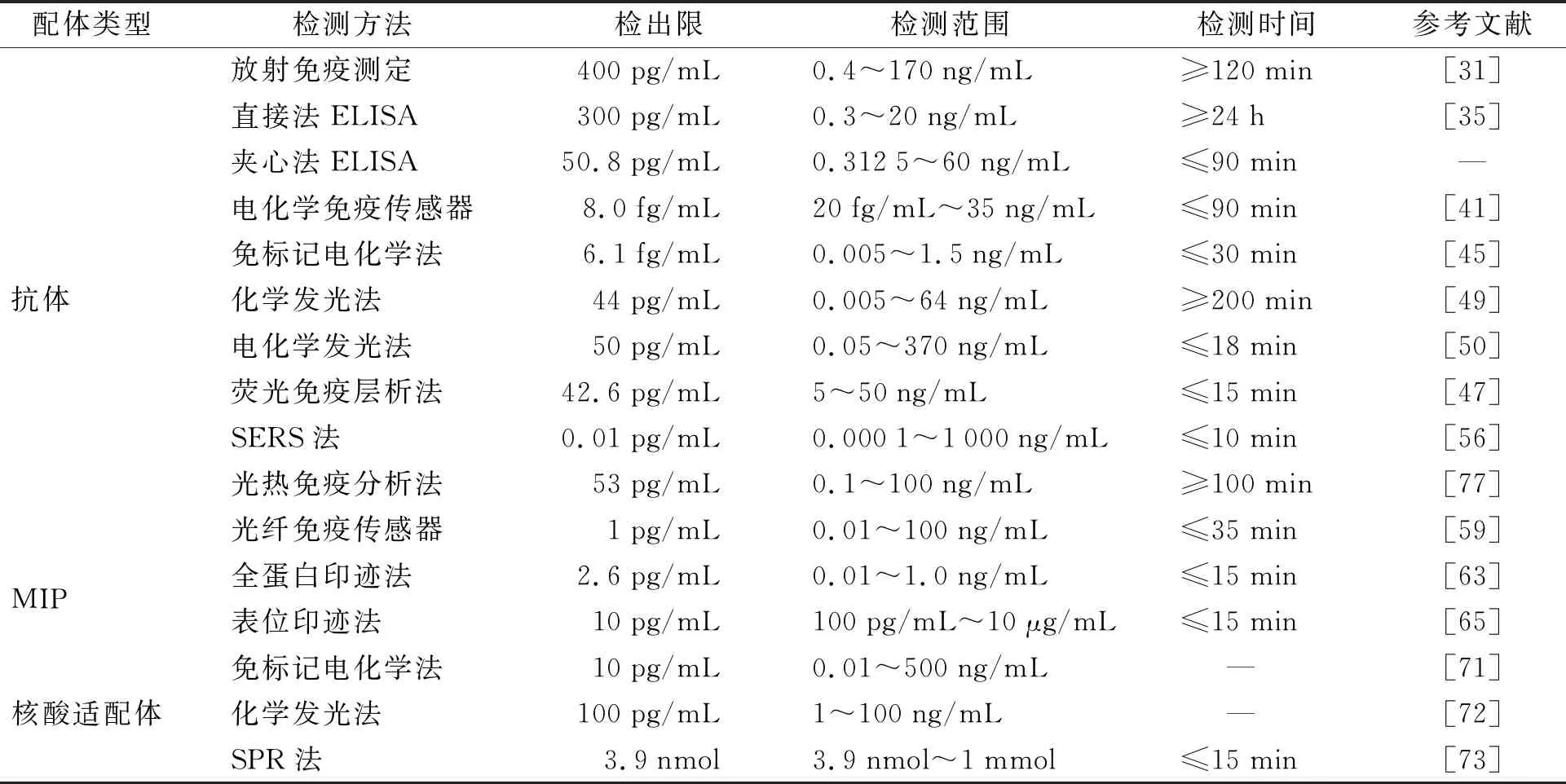
表2 基于配体的NSE检测方法性能汇总
随着生物、化学、材料等多学科交叉日益加深,NSE检测方法也在不断创新和进步。此外,还需要加强对NSE检测结果与临床意义之间关系的研究,探索NSE在不同类型和阶段的肿瘤中的变化规律和预后价值,并结合其他肿瘤标志物或影像学检查等手段进行综合评估。
未来,NSE检测方法可能会向以下几个方向发展:通过微流控芯片达到对NSE高效、快速、灵敏、特异和低成本的分析。光学传感器法:借助光学传感器如表面等离子体共振设备[76]、光纤等实施对NSE无标记、在线、实时和高通量地监测。基于深度学习的目标识别法:采用深度学习算法如R-CNN等对NSE检测结果图像或视频中目标区域进行自动识别和定位。

