人工血栓抽吸联合置管溶栓在急性非肝硬化性门静脉血栓治疗中的应用
朱洪江,赵鹏鹏,颜峰,屈长征,符延波
张家界市人民医院 血管介入外科,湖南 张家界 427000
门静脉血栓(portal vein thrombosis,PVT)可导致门静脉阻塞和压力升高。如果血栓扩散到肠系膜上静脉,可能导致肠道淤血,甚至引起肠道坏死,是一种少见但可能导致严重后果的综合征[1-2]。急性非肝硬化性门静脉血栓(non-cirrhotic portal vein thrombosis,nc-PVT)因缺少门静脉的侧支循环,可导致门静脉系统压力急剧上升。如果血栓扩散到肠系膜静脉,可能导致肠道急性缺血坏死;如血栓残留,还可能导致门静脉高压和门静脉海绵样变性等长期后遗症的出现[3]。急性nc-PVT的主要治疗方式包括抗凝、经皮肝穿刺门静脉置管溶栓或吸栓以及经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt,TIPS)等[4]。相对而言,经皮肝穿刺门静脉方式技术难度较低,费用较低。因此,我们采用经皮肝穿刺门静脉置管溶栓或人工血栓抽吸(manual aspiration thrombectomy,MAT)的方法治疗急性nc-PVT患者,取得了良好的临床效果,现报道如下。
1 资料和方法
1.1 一般资料
回顾性分析2019年1 月至2023年4 月在张家界市人民医院血管介入外科住院治疗的9 例急性nc-PVT患者临床资料,其中男4例,女5例,年龄30~72岁,中位年龄58岁。发病时间1~3 d,1例为产后5 d(病例3),4例合并腹腔脏器炎症,1 例为胆囊切除术后,3例未查及明显危险因素。9例患者基本情况详见表1。所有患者均有急性腹痛表现,经腹部增强CT诊断门静脉血栓,且D-2聚体升高。

表1 9例急性非肝硬化性门静脉血栓患者的一般资料以及治疗情况
1.2 纳入和排除标准
纳入标准:(1)患者急性腹痛,经过抗凝治疗持续性腹痛不能缓解;(2)排除肝硬化、肝恶性肿瘤疾病;(3)腹部增强CT明确门静脉血栓形成且门静脉因血栓完全闭塞或狭窄率>50%。排除标准:(1)肝功能Child-Pugh分级为C级;(2)存在抗凝、溶栓禁忌。
1.3 手术方法
1.3.1 经皮经肝门静脉穿刺及门静脉造影 在CT引导下确定门静脉主干的最佳穿刺部位、角度以及深度后,以穿刺针向肝门区穿刺(图1A~B)。退出针芯,如为门静脉狭窄病变则穿刺成功后可回抽出血液;如门静脉闭塞则无法回抽出血液,此时经穿刺针送入导丝试探,如导丝下行顺畅且CT扫描证实导丝位于门静脉主干内则表明穿刺成功(图2C)。然后将患者转移至DSA室,经导丝引入8 F血管鞘及单弯导管,在泥鳅导丝配合下将导管分别送入SMV、SV远端行血管造影,明确血栓部位、程度(图1D)。
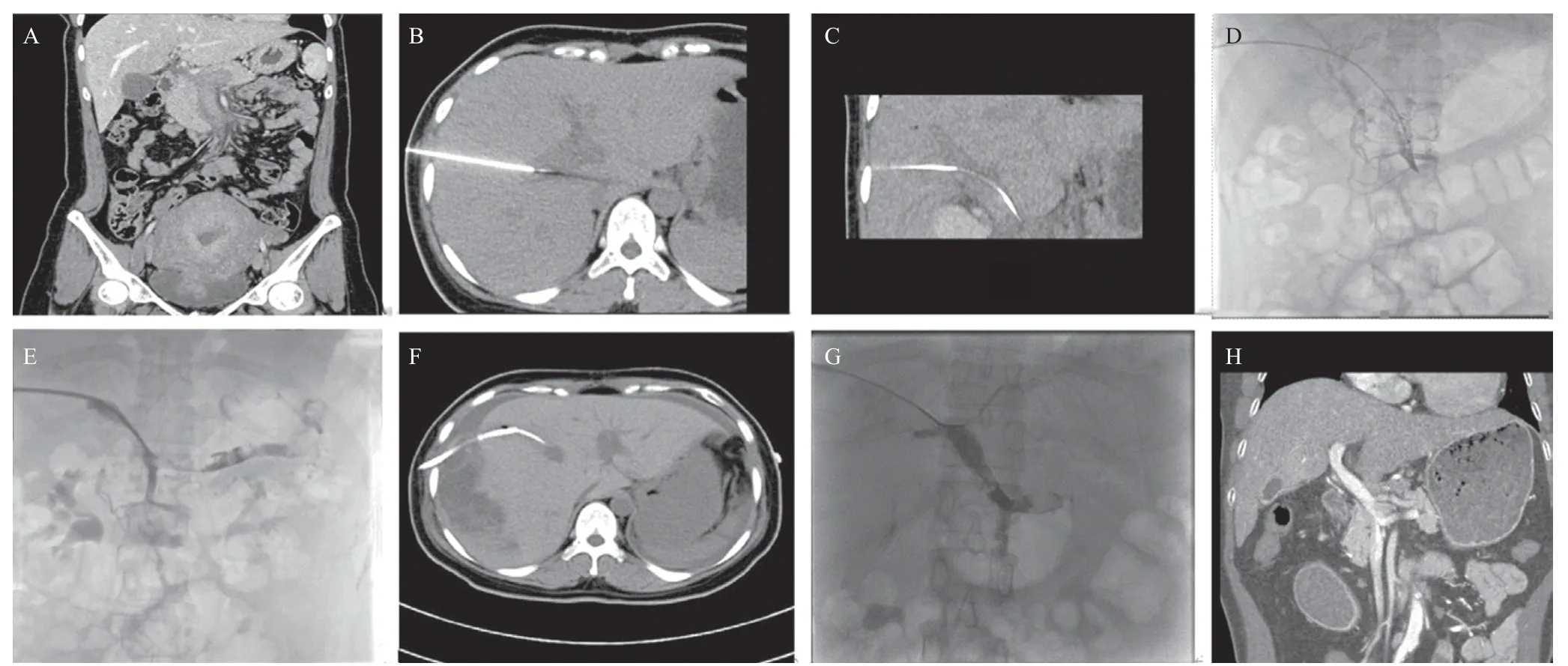
图1 应用人工血栓抽吸联合置管溶栓治疗急性nc-PVT患者的术前腹部CT、抽栓及溶栓手术过程以及术后6个月CT复查图像(病例3)
1.3.2 血栓抽吸及置管溶栓术 经血管鞘送入8 F引导管。在之前造影明确血栓部分行手动血栓抽吸,抽吸后造影如残留血栓则植入溶栓导管溶栓治疗(见图1E)。溶栓过程中每6 h抽血复查凝血功能。如纤维蛋白原低于1.0 g/L则停止溶栓并拔管。尿激酶剂量参照下肢深静脉血栓溶栓治疗[5]定为30~40万U/d,依据患者出血风险调整。
1.3.3 溶栓后造影及拔管 溶栓过程中每24 h复查造影,如血栓清除评估达到Ⅲ级以上或溶栓72 h以上则拔出溶栓导管。血栓清除标准[6]:血栓清除率>90%为Ⅲ级;血栓清除率50%~90%为Ⅱ级;血栓清除率<50%为Ⅰ级。鞘管拔出前置入3~4 mm弹簧圈及明胶海绵栓塞肝内穿刺道。
1.4 术后处理及随访
术后使用每日一次利伐沙班20 mg或每日两次达比加群酯150 mg抗凝治疗,抗凝疗程6 个月。术后1、3、6个月电话随访患者有无腹痛或其他症状,术后6个月复查腹部增强CT。
2 结果
所有患者均成功穿刺门静脉,技术成功率100%。溶栓时间24~72 h,平均(50±17)h,尿激酶剂量40~120万U,平均(73±28)万U。术后即刻造影评估门静脉血栓清除Ⅲ级6例,Ⅱ级3例。治疗后腹痛症状均明显好转。人工血栓抽吸及置管溶栓治疗后6个月,门静脉系统血栓清除III级8例,Ⅱ级1例。
9例患者中1例在溶栓期间发生穿刺点出血,经输血400 mL及介入栓塞肝内穿刺道后生命体征恢复正常。1例患者出现肠道缺血坏死,经开腹切除坏死肠管后好转。3例患者溶栓过程中出现发热,经抗感染治疗后体温恢复正常。
3 讨论
PVT诊断确立后,除了评估患者是否合并肝硬化,还需评估是急性血栓还是慢性血栓,这对于制定治疗计划至关重要。慢性血栓因机化且与血管壁粘连,抽栓与溶栓均难以达到理想的治疗效果。急慢性血栓主要通过以下几点鉴别。(1)急性nc-PVT常急性起病,表现为中重度的腹痛和发热[7],慢性nc-PVT常表现为门静脉高压的临床表现。(2)彩超对于急性nc-PVT、慢性nc-PVT的鉴别也有一定的作用:急性nc-PVT在彩超灰阶图像上表现为低回声或等回声的血管内占位,可伴有门静脉扩张,而慢性nc-PVT则主要表现为高回声,同时可在肝门区发现较多的细小侧支循环[2]。(3)慢性nc-PVT在CT上表现为门静脉海绵样改变,即肝外门静脉闭塞引起的肝门部多发侧支血管形成。
本组除病例8 外均为急性nc-PVT+MVT/SV患者,均表现为急性剧烈腹痛,且部分患者出现肠道坏死表现如腹部压痛、反跳痛及肌酸激酶升高。所以我们采取抗凝+经皮经肝穿刺门静脉吸栓、置管溶栓的治疗方案,术后除病例4 出现肠道坏死切除部分肠管外,其余患者均取得了较好的临床效果。术前评估血栓范围十分必要,对于合并肠系膜血栓的PVT患者须在抗凝的基础上采用更积极的处理方法祛除血栓降低门静脉系统压力,避免出现肠道坏死等危重并发症。
门静脉系统特点是两端均是毛细血管,选取适当入路是介入治疗急性nc-PVT成功的关键。常用的介入入路包括TIPS[8]和经皮经肝穿刺门静脉[9]。文献报道的PVT病例多为肝硬化性PVT,所以常用的穿刺入路为TIPS。TIPS不仅可降低肝硬化患者的门静脉压力,还可以提供栓塞食管胃底曲张静脉的通路[10]。但由于TIPS入路技术难度大,对术者要求也更高,尤其是对于门静脉内血栓闭塞的患者,术中穿刺后难以通过回抽出血液判断穿刺是否成功,更加增大了手术难度。而且对于急性nc-PVT,TIPS入路改变了患者肝脏血流动力学,且存在右心衰竭、肝性脑病的并发症,其应用存在较大争议。我们采用经皮经肝穿刺门静脉的入路,技术难度较TIPS入路低。对于门静脉血栓闭塞的患者,我们采取CT引导下穿刺,可经CT确定合适的穿刺路径。穿刺后可再次CT扫描判断穿刺针尖端是否位于门静脉内并通过送入导丝时的阻力再次确认是否位于门静脉内。当然该入路也存在局限性,例如溶栓过程中穿刺点出血的风险[11-12]。肝脏的位置可随呼吸改变,可能导致溶栓过程中留置血管鞘脱出肝脏。本组病例3 即在溶栓过程中发生了穿刺点出血,在溶栓48 h后出现贫血貌和血性腹膜炎表现,复查增强CT发现留置血管鞘已从肝脏滑出,肝脏包膜下血肿形成(图1F)。所以经皮经肝穿刺门静脉通路需密切观察有无出血表现,一旦出现立即停止溶栓,并栓塞肝脏穿刺隧道止血。
人工血栓抽吸(MAT)为常用的血栓减容的手术方式,其操作较为简单,能够快速清除血栓,而且耗材费用低,尤其适合基层医院,目前已得到了广泛的应用[13]。本组9 例患者均经过MAT抽栓,术中可抽出较多血栓,经后续的溶栓治疗后腹痛均明显缓解。其中6例闭塞患者经MAT抽栓后均转为狭窄病变,恢复部分血流,有利于后续的溶栓治疗,避免肠道缺血坏死。除病例4 因肠道缺血时间较长而发生肠坏死,病例3 发生穿刺点出血外。总体来说MAT联合溶栓治疗急性nc-PVT患者是完全有效的,值得临床推广。但因病例数较少,且随访时间有限,远期的疗效仍有待进一步观察。

