当归补血汤治疗血管性痴呆作用机制网络药理学研究*
刘宗欣,李孟韩,万 婷,陈兴华△
(1. 广州中医药大学第一临床医学院,广东广州 510405; 2. 广州中医药大学第一附属医院,广东广州 510405)
血管性痴呆(VD)是由脑血管病变导致慢性脑区低灌注引起的认知功能障碍综合征,发病率高[1],严重影响患者的生活质量。虽然控制致病性脑血管疾病危险因素、抗血小板聚集、抗凝等措施可预防VD[2],但该病尚无获批的特效治疗药物。VD 可由氧化应激、炎性反应、突触改变及遗传等多种因素导致[3],其发病机制与神经元的自噬、变性、凋亡、坏死、氧化应激反应等有关,发病过程涉及磷脂酰肌醇- 3 - 激酶(PI3K)、核因子- κB(NF - κB)、细胞铁死亡等信号通路[4-7]。有研究表明,细胞铁死亡在认知障碍相关疾病的发病过程中有重要作用[8]。中医认为,痴呆由髓减脑消、神机失用所致,其中气血亏虚是主要病机。当归补血汤是中医经典补血方剂,始载于《陈素庵妇科补解》。该方剂治疗认知障碍相关疾病疗效明显[9],具有抗动脉粥样硬化[10]、抗氧化[11]及神经保护作用[12],其作用机制可能与氧化应激及细胞铁死亡等相关。本研究中利用网络药理学及分子对接技术,探讨了当归补血汤治疗VD 的作用机制,以期为VD患者的临床用药提供参考。现报道如下。
1 资料与方法
1.1 当归补血汤活性成分及靶点获取
以“黄芪”“当归”“huangqi”“danggui”为关键词,检索中药系统药理学数据库与分析平台(TCMSP,https://tcmsp-e.com/tcmsp.php),以口服生物利用度(OB)>30%、药物类药性(DL)>0.18 为条件筛选活性成分;通过TCMSP 数据库获取相关靶点,利用Uniprot 数据库(https:// www. uniprot. org)查询对应基因,采用Perl 5.26.3软件对靶点基因进行注释。
1.2 VD 靶点获取
以“vascular dementia”为关键词,分别检索Gene-Cards数据库(https://genealacart.genecards.org)、OMIM数据库(https://www.omim.org),获取VD 靶点基因,建立疾病基因数据集。
1.3 成分-共有靶点网络构建
将成分靶点和疾病靶点导入R 3.6.1 软件,获得共有靶点。采用Perl 软件对成分和共有靶点进行一一映射,利用Cytoscape 3.7.2 软件对映射结果进行拓扑计算,构建成分- 共有靶点网络。根据导出数据文件,对各成分与共有靶点的相互作用数量(即边数)进行排序,筛选边数>15的成分为核心成分。
1.4 蛋白相互作用(PPI)网络构建
将共有靶点导入String 数据库(https://cn.stringdb. org),种属选择“homo sapiens”,最低相互作用阈值设为中等(medium confidence,0.400),隐藏游离节点,其他参数保持默认设置,构建PPI 网络。导出.tsv 文件,采用R 3.6.1 软件对节点、边数、度值进行循环计算,以各条件均大于中位值的基因对应的蛋白为核心靶点。对核心靶点的度值排序,选取度值大于40 的靶点为关键靶点。
1.5 富集分析
将共有靶点输入R3.6.1 软件进行基因本体论(GO)功能富集分析和京都基因与基因组百科全书(KEGG)通路富集分析。利用Bioconductor 软件包中的“org. Hs. eg. db”“colorspace”“stringi”“ggplot2”“DOSE”“clusterProfiler”“enrichplot”绘图包,设置P<0.05,分别计算富集的基因数目,选取P值排名前20的GO 功能富集分析结果绘制柱状图;选取排名前30 的KEGG 通路富集分析结果绘制气泡图。
1.6 分子对接验证
通过RCSB 数据库(http:// www. rcsb. org)下载关键靶点结构,采用PyMOL 2.3.0 软件去除蛋白结晶水、原始配体;根据核心成分小分子的CAS 号,从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov)中下载SDF格式的3D 结构,导入ChemBio3D Ultra 14.0 软件进行能量最小化,将Minimum RMS Gradient 设置为0.001,将小分子结构保存为.mol2格式。将处理后的关键靶点和核心成分文件分别导入AutoDock Tools 1.5.6软件处理,将结果保存为pdbqt格式。采用POCASA 1.1在线工具(http://altair.sci.hokudai.ac.jp/g6/service/pocasa/)预测蛋白结合位点,采用AutoDock Vina 1.1.2 软件进行分子对接,采用PyMOL 2.3.0 软件分析相互作用模式,并计算结合能。
2 结果
2.1 当归补血汤活性成分与靶点
共获得活性成分22个(当归2个,黄芪20个),详见表1;作用靶点1 807 个(当归864 个,黄芪943 个),剔除重复后为142个。VD靶点3 414个。

表1 当归补血汤活性成分Tab.1 Active ingredients of Danggui Buxue Decoction
2.2 成分-共有靶点网络
共获得共有靶点81个(见图1),成分-共有靶点网络见图2。共160个节点、354条边。共获得18个与VD有关的活性成分(黄芪16个、当归2个),7个核心成分(3,9 -二-O-美迪紫檀苷、7-O-甲基异黏菌素醇、毛蕊异黄酮、芒柄花素、异鼠李素、山柰酚及槲皮素)。
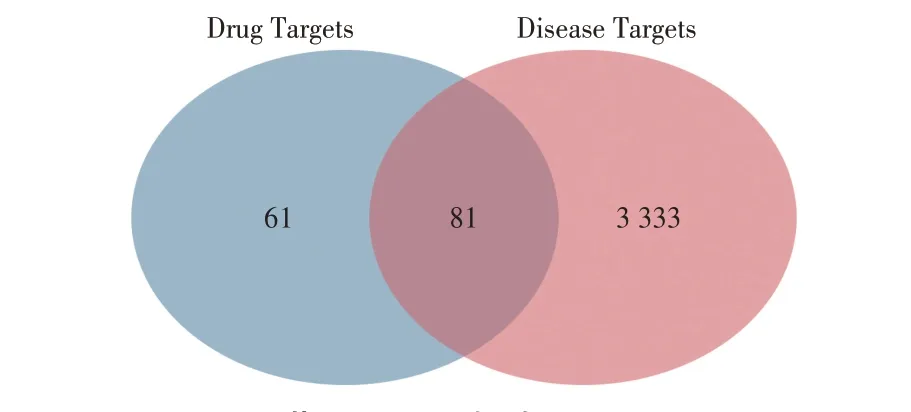
图1 药物-疾病靶点维恩图Fig.1 Venn diagram of drug-disease targets
2.3 PPI 网络
PPI 网络见图3,共38 个节点,203 条边,平均度值为5.01。共获得丝氨酸/苏氨酸蛋白激酶1(AKT1)、雌激素受体1(ESR1)、过氧化物酶体增殖物激活受体γ(PPARγ)、丝裂原活化蛋白激酶14(MAPK14)、信号转导与转录激活因子1(STAT1)、血红素加氧酶1(HMOX1)、白细胞介素4(IL - 4)、RELA 原癌基因、细胞间黏附分子1(ICAM1)、丝裂原活化蛋白激酶8(MAPK8)10 个核心靶点,经度值筛选后,共获得6 个关键靶点,即AKT1,HMOX1,MAPK8,MAPK14,PPARγ,STAT1。

图3 当归补血汤治疗血管性痴呆共有靶点的蛋白相互作用网络Fig.3 PPI network of common targets of Danggui Buxue Decoction in the treatment of VD
2.4 富集分析
GO功能富集分析获得生物过程(BP)1 404个条目,细胞组成(CC)53 个条目,分子功能(MF)130 个条目。P值排名前20 的富集条目见图4。其中,BP 主要包括异源性刺激应答、缺氧反应、血管管径调节等;CC主要包括筏膜、突触膜及其前后膜组成部分等;MF主要包括核受体活动、配体激活的转录因子活性、G蛋白耦联胺类受体的活性等。KEGG通路富集分析共富集相关通路161条,排名前30的通路见图5。主要涉及脂质和动脉粥样硬化通路、流体剪切应力和动脉粥样硬化通路、晚期糖基化产物-晚期糖基化终末产物受体(AGE-RAGE)信号通路、肿瘤坏死因子(TNF)信号通路等。
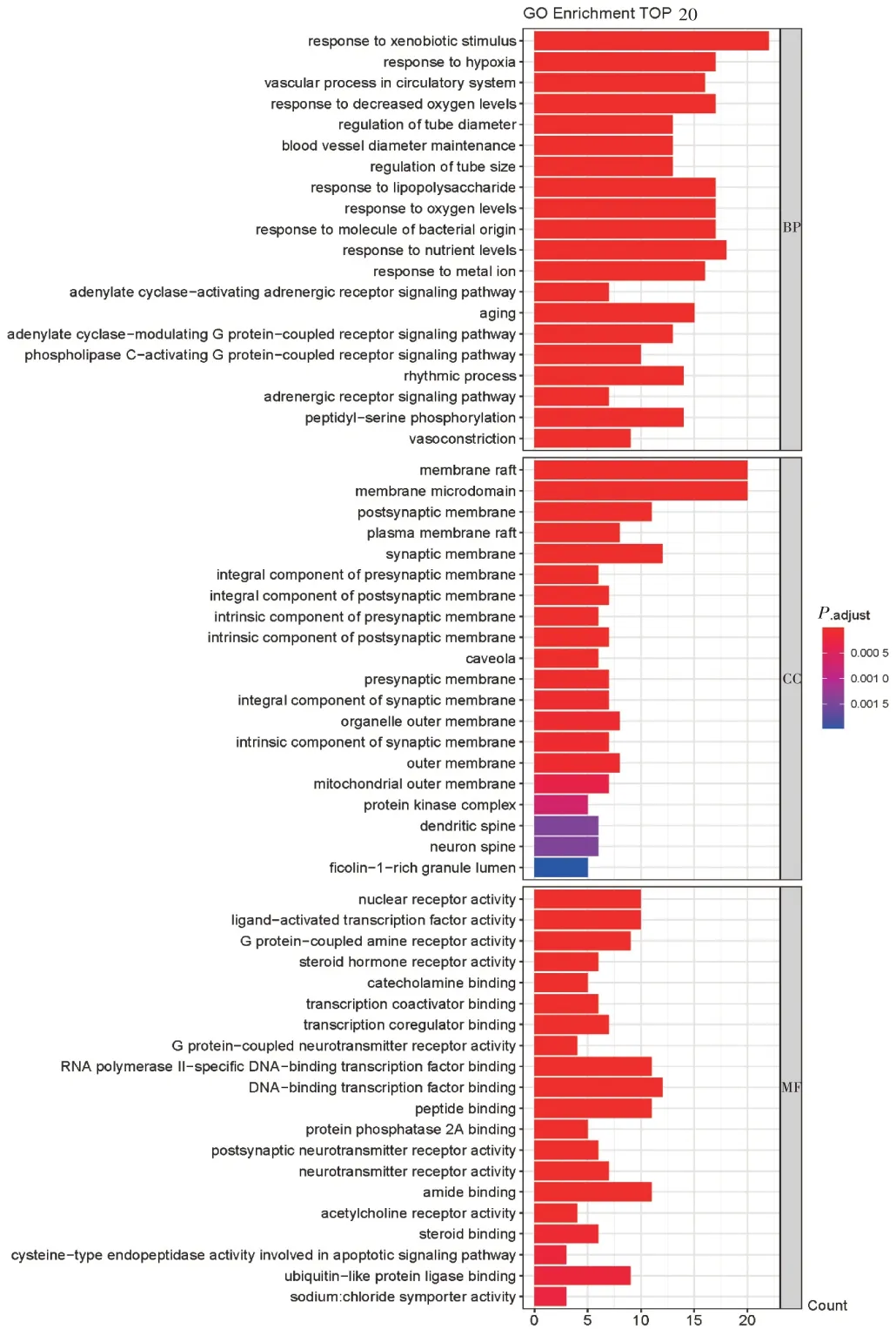
图4 GO功能富集分析结果Fig.4 Results of GO functional enrichment analysis

图5 KEGG通路富集分析结果Fig.5 Results of KEGG pathway enrichment analysis
2.5 分子对接
核心成分与关键靶点的对接结果见表2,将每个靶蛋白与活性成分结合性最强的对接结果(即芒柄花素与AKT1,槲皮素与HMOX1 和STAT1,异鼠李素与MAPK8,MAPK14,PPARγ)进行可视化,结果见图6。
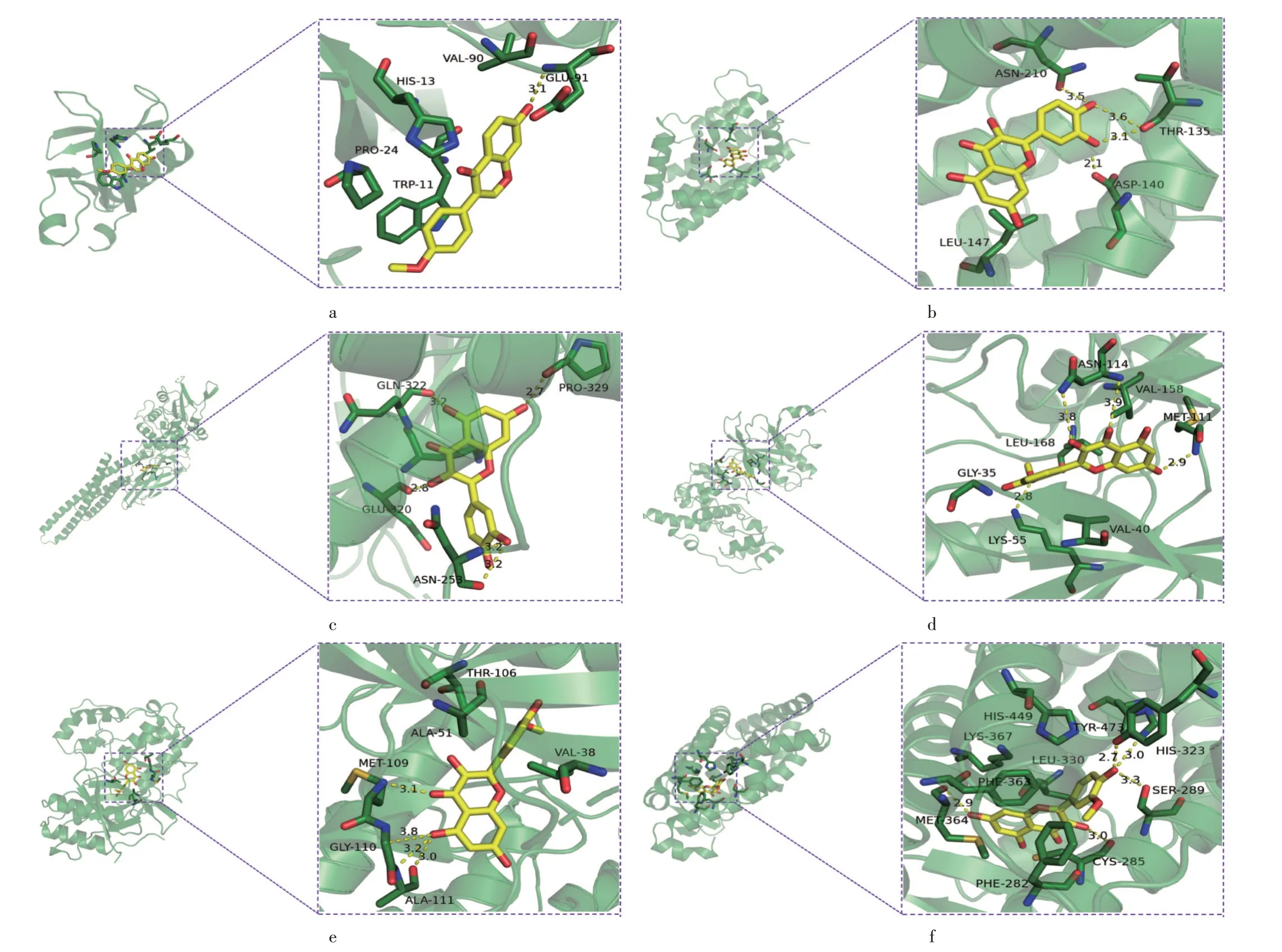
a. 芒柄花素与AKT1 b. 槲皮素与HMOX1 c. 槲皮素与STAT1 d. 异鼠李素与MAPK8 e. 异鼠李素与MAPK14 f. 异鼠李素与PPARγ图6 分子对接示意图a.Formononetin with AKT1 b.Quercetin with HMOX1 c.Quercetin with STAT1 d.Isorhamnetin with MAPK8 e.Isorhamnetin with MAPK14 f.Isorhamnetin with PPARγFig.6 Display of molecular docking
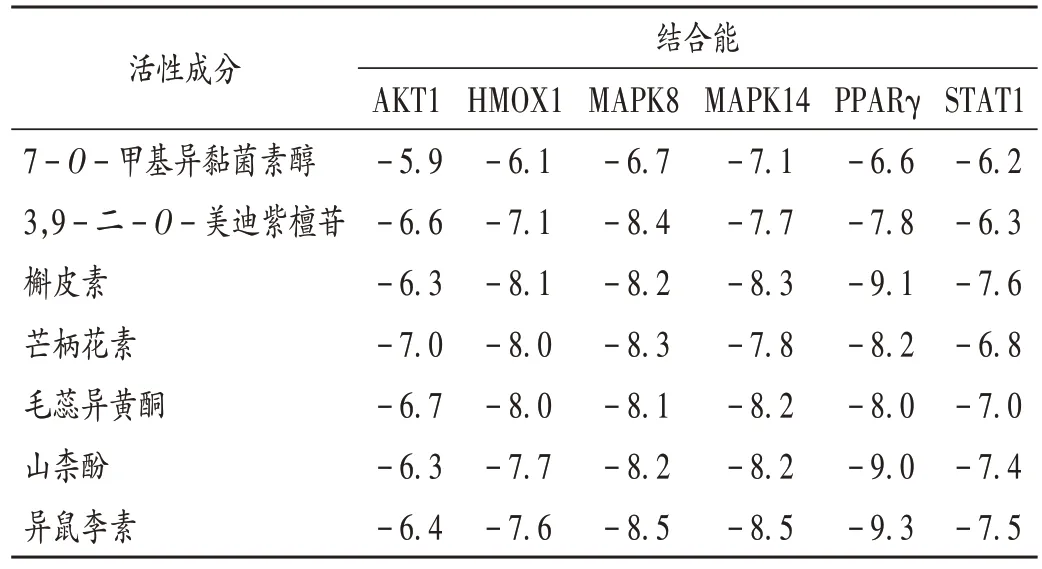
表2 分子对接结果(kcal/mol)Tab.2 Results of molecular docking(kcal/mol)
3 讨论
VD 发病机制复杂,脑神经元的死亡与VD 的发生密不可分。VD 患者常存在慢性脑区低灌注损伤,引起脑细胞缺氧,从而导致氧化应激反应,同时产生大量自由基对脑血管造成损害,故氧化应激反应是造成VD 发病早期神经元死亡的重要原因[13]。铁稳态失调、脂质过氧化和谷胱甘肽/ 谷胱甘肽过氧化物酶4 可能参与了VD的病理过程[14-15]。
当归补血汤是传统中医药学中的经典名方,其组方特色为黄芪与当归用量比为5∶1,通过重用黄芪为君,少量当归活血为臣,从而达到补益气血的目的。本研究结果表明,当归补血汤活性成分中,黄芪占多数,印证了该方配伍的合理性。中药方剂包含多种药物成分,每种成分可作用于多个靶点发挥药效。本研究结果表明,当归补血汤核心成分为7-O-甲基异黏菌素醇、毛蕊异黄酮、芒柄花素、异鼠李素、山柰酚、槲皮素。其中,3,9-二-O-美迪紫檀苷是从黄芪中分离的小分子化合物,可抑制血小板衍生生长因子BB 诱导的细胞增殖及血管平滑肌细胞增殖[16],防止动脉粥样硬化及斑块形成,从而预防VD发生,并延缓其进展;7-O-甲基异黏菌素醇有良好的OB,可能对心血管疾病、凝血障碍、帕金森病、神经胶质瘤等的治疗具有潜在应用价值[17]。毛蕊异黄酮、芒柄花素及异鼠李素均被证实可通过激活Nrf2 通路或其上游靶点发挥抗氧化应激作用,从而保护损伤后的脑细胞[18-19];槲皮素具有免疫调节、抗损伤、抗肿瘤、抑制动脉粥样硬化等活性[20],还可通过缓解脑部氧化应激反应改善缺血性脑卒中模型小鼠的脑功能[21];山柰酚有助于保护大脑,预防缺血性脑卒中导致的脑损伤及其他慢性炎性疾病[22]。
本研究结果提示,当归补血汤治疗VD 的核心靶点与脂质和动脉硬化通路、流体剪切应力和动脉粥样硬化通路、AGE - RAGE 信号通路、TNF 信号通路密切相关;且VD 的发病过程与能量代谢、炎症相关等信号通路密不可分。低密度脂蛋白可积聚在血管壁内,并通过氧化修饰从而导致内皮功能紊乱,是导致动脉粥样硬化及相关心脑血管疾病的根本原因;流体剪切应力和动脉粥样硬化通路可通过上调Nrf2的表达从而预防动脉粥样硬化[23-24]。AGE/RAGE信号通路可提高NF-κB 的活性,从而促进白细胞介素1、白细胞介素6、TNF-α促炎性细胞因子的表达[25]。TNF信号通路可调节细胞凋亡、增殖及炎症和免疫等生物过程,其受体可通过NF-κB和MAPK 途径调控细胞生存及凋亡。故当归补血汤的核心靶点可能参与脑血管动脉粥样硬化形成的调控通路,可能通过调控NF - κB 和Nrf2 的表达对VD 起治疗作用。当归补血汤治疗VD 的核心靶点与异源性刺激应答、缺氧反应、血管管径调节等密切相关,提示当归补血汤可能通过参与细胞缺氧反应、血管调节等过程发挥治疗VD的作用。
本研究结果显示,芒柄花素与AKT1,槲皮素与HMOX1 和STAT1,异鼠李素与MAPK8,MAPK14,PPARγ 均有较好的对接效果。AKT1 基因编码丝氨酸/苏氨酸蛋白激酶,可通过胞内磷脂酰肌醇激酶依赖的机制被胞外信号激活,是PI3K/ AKT 信号通路的核心因子。YI等[26]的研究表明,PI3K-AKT-mTOR 通路的持续激活可抑制铁死亡。芒柄花素与AKT1 结合良好,SUGIMOTO 等[27]研究发现,芒柄花素可通过激活PI3K/Akt-Nrf2信号增强抗氧化基因表达,降低活性氧水平,从而实现对人神经母细胞瘤细胞SH-SY5Y 的神经保护,故推测芒柄花素可能通过与AKT1 靶点结合从而发挥激活相关通路的作用。
STAT1 具有抑制细胞增殖、促进凋亡的作用[28]。研究证明,Nrf2 可通过JAK/ STAT 等潜在信号通路被激活[29]。HMOX1 基因是铁死亡过程中的重要靶点基因,其编码的蛋白是铁死亡过程中铁依赖性脂质过氧化的必需酶。YANG 等[30]通过肿瘤相关实验表明,Nrf2/HMOX1 信号轴的激活可抑制细胞铁死亡过程。TIAN等[31]的实验证明,槲皮素能通过激活Nrf2 信号通路上调HMOX1 的表达,以保护内皮细胞免受氧化应激。LUO 等[32]的研究发现,槲皮素可通过HMOX1 诱导调节巨噬细胞中以还原型辅酶Ⅱ为来源的超氧阴离子的产生,且该过程与Nrf2 的核内积累和其负调控因子KEAP1 的下调有关。当归补血汤能增加细胞的能量代谢,铁是血红蛋白携氧必不可少的因素,其代谢过程发生异常会导致贫血。故槲皮素可能通过调控HMOX1 及STAT1靶点基因从而激活Nrf2通路,可能与细胞铁死亡过程被抑制有关。
PPARγ 是一类由配体调节的核激素受体,主要负责脂类的分解代谢等[33]。MA 等[34]证明,药物可通过调节肾炎模型小鼠Nrf2及PPARγ途径发挥抗氧化和抗炎作用。MAPK8 与MAPK14 同为丝裂原活化蛋白激酶,是MAPK 通路的核心因子。MAPK 是细胞外信号从细胞表面传导至细胞核内部的重要传递者,可被氧化应激反应及多种促炎因子激活,广泛参与细胞内多种信号传导过程,对Nrf2/HMOX1通路具有激活和调节作用[35]。LI 等[36]通过细胞实验证明,药物可通过靶向MAPK -Nrf2/ARE 信号通路,从而保护黑色素细胞免受氧化应激。但MULATI 等[37]通过动物实验证明,异鼠李素通过抑制MAPK 信号通路改善了高脂肪和高果糖饮食模型小鼠的认知障碍,提示MAPK通路在调节氧化应激过程中可能发挥双向作用。WU 等[38]的研究发现,异鼠李素可通过Nrf2/ HMOX1 信号通路缓解高糖缺氧HT22 海马神经元的炎性反应。根据分子对接结果,推测异鼠李素可能通过MAPK 与PPARγ 共同调节Nrf2 信号通路,从而缓解细胞氧化应激反应。
综上所述,当归补血汤活性成分可能作用于多个VD 靶点相关通路,调控氧化应激损伤机制或铁死亡各个环节,从而缓解或逆转受损细胞的氧化应激过程。

