肾气丸加减方对高糖高脂诱导的MIN6细胞保护作用及PI3K/AKT/GSK-3β信号通路的影响
张月颖 张珊 温志歌 史佩玉 王皓朔 倪青
胰岛β细胞功能受损是2型糖尿病发生发展的中心环节,故保护和恢复胰岛β细胞功能是改善和治疗2型糖尿病的重要策略。近年来研究者认为胰岛内分泌细胞间命运转换是导致糖尿病胰岛功能下降的重要原因[1-2],胰岛β细胞“去分化”的发现拓展了β细胞功能损伤的机制范围,去分化即β细胞在应激状态下退化成具有多分化潜能的前体细胞,丧失部分或全部胰岛素分泌的能力,当应激环境解除后,其可再分化为具有正常分泌功能的β细胞,此过程与遗传基因和后天环境因素有关[3-4]。既往研究证实,补肾法在糖尿病治疗中可以起到降血糖、保护胰岛细胞功能作用[5-7]。金匮肾气丸出自经书《金匮要略》,功用补肾填精,助阳化气,本研究中药肾气丸加减方以金匮肾气丸为基础方加减化裁,去炮附子以防止其辛热伤津,加黄芪、党参健脾益气,气津双补,胡芦巴温肾阳助气化和马齿苋清热利湿以应标本兼顾治则。
胰岛β细胞去分化机制为β细胞功能富集基因的下调,其中比较关键的两个基因为胰腺十二指肠同源盒基因(pancreatic duodenal homeobox-1,PDX-1)和肌腱膜纤维肉瘤癌基因同系物 A(v-maf musculoaponeurotic fibrosarcoma oncogene homologue A,MafA),PDX-1是胰腺发育成熟过程中重要转录因子,对β细胞增殖和胰岛素分泌功能起重要作用[8-9],MafA特异存在于胰岛β细胞,与PDX-1共同促进胰岛素基因表达,是胰岛β细胞分化过程中重要激活因子[10-11],PDX-1和MafA可作为量化β细胞再生和功能“再恢复”的标志物[12],其稳定性受糖原合成酶激酶-3β (glycogen synthase kinase-3β,GSK-3β)的影响。GSK-3β是一种多功能丝氨酸/苏氨酸激酶,在能量代谢、细胞生长和凋亡中起重要作用[13],GSK-3β可调节胰岛β细胞中PDX-1的稳定性,其过度激活可导致胰岛β细胞增殖减少和功能下降[14-15]。在此基础上,本研究从β细胞凋亡角度基于磷脂酰肌醇3-激酶/丝氨酸—苏氨酸激酶/糖原合成激酶3β(phosphoinositide3-kinase/threonine-protein kinase/glycogen synthase kinase-3,PI3K/Akt/GSK-3β)信号通路探究肾气丸加减方对高糖高脂作用下MIN6细胞功能影响及可能作用机制。
1 材料与方法
1.1 细胞
小鼠胰岛β细胞(MIN6),购于上海雅吉生物科技有限公司,完成细胞及种属鉴定。
1.2 实验药物
肾气丸加减方药物组成:生地黄24 g、生山药12 g、山茱萸12 g、茯苓9 g、泽泻9 g、牡丹皮9 g、桂枝3 g、黄芪12 g、党参9 g、胡芦巴6 g、马齿苋9 g。含药血清制备:健康SD大鼠20只,6~8周龄,体质量300~350 g,购买于北京维通利华实验动物技术有限公司,适应性喂养结束后,随机分为肾气丸加减方含药血清组及空白血清组。根据大鼠与人的药物用量换算比(6.25∶1),每只大鼠的每日使用中药灌胃剂量按以下公式计算:6.25×成人每日剂量(114 g生药)/成人平均体重(70 kg)=10.2 g/(kg·d)。空白组予纯净水同等计量灌胃,每12小时灌胃一次,连续灌胃3.5天,使血药浓度稳定。最后一天灌胃结束2小时后,使用3%戊巴比妥钠按照30 mg/kg腹腔注射进行麻醉,行腹主动脉取血,室温静置2小时,使用低温高速离心机离心,3 500 rpm,离心15分钟,使用无菌移液枪吸取上清至新的离心管,即为血清,冻存于-80°C冰箱。
1.3 主要试剂与仪器
RPMI1640培养基(Gibco,11875-093),胎牛血清FBS(Gibco,10099141),高糖高脂试剂盒(鲲创,KT002),0.25%胰酶+0.02%EDTA(Gibco,25300054),CCK-8试剂盒(北京翱擎生物,AQ308),胰岛素放射免疫分析盒(北方生物技术研究所,国药准字S10930046),ANNEXIN V- FITC/PI 凋亡检测试剂盒(Solarbio,CA1020),Anti-β Actin(Abcam, ab8245),Anti-PI3K(CST, 4257),Anti-p-PI3K(CST, 4228s),Anti-Akt(CST, 4691),Anti-p-Akt(CST, 4060s),Anti-GSK-3β(Abcam,ab93926),Anti-p-GSK-3β(ser-9)(CST,5558T),Anti-PDX-1(Abcam,ab134150),Anti-MafA(Abcam,ab264418),LY294002(Abcam,ab120243)。
倒置相差显微镜(Nikon,日本),T25/T75细胞培养瓶(430641,CORNING),细胞培养箱(HERAcell150i,Thermo),酶标仪(680,Bio-Rad),电泳仪(PowerPacTM,Bio-Rad),蛋白垂直电泳槽(MINI SUB,Bio-Rad)。
1.4 细胞造模建立与分组干预
参考制备糖脂毒性细胞模型相关实验文献,本实验选用30 mmol/L葡萄糖(Glu)+棕榈酸钠(PA)进行造模,结合细胞活力及半数抑制率,设计实验梯度进行PA造模条件摸索。为观察肾气丸加减方含药血清促进MIN6增殖的最佳药物浓度,根据药物和大鼠血清的占比,含药培养基设计2.5%、5%、10%、15%、20%不同浓度梯度预培养24小时后,根据上述最佳造模条件继续干预24小时观察最佳作用时间,实验重复5次,按照肾气丸加减方含药血清促进MIN6增殖的最佳浓度进行后续实验。
根据上述结果,实验干预分组如下:空白组:培养基+15%空白血清;模型组:30 mmol/L Glu+0.4 mmol/L PA+培养基+15%空白血清;肾气丸加减方低剂量组:5%肾气丸加减方含药血清预培养24小时,后使用30 mmol/L Glu+0.4 mmol/L PA+5%肾气丸加减方含药血清+10%空白血清培养基培养;肾气丸加减方中剂量组:10%肾气丸加减方含药血清预培养24小时,后使用30 mmol/L Glu+0.4 mmol/L PA+10%肾气丸加减方含药血清+5%空白血清+培养基培养;肾气丸加减方高剂量组:15%肾气丸加减方含药血清预培养24小时,后使用30 mmol/L Glu+0.4 mmol/L PA+15%肾气丸加减方含药血清+培养基培养;通路阻滞剂组(LY294002):15%肾气丸加减方含药血清预培养24小时,后使用30 mmol/L Glu+0.4 mmol/L PA +15%肾气丸加减方含药血清+培养基+50 μmol/L LY294002培养。
1.5 检测指标及方法
1.5.1 CCK-8法检测细胞活力 CCK-8法评估空白组、模型组及肾气丸加减方低、中、高剂量组MIN6细胞活力:取对数生长期的MIN6细胞按照浓度1×105个细胞/mL(预实验确定细胞个数)接种于96孔板,每孔加入100 μL细胞混悬液,每组设5个复孔,边缘留空白孔加入PBS,以免细胞混悬液蒸发。
CCK-8反应:按照预定时间取出孵育细胞,弃去孔中培养基,每孔加入10% CCK-8液在空白培养基中(孔中不能有气泡),培养板继续按照规定时间孵育。
上机检测:按照预定时间观察细胞颜色并上酶标仪检测,吸光值设定为450 nm,测定不同组别吸光度值。
1.5.2 细胞上清液胰岛素含量测定 采用胰岛素放射免疫分析试剂盒检测空白组、模型组、肾气丸加减方低、中、高剂量组MIN6细胞上清液胰岛素含量。(1)药品准备:Ins.标准品、125I-Ins、豚抗-Ins.抗体、驴抗豚免疫分离剂、Ins.质控血清、Ins.缓冲液。(2)测定步骤:取圆底聚苯乙烯试管若干,用记号笔或特殊铅笔编号NSB、S0-S5和待测样品管等,然后用微量加样器按表1加样。加样前所有试剂(尤其分离剂)包括待测样品要摇匀,并且最好平衡到室温,每组重复3次。(3)数据处理: 由电脑自动处理得出结果,使用log-logit处理模式。

表1 加样程序表 (单位:μL)
1.5.3 流式细胞术检测细胞凋亡率 细胞以2×105个/mL接种于6孔板中,每孔加2 mL细胞混悬液,待细胞贴壁后按照1.4实验分组给予不同处理,干预24小时后根据Annexin V FITC/PI 凋亡检测试剂盒说明书进行实验:(1)使用细胞刮刀轻轻仔细刮下细胞(避免胰酶对细胞消化的伤害)转移至15 mL离心管,同上清液一起离心,离心结束后弃去上清,用预冷的含2%FBS的PBS洗涤细胞2次,第2次离心结束后使用1 × Buffer重悬细胞,进行细胞计数,每组重复3次。(2)按照说明书调整细胞上机浓度为1×106个/mL,取100 μL转移至Falcon流式管(提前在F管中加入AV、PI各5 μL),轻弹管身,充分混匀。(3)室温避光孵育15分钟后各管加入200 μL× Buffer,过滤后上机检测。
1.5.4 PI3K/AKT/GSK-3β信号通路和PDX-1/MafA蛋白表达检测 免疫蛋白印迹法样本收集:对数生长期的MIN6细胞以2×105个/mL接种于6孔板中,每孔加2 mL细胞混悬液,待细胞贴壁后按照实验分组给予不同处理,干预24小时后处理细胞。BCA 法测定蛋白浓度并将各组浓度调平,蛋白样品经凝胶电泳后转移至PVDF膜,封闭后加入一抗按一定比例稀释抗体的抗体稀释液中,置于4°C冰箱摇床上,摇荡过夜。次日洗膜后孵育二抗(1∶5 000), 孵育结束洗膜后利用ECL化学发光法显影,采用 Image J软件统计蛋白条带的灰度值及其相对应的内参蛋白条带的灰度值。目的条带灰度值/内参条带灰度值,即为每个样本所含目的蛋白的相对含量。每个目的基因至少测定3个样本。
1.6 统计学方法

2 结果
2.1 MIN6细胞模型的成功构建
30 mmol/L Glu联合PA呈梯度依赖性抑制MIN6细胞增殖,PA浓度越高细胞活力越低,直线回归分析得出PA抑制细胞增殖的IC50值为0.38 mmol/L,故最终本实验选取0.4 mmol/L PA联合30 mmol/L Glu对MIN6细胞进行造模。见表2。
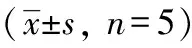
表2 PA造模法各浓度MIN6细胞活力吸光度值
2.2 肾气丸加减方含药血清改善MIN6细胞损伤模型的作用
与空白组相比,模型组细胞存活率显著下降(P<0.01)。与模型组比较,不同浓度肾气丸加减方组含药血清干预细胞后,细胞存活率均有不同程度的升高,其中2.5%含药血清组比较无统计学差异(P>0.05),5%、10%、15%以及20%组细胞存活率均有提升(P<0.05或P<0.01),其中5%~15%组细胞存活率呈升高趋势,20%组细胞存活率较15%组出现下降,因此,选用15%组作为实验中药高剂量组,10%、5%依次作为实验中、低剂量组。见表3。
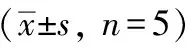
表3 各组MIN6细胞活力吸光度值
2.3 肾气丸加减方含药血清对MIN6细胞胰岛素分泌的影响
胰岛素放射免疫分析结果显示,与空白组比较,模型组MIN6细胞胰岛素分泌水平显著下降(P<0.01)。与模型组细胞比较,肾气丸加减方各组MIN6细胞胰岛素分泌水平均升高(P<0.05或P<0.01)。见表4。
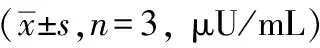
表4 各组MIN6细胞胰岛素分泌水平
2.4 肾气丸加减方含药血清对糖脂毒性诱导的MIN6细胞凋亡的影响
流式细胞实验结果显示,与空白组比较,模型组MIN6细胞凋亡显著升高(P<0.01)。与模型组比较,肾气丸加减方低、中、高剂量组MIN6细胞凋亡率均出现下降(P<0.05或P<0.01),其中高剂量组MIN6细胞凋亡率最低。见表5,图1。
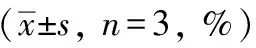
表5 各组MIN6细胞凋亡率
2.5 肾气丸加减方含药血清对MIN6细胞PI3K/AKT/GSK-3β信号通路蛋白表达的影响
2.5.1 MIN6细胞PI3K/AKT/GSK-3β信号通路蛋白表达检测 蛋白免疫印迹结果显示,与空白组对比,模型组中PI3K/p-PI3K、AKT/p-AKT及p-GSK-3β蛋白表达均降低(P<0.05或P<0.01),GSK-3β表达量升高(P<0.05)。与模型组对比,肾气丸加减方中剂量组、高剂量组中PI3K/p-PI3K、AKT/p-AKT及p-GSK-3β蛋白表达均升高(P<0.05或P<0.01),GSK-3β表达量降低(P<0.01)。通路阻滞剂组中肾气丸加减方上述结果被抵消(P<0.05或P<0.01)。见表6,图2。
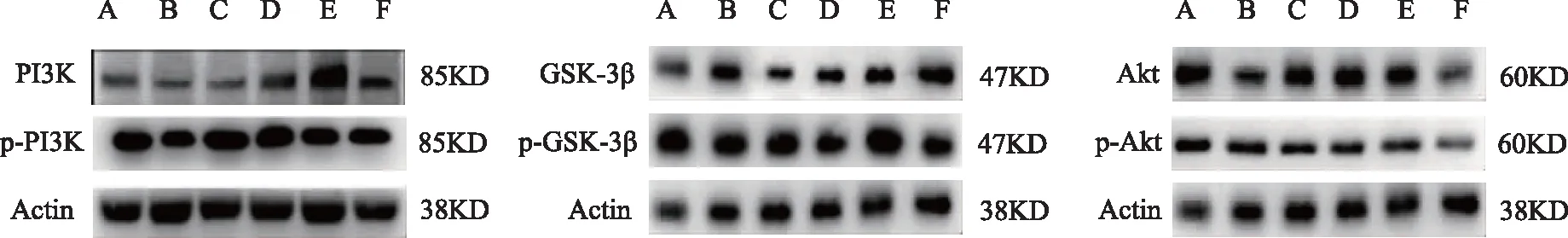
注:A为空白组,B为模型组,C为肾气丸加减方低剂量组,D为肾气丸加减方中剂量组,E为肾气丸加减方高剂量组,F为通路阻滞剂组。
表6 不同干预措施下MIN6细胞PI3K/Akt/GSK-3β信号通路的蛋白表达 目标蛋白/Actin)
2.5.2 MIN6细胞PDX-1/MafA蛋白表达检测 蛋白免疫印迹结果显示,与空白组对比,模型组中PDX-1及MafA蛋白表达均降低(P<0.05或P<0.01)。与模型组对比,肾气丸加减方各组中PDX-1及MafA蛋白表达均升高(P<0.05或P<0.01)。LY组中肾气丸加减方上述结果被抵消(P<0.05或P<0.01)。见表7,图3。
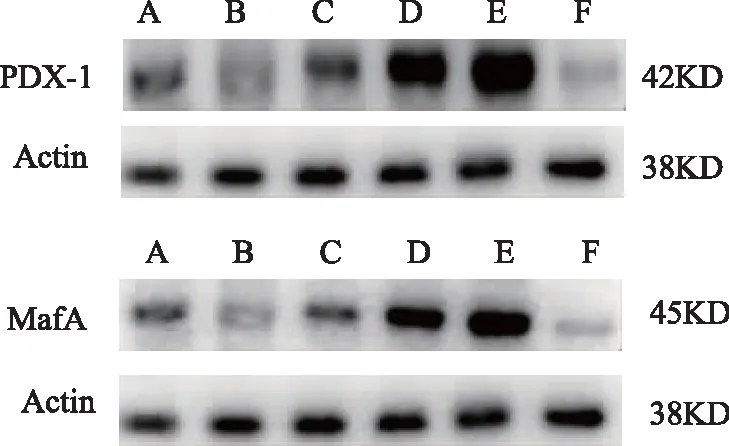
注:A为空白组,B为模型组,C为肾气丸加减方低剂量组,D为肾气丸加减方中剂量组,E为肾气丸加减方高剂量组,F为通路阻滞剂组。
表7 不同干预措施下MIN6细胞PDX-1/MafA蛋白的表达 目标蛋白/Actin)
3 讨论
2型糖尿病属中医“消渴”范畴,病因包括先天禀赋不足、后天失养,病及五脏,尤与脾肾二脏密切相关。“脾主运化”是维持胰岛功能和血糖稳态的核心环节,恢复脾主运化功能可改善糖尿病胰岛功能衰竭[16]。胰岛β细胞衰竭原因是去分化而非凋亡,去分化过程与基因表达及结构功能蛋白变化相关,结合中医肾主先天基础理论,因此本研究选方肾气丸加减方,源于《金匮要略》经方金匮肾气丸加减,本方补肾气基础上去大辛大热的附子,改用胡芦巴温阳化气,加用黄芪、党参健脾助气化,马齿苋清热利湿,全方补泄兼施,共奏补肾健脾,助阳化气之功效。现代药理研究表明,肾气丸君药生地有效成分环烯醚萜苷类具有促胰岛素分泌和保护胰岛细的胞功能[17-18],胡芦巴的有效成分胡芦巴碱能有效改善糖尿病大鼠糖脂代谢[19],马齿苋有效成分马齿苋多糖可促进胰岛β细胞PDX-1蛋白表达,对胰岛β细胞的增殖再生有促进作用[20],这为本研究选用肾气丸加减方提供了理论基础和实验稳定性。
慢性应激环境是胰岛β细胞去分化的主要诱导因素,糖尿病发生发展过程中出现的高血糖和脂代谢紊乱是人体处于氧化应激内环境的主要原因之一[21],慢性应激环境的解除是胰岛β细胞再分化的前提基础,基于此,本研究选用高糖联合棕榈酸钠来模拟糖尿病人体内高糖高脂内环境,观察在高糖高脂作用条件下,肾气丸加减方对胰岛细胞功能的保护作用及作用机制。本研究选用30 mmol/L 葡萄糖联合0.4 mmol/L棕榈酸钠作用24小时作为构建体外细胞损伤模型的条件,CCK-8法测定模型组细胞活力值明显下降,流式细胞实验显示模型组细胞凋亡率上升,说明成功构建了稳定的体外胰岛β细胞损伤模型。在上述造模条件下,加入不同浓度肾气丸加减方含药血清干预24小时后,通过CCK-8法和流式细胞实验观察不同组MIN6细胞活力和凋亡率,结果显示与模型组比较,肾气丸加减方中、高剂量组细胞活力明显升高,细胞凋亡水平下降,结合胰岛素分泌水平的测定,证实肾气丸加减方可提高高糖高脂造模条件下MIN6细胞活力,减少细胞凋亡率,显著促进胰岛素分泌,保护胰岛β细胞功能。本研究中模型组细胞凋亡率为30%左右,但胰岛素分泌水平却下降很多,因此,是否有一部分细胞未发生凋亡,但已经失去了胰岛素分泌水平,无论胰岛细胞凋亡还是去分化都属于胰岛β细胞功能障碍,肾气丸加减方起到了恢复胰岛β细胞功能的作用。
PDX-1与MafA基因被认为是胰岛素基因转录“调节器”,其中PDX-1主要参与胰岛细胞生理功能的维持,是胰腺发育形成的开关基因[22],对胰岛β细胞具有促增生和抗凋亡的作用[23],PDX-1表达减少会造成胰岛β细胞功能减退,自我修复能力减弱,使胰腺组织在高血糖环境中自我修复能力减弱,进而加重糖尿病进展,因此在调控胰岛β细胞成熟、保护胰岛β细胞功能以及促进胰岛β细胞再生中,PDX-1因子的重要性处于核心位置。MafA作为胰岛β细胞特异性转录因子,是葡萄糖刺激胰岛β细胞进行胰岛素基因表达的关键转录因子之一,与PDX-1分别结合胰岛素基因启动子调控区域的C1、A3顺式作用元件,协同激活胰岛素基因表达,促进胰岛β细胞分泌胰岛素,它在β细胞分化的最后阶段胰岛素生成细胞成批发育时才有所表达,对β细胞的生存、增殖有重要作用[24]。PI3K/AKT作为胰岛β细胞中经典代谢通路,其参与胰岛β细胞增殖、胰岛素代谢、葡萄糖利用等多个环节,对胰岛β细胞功能维持具有重要作用,这个信号通路的开启信号通路调控着下游蛋白,包括哺乳动物雷帕霉素靶蛋白(mTOR)和GSK-3β,GSK-3β通路调节细胞凋亡和炎症等多种生物活性[25],活化的AKT作为GSK-3β的上游因子,与GSK-3β结合后使GSK-3β丝氨酸9位点磷酸化而失活,因此p-GSK-3β可发挥抗凋亡作用。同时,GSK-3β调节着胰岛β细胞中PDX-1的稳定性,GSK-3β作为糖原合成酶激酶的一种亚型,其过度激活对其他蛋白有降解作用[23]。本研究中模型组的GSK-3β蛋白表达升高,GSK-3β被激活同时PDX-1、MafA表达受抑制,其机制可能是由于GSK-3β参与了PDX-1和MafA蛋白的降解;肾气丸加减方干预后,GSK-3β表达受到抑制,p-GSK-3β蛋白、PDX-1和MafA蛋白表达均上调,且加入通路阻滞剂LY294002后,肾气丸加减方以上作用被抵消,证明肾气丸加减方可能通过PI3K/AKT/GSK-3β通路提高了PDX-1和MafA蛋白的表达,以此恢复胰岛β细胞功能。
综上所述,肾气丸加减方含药血清可以提高糖脂毒性作用下MIN6细胞活力,减少细胞凋亡,促进胰岛素分泌。作用机制与 PI3K/AKT/GSK-3β 信号通路的激活、抑制GSK-3β的表达有关,进而升高PDX-1和MafA的蛋白表达,保护和恢复胰岛β细胞功能。

