金芪降糖片调控AMPK/NOX4/IRS1信号通路改善2型糖尿病大鼠肝脏胰岛素抵抗机制研究
史丽伟 布天杰 史佩玉 连心逸 张美珍 倪青
2013年我国成人糖尿病(diabetes mellitus, DM)患病率为10.4%,DM患病人数约为1.144亿,居全球首位[1]。从2000至2019年的20年间,2型糖尿病(type 2 diabetes mellitus,T2DM)的患病率每年增长超过1.5%[2]。T2DM约占成人DM发病类型的90%以上。胰岛素抵抗(insulin resistance,IR)伴随胰岛β细胞功能缺陷所致的胰岛素分泌减少是T2DM显著的病理生理学特征[3]。目前积极改善IR仍是T2DM治疗的关键策略之一[4]。金芪降糖片源自《备急千金要方》中治疗消渴症的经典名方,由黄连、黄芪、金银花组成,具有清热益气作用,用于治疗消渴病气虚内热证。研究发现,金芪降糖片对T2DM具有一定疗效,可以改善T2DM糖脂代谢、减轻IR及保护胰岛β细胞功能[5-7]。氧化应激是T2DM大鼠糖脂代谢紊乱及IR的重要机制之一[8],研究拟探讨金芪降糖片改善T2DM大鼠糖脂代谢、IR、氧化应激的作用以及改善T2DM大鼠肝脏IR的作用机制。
1 材料与方法
1.1 动物
6周龄SPF级雄性SD大鼠40只,体质量(160±20)g,购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2012-0001],饲养于中国中医科学院广安门医院SPF II级实验动物中心,每笼5~6只。实验前适应性饲养1周,饲喂标准大鼠合成饲料(购自江苏协同医药生物工程有限责任公司),自由饮用纯净水,环境温度(22±2)℃,相对湿度45%~70%,人工控制室内照明,予昼夜各12小时的规律光照,保持良好通风,实验动物均受人道对待。
1.2 药物
金芪降糖片由天津中新药业集团股份有限公司隆顺榕制药厂生产,0.56 g/片×12片×3板/盒,国药准字Z10920027。盐酸二甲双胍片由中美上海施贵宝制药有限公司生产,500 mg/片×20片/盒,国药准字H20023370。盐酸二甲双胍成人(70 kg)每日常用剂量为1.5 g,金芪降糖片每日常用剂量为5.04 g,以成人(70 kg)每日每公斤体重用药量的7倍作为大鼠等效剂量。临用时用0.9%生理盐水配制成混悬液,灌胃体积10 mL/kg。
1.3 试剂与仪器
链脲佐菌素(streptozotocin,STZ)、戊巴比妥钠由美国SIGMA公司生产;糖化血红蛋白(hemoglobin a1c, HbA1c)试剂盒、超氧化物歧化酶(superoxide dismutase, SOD)测试盒、丙二醛(malonaldehyde, MDA)测试盒、谷胱甘肽(glutathione,GSH)测试盒均由南京建成生物工程研究所生产;大鼠胰岛素测试盒由上海睿铂赛生物科技有限公司生产。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)α抗体、p-AMPKα(Thr172)抗体、胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)抗体、p-IRS-1(Ser307)抗体购自CST公司,还原型辅酶Ⅱ氧化酶-4(nicotinamide adenine dinucleotide phosphate oxidase type 4, NOX4)抗体购自Abcam公司,β-Actin内参均购自博奥森生物技术有限公司;羊抗小鼠IgG-HRP、羊抗兔IgG-HRP均购自索莱宝生物有限公司。SynergyTMH1全功能酶标仪(BioTek公司,美国),离心机(TOMOS公司,美国),电热恒温水浴箱(北京长安科学仪器厂),磁力加热搅拌器(江苏金城国胜实验仪器厂),高速恒温冷冻离心机(eppendorf公司,德国),蛋白印迹电泳系统(Bio-rad公司,美国),全自动凝胶成像系统 (Bio-rad公司,美国)转移电泳仪(北京六一仪器厂),电泳槽(北京六一仪器厂)。
1.4 分组与模型制备
将40只SPF级雄性SD大鼠适应性饲养1周,随机分为正常饮食组10只和高脂饲料饮食组30只。正常饮食组饲喂标准普通饲料,高脂饮食组饲喂高脂饲料(购自江苏协同医药生物工程有限责任公司,配方如下:基础饲料68.1%、蔗糖10%、猪油10%、蛋黄粉10%、1.5%胆固醇、0.4%胆酸盐)。各组大鼠分别饲养4周后禁食12小时,高脂饮食组大鼠一次性予30 mg/kg STZ(0.1 mol/L pH 4.0柠檬酸缓冲液配制,现配现用)腹腔注射,正常饮食组大鼠予30 mg/kg 柠檬酸缓冲液腹腔注射。STZ注射72小时后,尾静脉采血测定空腹血糖(fasting blood glucose,FBG),若FBG>11.1 mmol/L,即认为T2DM造模成功。高脂饲料组大鼠30只共建模成功24只T2DM大鼠,将其随机分为模型组、二甲双胍组、金芪降糖片组,每组8只,正常饮食组大鼠10只作为空白对照组。空白对照组、模型组分别予0.9%氯化钠注射液10 mL/kg灌胃,二甲双胍组和金芪降糖片组分别予10 mL/kg的盐酸二甲双胍片、金芪降糖片混悬液,干预7周。
1.5 血清及组织标本的制备
各组大鼠干预7周后禁食12小时,30 mg/kg 3%戊巴比妥钠腹腔注射麻醉。麻醉满意后分离腹主动脉取血,将血样置于EP管中室温静置30分钟,随后在4℃条件下,3 000 rpm离心10分钟,取上清分装,-80℃保存备用。各组大鼠处死后,取下整个胰腺、肝脏。各组分别从大鼠胰腺中、尾部相同部位及肝脏中叶相同部位迅速剪取部分胰腺和肝脏组织,生理盐水漂洗干净,浸泡于10%福尔马林中固定,行胰腺、肝组织苏木精—伊红染色法(hematoxylin-eosin staining, HE)染色及肝糖原染色(periodic acid schiff, PAS)。剩余胰腺、肝组织置于-80℃保存备用。
1.6 观测指标
观察给药前后大鼠的一般情况,各组大鼠给药前、给药后4周及7周各测FBG。采用HbA1c、空腹胰岛素(fasting blood insulin,FINS)、SOD、MDA、GSH检测试剂盒分别检测HbA1c、FINS、SOD、MDA、GSH水平。应用胰岛素抵抗指数(homeostatic model assessment of insulin resistance, HOMA-IR)评估IR,HOMA-IR=FBG(mmol/L)×FINS (μU/mL)/22.5。采用全自动生化分析仪检测肝功能、血脂四项[总胆固醇(total cholesterol, TC)、甘油三酯(triglycerides, TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)]。肝脏、胰腺HE染色及肝脏PAS染色按照标准操作流程进行。
各组大鼠干预7周后禁食12小时,麻醉取血样后处死,迅速取下整个肝脏,-80℃保存备用。空白对照组、模型组及药物干预组每组选取3只大鼠,采用免疫蛋白印迹法检测肝组织AMPK/NOX4/IRS1相关信号通路蛋白表达水平。肝组织预处理及细胞蛋白提取均在冰上或4℃进行。加入裂解液1 mL进行研磨,BCA法测定蛋白浓度并将各组浓度调平,蛋白样品经凝胶电泳后转移至PVDF膜,用封闭液按照 1∶1 000比例稀释一抗AMPK、p-AMPK(Thr172)、NOX4、IRS-1、p-IRS-1(Ser307)蛋白表达,4℃摇床过夜。一抗孵育结束,室温下TBST洗膜3次,每次10分钟。按照 1∶2 000比例稀释山羊抗兔IgGHRP抗体,室温孵育1小时,以TBST洗膜3次,每次10分钟。ECL化学发光法显影,采用ImageJ 1.52软件进行蛋白条带分析。
1.7 统计方法
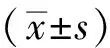
2 结果
2.1 金芪降糖片对T2DM大鼠体质量的影响
实验中发现,正常组大鼠毛发光泽,活动正常,对外界环境刺激反应灵敏;模型组大鼠毛发枯槁,多饮、多尿,行动迟缓,易惊易躁。大鼠造模成功后,各组大鼠体质量无统计学差异。药物干预2周、4周、7周后,金芪降糖片组大鼠、二甲双胍组大鼠与模型组大鼠体质量变化无统计学差异(P>0.05),对照组大鼠体质量明显大于模型组和各药物干预组大鼠体质量(P<0.01),见表1。
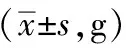
表1 金芪降糖片对T2DM大鼠体质量的影响
2.2 金芪降糖片对T2DM大鼠FBG的影响
与空白组比较,模型组大鼠FBG明显升高(P<0.01)。各组药物干预前FBG水平与模型组比较差异无统计学意义(P>0.05)。金芪降糖片组、二甲双胍组分别干预4周、7周后FBG水平均较模型组明显下降(P<0.01)。二甲双胍组药物干预4周、7周后FBG水平低于金芪降糖片组,但差异无统计学意义(P>0.05),见表2。
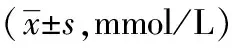
表2 金芪降糖片对T2DM大鼠FBG的影响
2.3 金芪降糖片对T2DM大鼠HbA1c及FINS的影响
模型组大鼠HbA1c、FINS、HOMA-IR明显高于空白对照组(P<0.05)。与模型组比较,金芪降糖片组与二甲双胍组HbA1c、FINS、HOMA-IR水平均低于模型组(P<0.05),两药物组间无统计学差异(P>0.05)。两药物干预组HbA1c水平与空白对照组差异无统计学意义(P>0.05)。金芪降糖片组FINS水平高于空白对照组(P<0.05)。金芪降糖片组、二甲双胍组HOMA-IR均高于空白对照组(P<0.05)。见表3。

表3 金芪降糖片对T2DM大鼠HbA1c、FINS、HOMA-IR的影响
2.4 金芪降糖片对T2DM大鼠氧化应激指标的影响
模型组T2DM大鼠SOD、GSH水平明显低于空白对照组(P<0.05),MDA水平明显高于空白对照组(P<0.05)。金芪降糖片干预7周后T2DM大鼠SOD、GSH水平明显高于模型组(P<0.05),MDA水平明显低于模型组(P<0.05),且金芪降糖片组GSH水平明显高于二甲双胍组(P<0.05)。二甲双胍干预7周后T2DM大鼠MDA水平明显低于模型组(P<0.05),但SOD、GSH水平与模型组差异无统计学意义(P>0.05),见表4。

表4 金芪降糖片对T2DM大鼠SOD、GSH、MDA的影响
2.5 金芪降糖片对T2DM大鼠血脂的影响
模型组TC、TG水平明显高于空白对照组(P<0.05)。金芪降糖片组TC、TG水平明显低于模型组(P<0.05)。二甲双胍组TC、TG水平与模型组差异无统计学意义(P>0.05)。空白对照组、模型组、金芪降糖片组、二甲双胍组LDL-C、HDL-C水平均无统计学意义(P>0.05),见表5。

表5 金芪降糖片对T2DM大鼠TC、TG、LDL-C、HDL-C的影响
2.6 金芪降糖片对T2DM大鼠肝功的影响
空白对照组、模型组、金芪降糖片组、二甲双胍组ALT、AST差异均无统计学意义(P>0.05),见表6。
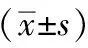
表6 金芪降糖片对T2DM大鼠ALT、AST的影响
表7 金芪降糖片对T2DM大鼠AMPK、NOX4、IRS-1蛋白表达的影响
2.7 金芪降糖片对T2DM大鼠肝脏及胰腺组织病理形态的影响
空白对照组大鼠胰腺组织内,胰岛多呈圆形或椭圆形细胞团,细胞团大小不一,结构规整,分散于胰腺腺泡之间,数量较多,胰岛界限清晰,胰岛内细胞丰富,大小均匀,形态饱满,排列紧密。与正常组大鼠比较,模型组胰岛数目减少,分布稀疏,部分胰岛组织萎缩,胰岛呈不规则形,边界不清,结构紊乱,胰岛内细胞肿胀,变形,胞质着色变浅,并可见核固缩或核缺失的死亡细胞。与模型组大鼠比较,各药物干预组大鼠胰岛数目及胰岛内细胞数目增加,胰岛萎缩程度有所好转,胰岛结构较为完整,见图1。
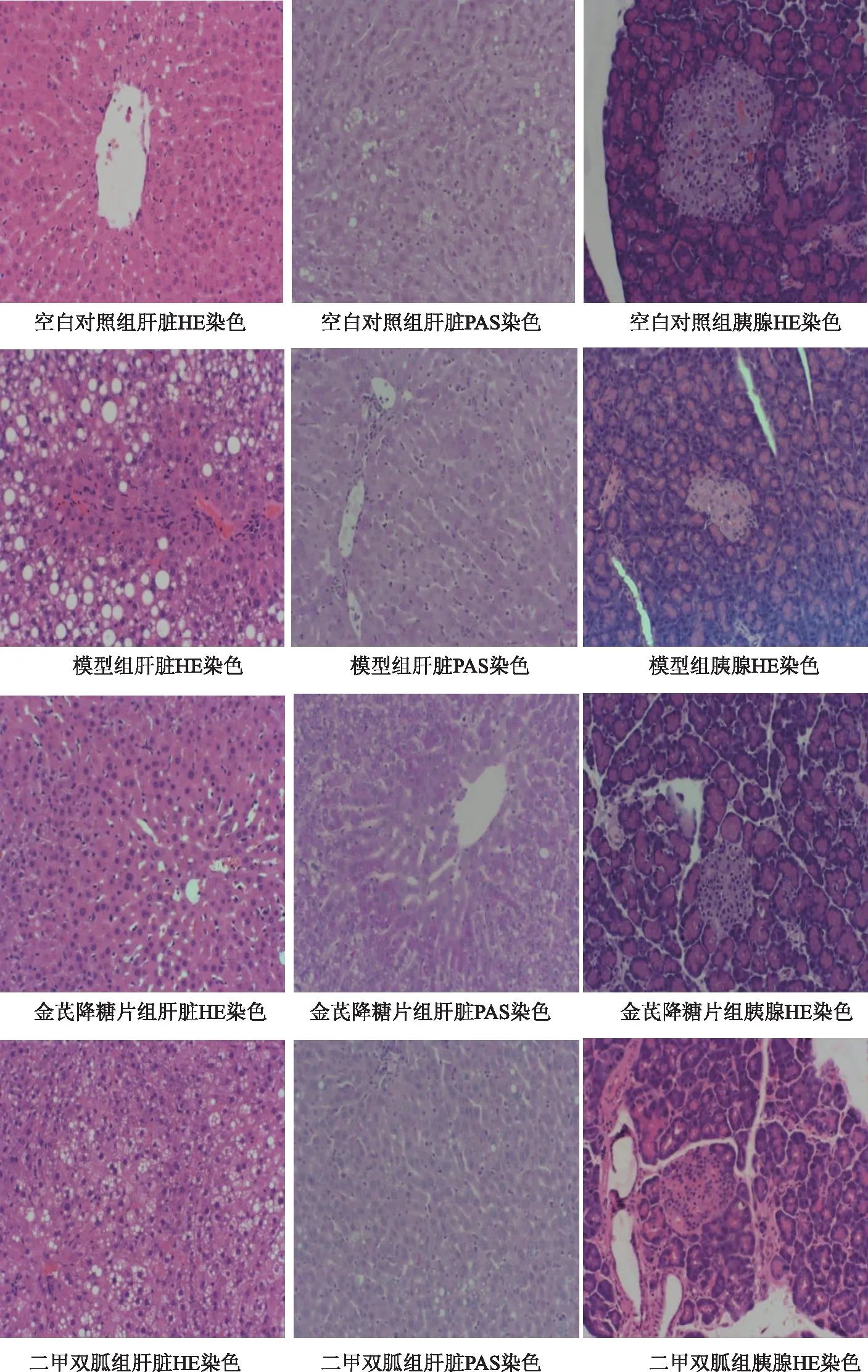
图1 各组大鼠肝脏组织HE染色、PAS染色及胰腺HE染色情况(×200倍)
空白对照组大鼠肝组织结构完整,肝小叶结构清晰,肝细胞以中央静脉为中心向四周以放射状整齐排列,肝窦规则,肝细胞索排列整齐。模型组大鼠肝细胞索排列紊乱,肝细胞多数肿胀,出现中到重度弥漫小泡性脂肪变性、空泡变性,胞浆内可见大小不等、数量不一的脂滴空泡,甚至部分肝细胞出现气球样、纤维化坏死。与模型组比较,各药物干预组大鼠肝细胞排列较为均匀有序,细胞水肿及脂肪变性较模型组明显减轻,见图1。
空白对照组大鼠肝细胞胞质内糖原颗粒呈紫红色,含量丰富,颗粒分布均匀,染色深,细胞间界线清晰。T2DM模型组大鼠肝细胞存在明显脂肪样变性,细胞肿胀,胞质内糖原颗粒分布较对照组明显减少,部分肝细胞甚至出现糖原颗粒缺失。与模型组比较,金芪降糖片组、二甲双胍组肝细胞糖原颗粒均呈增加趋势,但糖原颗粒在肝细胞内分布略差,分布欠均匀,见图1。
2.8 金芪降糖片对T2DM大鼠AMPK、NOX4、IRS-1蛋白表达的影响
T2DM模型组大鼠p-AMPK(Thr172)蛋白表达较空白对照组明显下调(P<0.05),NOX4、p-IRS-1(Ser307)蛋白表达明显上调(P<0.05)。与模型组比较,金芪降糖片组p-AMPK(Thr172)蛋白表达明显上调(P<0.05),金芪降糖片组、二甲双胍组NOX4、p-IRS-1(Ser307)蛋白表达明显下调(P<0.05),两药物组在NOX4、p-IRS-1(Ser307)蛋白表达方面差异无统计学意义(P>0.05)。各组AMPK/NOX4/IRS1相关蛋白表达电泳见图2。
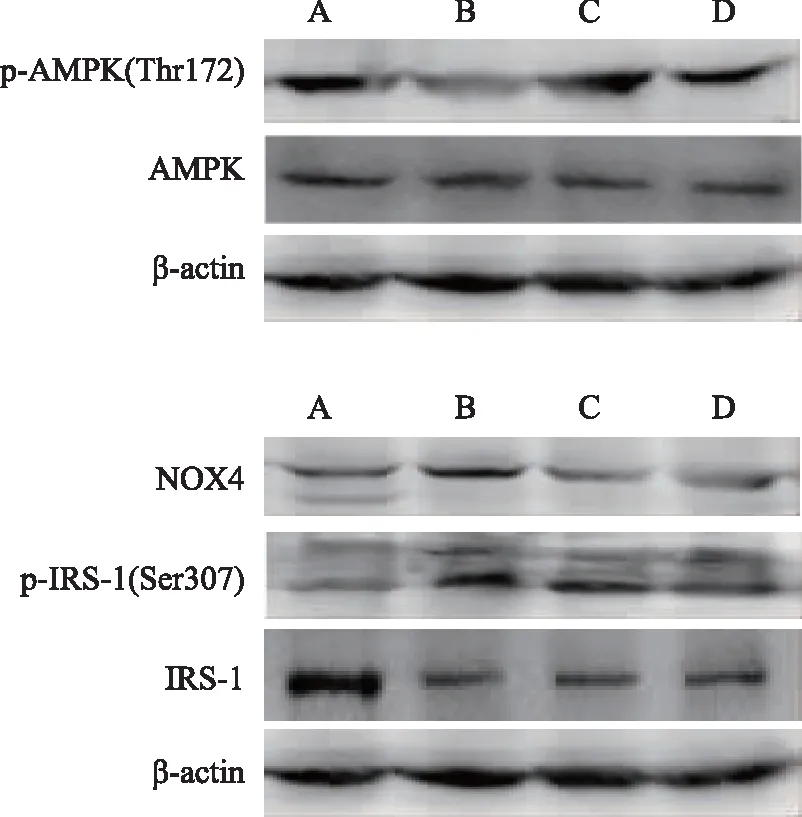
注:A为空白对照组,B为模型组,C为金芪降糖片组,D为二甲双胍组。
3 讨论
DM属于中医“消渴病”范畴,且“病由热生”,其发病与禀赋不足、脏腑柔弱、饮食失节、情志失调、劳逸过度、外感邪毒导致热毒炽盛、阴虚燥热有关,病程日久热盛耗气伤阴[9]。研究显示,益气养阴法治疗T2DM可以显著改善糖脂代谢及降低相关炎症因子,改善IR,提高胰岛素敏感性,修复胰岛β细胞功能[10]。金芪降糖片出自《备急千金要方》,是治疗消渴症的经典名方,由黄连、黄芪、金银花组成,全方共奏清热益气之功,用于治疗消渴病气虚内热证。研究发现,金芪降糖片单药或联合西药用于消渴病气虚内热证具有一定疗效[11]。网络药理学研究发现金芪降糖片可多成分、多靶点、多通路改善IR、保护胰岛β细胞功能[6,12],其治疗DM的作用机制可能与调节细胞增殖与凋亡、减轻氧化应激及炎症反应等有关[13]。氧化应激是由于机体受到刺激,细胞中的活性氧簇(Reactive oxygen species,ROS)产生过多和/或抗氧化防御机制减弱,导致ROS的生成和清除之间失衡,机体出现氧化应激状态[14]。高血糖会上调慢性炎症标志物,增加ROS产生,高浓度ROS诱导的氧化应激可以直接损伤胰腺β细胞功能、加重胰岛素信号传导通路障碍引起IR[14-16]。T2DM高脂、高糖、促炎因子等导致ROS产生过多造成氧化应激,同时使机体总抗氧化应激能力下降,包括SOD、GSH降低及MDA升高,从而加重氧化应激损伤,致使胰岛β细胞损伤和加重T2DM IR[17]。因此,在改善T2DM糖脂代谢的同时,积极增强机体的总抗氧化应激能力具有重要意义。
金芪降糖片组及二甲双胍组大鼠精神状态、活动状况及多饮、多尿症状较T2DM组大鼠明显改善,这可能与高血糖状态得到改善有关。空白对照组大鼠体质量从第2周开始明显高于模型组及各药物干预组,模型组大鼠从第2周开始体质量逐渐缓慢增长,这可能与胰岛β细胞功能损伤后有所恢复有关[18],金芪降糖片组、二甲双胍片组体重增加与各组大鼠一般状况、糖脂代谢、氧化应激以及肝脏、胰腺组织形态学改善相一致。T2DM早期血清高胰岛素血症是IR的重要标志,金芪降糖片与二甲双胍组血糖水平、胰岛素水平及HOMA-IR明显低于模型组,药物干预组血糖水平改善可能与IR减轻有关。同时,金芪降糖片组、二甲双胍组血糖水平较模型组显著下降,但是治疗7周末血糖仍明显高于空白对照组,然HbA1c水平治疗7周末两药物干预组较模型组显著降低,但与空白对照组无统计学差异,究其原因可能为HbA1c是血液中葡萄糖与血红蛋白的氨基之间的非酶催化反应产物,反映过去8~12周总的血糖水平,然该实验从建模成功到干预结束时间7周多,HbA1c未能充分体现出造模后总的血糖水平。T2DM模型组大鼠血清SOD、GSH水平降低而MDA水平升高,提示氧化应激存在。金芪降糖片组能显著增加GSH、SOD水平而降低MDA水平,二甲双胍组能显著降低MDA水平,金芪降糖片组可以显著改善T2DM大鼠氧化应激水平,这对于改善IR具有重要作用。各组大鼠ALT、AST水平无统计学差异,AST水平均高于正常值,这可能与空白对照组大鼠肥胖、模型组及各药物干预组高脂饲养后肝脏脂肪变性有关。金芪降糖片组TC、TG水平明显低于模型组,金芪降糖片对脂代谢改善可能有益于减轻IR。T2DM常合并非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD),IR是T2DM和NAFLD的共同病理基础,IR可导致糖脂代谢紊乱、大量TG在肝脏沉积随之引起氧化应激及炎症反应,促使NAFLD发生发展,同时NAFLD促使糖脂代谢紊乱、加重IR,加剧T2DM并发症发生[19-22]。结合肝脏HE染色、肝脏PAS染色可知,本实验T2DM大鼠合并出现NAFLD,肝脏脂肪变性导致肝脏IR,金芪降糖片改善肝脏组织形态学、降低TG水平、增加肝糖原含量、减轻氧化应激等,从而对肝脏IR具有很好改善作用。此外,金芪降糖片组、二甲双胍组胰腺组织形态学与模型组比较,大鼠胰岛数目及胰岛内细胞数目增加,胰岛萎缩程度有所好转。
AMPK是调节能量代谢的重要蛋白分子,其激活主要调节肝糖异生和肝糖原合成而维持血糖稳态,同时也可以抑制NOX4源性氧化应激对机体损伤[23]。NOX4源性高浓度ROS可能是引起肝脏氧化应激损伤和肝脏IR的关键氧化酶。单一NOX4蛋白分子表达失调足以干扰肝脏IRS/磷脂酰肌醇-3-羟激酶(Phosphatidylinositol 3-kinase, PI3K)/蛋白激酶B(Protein Kinase B, AKT)胰岛素信号通路十几种关键分子蛋白功能[24]。既往研究显示,T2DM大鼠肝脏AMPK磷酸化蛋白表达下调,影响肝糖异生和肝糖原合成,同时影响肝脏氧化应激能力,是T2DM发生发展的重要机制[23]。T2DM大鼠肝脏IR与IRS1信号通路障碍有关,T2DM肝脏p-IRS-1(Ser307)蛋白过表达,会抑制IRS1酪氨酸磷酸化对PI3K/AKT信号通路的激活作用而影响胰岛素信号传导,引起IR[25]。本研究发现,T2DM模型组大鼠p-AMPK(Thr172)蛋白表达明显下调(P<0.05),而NOX4、p-IRS-1(Ser307)蛋白表达明显上调(P<0.05),与既往研究结果一致,同时提示T2DM大鼠肝脏IR可能与AMPK/NOX4/IRS1信号通路蛋白表达异常进而影响胰岛素信号传导及氧化应激对胰岛β细胞损伤有关。金芪降糖片组、二甲双胍组分别干预7周后,其肝脏p-AMPK(Thr172)蛋白表达明显上调(P<0.05),NOX4、p-IRS-1(Ser307)蛋白表达明显下调(P<0.05),两组上述蛋白表达差异无统计学意义。本研究结果显示,金芪降糖片可能通过调控AMPK/NOX4/IRS1信号通路,进而改善胰岛素信号传导及减轻氧化应激对胰岛β细胞损伤而改善T2DM肝脏IR。
综上所述,金芪降糖片可以改善T2DM大鼠糖脂代谢,减轻氧化应激,改善肝脏及胰腺组织形态学,增加肝糖原含量,从而改善肝脏IR。金芪降糖片改善T2DM 肝脏IR的作用机制可能与其调控AMPK/NOX4/IRS1信号通路,激活相关蛋白表达有关。

