HA-RGD对细胞活性因子修复功效影响的研究
张楠 张婷婷



【摘要】目的 通过多种检测方法分析HA-RGD对细胞活性因子修复功效的影响。方法 利用一定的比例构建HA-RGD、细胞活性因子组合物1和组合物2,在细胞水平和人体水平分别评估其对皮肤的修复效果。结果 组合物1和组合物2中受试者人体安全斑贴试验结果均为阴性,未出现不良反应,安全性良好;基于细胞迁移实验,组合物1和组合物2与空白对照相比,相对迁移平均值显著升高(P<0.01);且组合物2和阳性对照效果相似;组合物1和组合物2中受试者的TEWL值在产品使用2周和4周时显著低于0周时(P<0.01),且呈极显著性下降趋势(P<0.001);根据受试者28 d的检测数值,组合物2中受试者的TEWL值在产品使用2周、4周时的下降数值均显著大于组合物1(P<0.01)。结论 HA-RGD对细胞活性因子的修复效果有一定的促进作用,能进一步提升细胞活性因子的修复效果,满足更大的皮肤修复需求市场。
【关键词】多氨基酸多糖缩合物;细胞活性因子;皮肤修复
中图分类号:R392 文献标识码:A 文章编号:1004-4949(2023)18-0070-04
Study on the Effect of HA-RGD on the Repair Efficacy of Cell Active Factor
ZHANG Nan, ZHANG Ting-ting
(Xian Bohong Biotechnology Co. Ltd., Xian 710032, Shaanxi, China)
【Abstract】Objective To analyze the effect of HA-RGD on the repair effect of cell active factors by various detection methods. Methods HA-RGD, cell active factor composition 1 and composition 2 were constructed in a certain proportion, and their repair effects on skin were evaluated at the cellular level and human level, respectively. Results Human safety patch test of subjects in combination 1 and combination 2 were negative, no adverse reactions occurred, and the safety was good. Based on the cell migration experiment, the average relative migration of composition 1 and composition 2 was significantly higher than that of blank control (P<0.01), and the effect of compound 2 was similar to that of positive control. The TEWL values of subjects in combination 1 and combination 2 were significantly lower at 2 weeks and 4 weeks than at 0 weeks (P<0.01), and showed a significant downward trend (P<0.001). According to the 28-day detection value of the subjects, the TEWL value of the subjects in the combination 2 decreased significantly more than that in the combination 1 at 2 weeks and 4 weeks (P<0.01). Conclusion HA-RGD has a certain promoting effect on the repair effect of cell active factors, which can further improve the repair effect of cell active factors and meet the larger market demand for skin repair.
【Key words】Polyamino sugar condesate; Cell active factors; Skin repair
间充质干细胞(mesenchymal stem cells,MSCs)作为一种能够自我更新且具有多向分化潜能的成体干细胞[1,2],其在培养过程中会分泌大量的细胞因子,是除外泌体外另一具有广泛生物学活性的小分子蛋白质,富含细胞活性关键的信息传递物质,这种传递物质被称为细胞活性因子[3]。间充质干细胞对体内受到损伤的组织和细胞的功能恢复起到重要作用,也被称作“生长因子”或“修复因子”[4],主要在护肤品中,起细胞修护组织再生功能[5]。水解透明质酸钠-肽(HA-RGD)为多氨基酸多糖缩合物与水解透明质酸组成,其中RGD是一种含有精氨酸-甘氨酸-天冬氨酸的三肽序列,能与11种整合素特异性结合,能有效促进细胞对生物材料的黏附[6]。整合素是細胞黏附分子家族的重要成员,能介导细胞与细胞、细胞与细胞外间质的黏附及信号传导,调节细胞的黏附、迁移、增殖和凋亡等。整合素又分为4个亚族,其中一族就是RGD受体,在RGD受体中整合素αV和β3是研究最早、最深入的亚型之一。研究表明[7],在部分炎症过程中,整合素αV和β3可能在成纤维细胞激活和伤口愈合等病理生理过程中发挥重要作用。细胞活性因子作为一款具有修复功效的原料,利用超滤浓缩技术将干细胞上清液中的细胞活性因子分离出来[8]。为了进一步提升其修复效果,满足更大的皮肤修复需求市场,本研究利用HA-RGD对于生物材料的黏附性以及其能与整合素特异性结合的特点,通过设计细胞水平和人体水平的实验方案并根据实验数据,研究HA-RGD对于细胞活性因子修复功效的影响,现报道如下。
1 材料与方法
1.1 材料 水解透明质酸钠-肽(HA-RGD>99%):所需原料由陕西未来生物基质工程有限公司固定原料商提供,规格:1 g/支;细胞活性因子(>0.6 mg/ml)由陜西未来肉膳健康科技有限公司固定原料商提供,规格:500 ml/瓶。本次测试所用细胞为成纤维细胞(广东博溪生物科技有限公司),低糖DMEM培养液(博溪生物)、新生牛血清(NBS,兰州荣晔)、细胞培养板(BIOFIL,24孔)。测试志愿者由西安博鸿生物技术有限公司召集。SKINLAB COMBO(Cortex Technology,Dermalab)、低致敏胶带、无屑吸水干纸巾、无尘纸。CO2培养箱(Thermo,150 i)、超净工作台(苏州安泰,SW-CJ-1F)、酶标仪(BioTek,Epoch)、倒置显微镜(Olympus,CKX41)。
1.2 方法
1.2.1用于实验的组合物的制备 按比例称取细胞活性因子(37.5%)和其他原料进行配制,然后过滤除菌、灌装、冻干后得到组合物1,备用;同理,按比例称取原料HA-RGD(0.05%)、细胞活性因子(37.5%)和其他原料进行配制,然后过滤除菌、灌装、冻干后得到组合物2,备用。
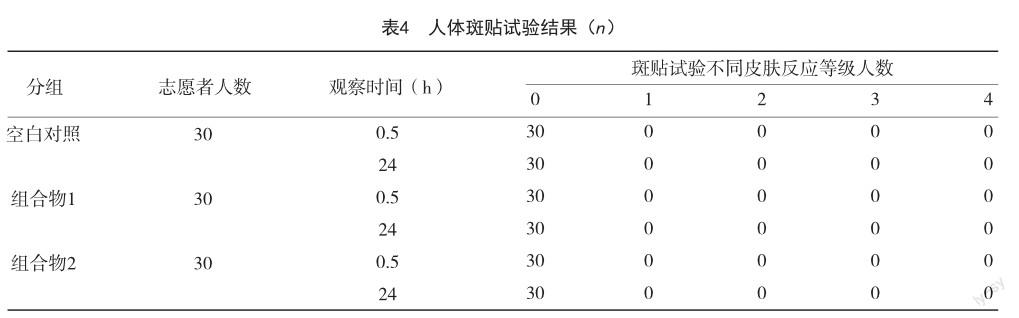
1.2.2安全性验证 人体斑贴试验:依照志愿者入选标准招募肤质符合要求的志愿者30名,年龄20~50岁。采用封闭式试验方法,将受试物置于合适的斑贴试器内,将其用低致敏胶带贴敷于受试者的手臂曲侧,用手掌轻压使之均匀的贴敷于皮肤上,持续24 h,空白对照组为受试者不使用产品。分别在24 h后去除受试器,0.5 h、24 h观察皮肤反应,记录反应结果。

1.2.3具有皮肤修复功能组合物的研究 ①细胞迁移实验:细胞迁移是指细胞在接收到迁移信号或感受到某些物质的刺激后而产生的移动[9];细胞迁移能力增加,表明具有促进创伤修复作用;皮肤受到损伤后,皮肤内的各种细胞主要通过细胞迁移到达损伤部位来进行修复活动,角质形成细胞的迁移能力对表皮损伤修复具有重要作用;将 2×105个细胞/孔接种于24孔板,于37 ℃、5% CO2培养箱内孵育达到完全融合;用无血清培养基清洗细胞,并用10 μg/ml丝裂霉素在培养箱孵育1 h,后用消毒后的10 μl枪头在24孔中心的单层细胞表面划出一条无细胞的伤痕,用基础培养液漂洗数次清洗划痕上的细胞;加入含2%血清的培养液以及用含2%血清培养基配置的样品溶液继续培养,观察16 h后迁移到划痕区细胞的情况,计算迁移相对平均值,每组设3个复孔,实验设计见表2;②经表皮失水率检测:目前大多研究机构通过测定经表皮失水率来评价皮肤屏障功能,其含义是皮肤在汗腺不活动的状态下总的失水量,能够反应角质层对于水的屏障功能,是评价角质层状态的重要因子;TEWL通过评价角质层屏障功能达到预测护肤品通过保湿作用对表皮屏障功能的维护、修复和加强作用,因此本实验方案用TEWL值表征组合物对于皮肤的修复效果;在测试条件下,得到的TEWL值越高,代表单位时间、单位横截面积的经表皮水分流失量越多,皮肤屏障功能越差;TEWL值越低,代表单位时间、单位横截面积的经表皮水分流失量越少,皮肤屏障功能得到改善,具有修复效果。

依据志愿者入选标准招募符合条件的志愿者入组,年龄28~55岁,分组试验。在测试环境中平衡等待30 min,保持放松。后使用低致敏胶带对志愿者测试区域进行粘贴,按压2 s后缓慢剥离,连续撕脱至出现肉眼可见的红斑,然后检测测试区域的经表皮水分流失率记为基础值;发放样品,根据样品使用说明书正确使用产品,测试区域分为样品涂抹区域和对照区域;并在设定的测量时间点2周和4周测量各测试区域的经表皮水分流失率记为测量值,检测方法见表3。

1.3 统计学方法 采用SPSS 28.0统计学软件进行数据分析,计量资料以(x-±s)表示,若测试数据为正态分布,则采用配对样本t检验;若测试数据为非正态分布,则采用秩和检验;P<0.05表示差异有统计学意义,P<0.01表示统计学意义显著,P<0.001表示统计学意义极显著。
2 结果
2.1 组合物的安全性 根据人体斑贴试验结果,参加试验的30名志愿者中,在斑贴试验进行0.5 h以及24 h后撕掉斑贴的皮肤反应均为阴性反应,组合物1和组合物2均未出现不良反应,安全性良好,不良反应发生率为0,见表4。
2.2 具有皮肤修复功效组合物的功效验证结果
2.2.1细胞迁移实验 阳性对照的相对迁移平均值显著高于空白对照,说明本次测试阳性对照有效;组合物1和组合物2与空白对照相比,相对迁移平均值显著升高(P<0.01),且组合物2和阳性对照效果相似,见图1。
2.2.2经表皮失水率测试实验 组合物1和组合物2中受试者的TEWL值在产品使用2周和4周时显著低于0周时(P<0.01),且呈极显著性下降趋势(P<0.001);根据受试者28 d的检测数值,组合物2中受试者的TEWL值在产品使用2周、4周时的下降数值均显著大于组合物1(P<0.01),见图2。
3 討论
细胞活性因子是对细胞分泌的能调节细胞功能的多肽的统称,有促进肌肤细胞组织的分化、促进受损肌肤组织的结构重建和促进受损肌肤深层细胞组织愈合等修复作用[11]。但是由于原料本身的提取纯度、储存条件和配方应用使得修复功效受到一定的限制,经调研发现,可利用RGD对于生物材料的粘附性和能与多种整合素其中包括参与炎症修复过程的αV和β3两种整合素的特异性结合,将细胞活性因子靶向性的带到需要修复的皮肤组织,提升细胞活性因子的修复功能。
由此通过设计多种实验检测手段对HA-RGD对于细胞活性因子修复功效的影响进行研究发现,组合物1和组合物2均未出现不良反应,说明组合物1和组合物2安全无刺激,安全性良好。细胞迁移实验显示,本次测试阳性对照有效,两组组合物对于细胞的相对迁移平均值均有提升,说明两组组合物均可提高细胞迁移速度,对细胞有一定的促进修复效果。且比较发现,组合物2较组合物1有更高的提升数值,说明组合物2有更加良好的促进细胞修复效果。在经表皮失水率测试实验中,TEWL值降低,说明单位时间单位横截面积中经表皮流失的水分减少,皮肤屏障功能得以修复。通过28 d的验证周期,人体修复功效验证数据表明,两组组合物在2周、4周的实验数据发现均能在人体水平上降低经表皮失水率,让敏感肌肤的皮肤屏障更加完整,起到一定的修复功效。且通过比较发现,组合物2较组合物1能更加明显地降低经表皮失水率,说明组合物2在对敏感肌肤屏障修复方面有更加突出的修复效果。本研究旨在探究HA-RGD对细胞活性因子修复功效的影响,发现两组组合物均在细胞水平上可促进细胞迁移能力,从而增强修复功效,能通过降低经表皮失水率来增强皮肤的屏障功能。且组合物2因HA-RGD的添加比组合物1有更加明显的细胞修复效果,得以说明HA-RGD对细胞活性因子的修复效果有一定的提升作用。
综上所述,HA-RGD对细胞活性因子的修复效果有一定的提升作用,可利用HA-RGD中RGD能与多种整合素其中也包括参与炎症修复过程的αV和β3两种整合素的特异性结合,将生物活性材料细胞活性因子黏附在需要修复的细胞上,进而实现智能靶向、精准修复功能,进一步提升细胞活性因子的修复效果。

参考文献
[1] Lee HJ,Kim M.Skin Barrier Function and the Microbiome[J]. Int J Mol Sci,2022,23(21):13071.
[2] Lan T,Luo M,Wei X.Mesenchymal stem/stromal cells in cancer therapy[J].J Hematol Oncol,2021,14(1):195.
[3] Pereira T,Ivanova G,Caseiro AR,et al.MSCs conditioned media and umbilical cord blood plasma metabolomics and composition[J].PLoS One,2014,9(11):e113769.
[4] Mokry J,Pisal R.Development and Maintenance of Epidermal Stem Cells in Skin Adnexa[J].Int J Mol Sci,2020,21(24):9736.
[5] 林苗远,李豫皖,刘毅,等.组织工程皮肤的研究热点及应用价值[J].中国组织工程研究,2022,26(1):153-159.
[6] 中华医学会核医学分会,中国生物物理学会分子影像学分会.整合素RGD受体显像临床应用专家共识(2022版)[J].协和医学杂志,2022,13(2):227-234.
[7] Schittenhelm J,Klein A,Tatagiba MS,et al.Comparing the expression of integrins αvβ3,αvβ5,αvβ6,αvβ8,fibronectin and fibrinogen in human brain metastases and their corresponding primary tumors[J].Int J Clin Exp Pathol,2013,6(12):2719-2732.
[8] 陈凤,杨敏,李彦洁,等.人脐带间充质干细胞的分离培养及多向分化潜能研究[J].生物学杂志,2021,38(5):82-85,90.
[9] 王婷.CARDS Toxin诱导Ⅰ型免疫正反馈回路在肺炎支原体肺炎中的作用及机制研究[D].苏州:苏州大学,2022.
[11] 禚风麟,程海艳,李邻峰,等.纳米微球新型细胞活性因子面膜对面部年轻化的疗效评价[J].临床和实验医学杂志,2019,18(9):963-966.
编辑 扶田

