成熟性囊性畸胎瘤伴肠型黏液上皮进展为交界性黏液性肿瘤1例
何建华,何文娟,赵建芳*,石芳,王玉湘
(1.延安市中医医院病理科,陕西 延安 716000;2.延安市人民医院,陕西 延安 716000)
1 病例资料
患者,女,32岁。发现盆腔肿物7年,每年复查超声,肿块逐渐增大,无明显压痛。体检一般情况良好;专科检查,脐下偏左侧可触及大小约6 cm × 6 cm大小肿块,压痛,边界清楚,活动度较差。腹部CT:左侧附件区囊性占位性病变,少量盆腔积液。临床诊断:盆腔肿瘤。行腹腔镜盆腔肿瘤切除术。术中见左侧附件区肿物,囊性,约7 cm × 7 cm × 7 cm。术后患者一般情况良好,定期复查。
1.1 病理学检查
灰白囊性肿物一个,大小8 cm × 6 cm × 3 cm。切面呈单房囊型,囊内含似胶冻样物。外壁灰白光滑,内壁附少许灰白样物,局灶质地稍硬,紧邻质硬区见一囊壁增厚区,范围约1.8 cm × 1.5 cm,厚0.7~1.2 cm,切面灰黄质中,其余囊壁厚0.2 cm(图1a)。镜下观察:可见分化成熟的皮脂腺、甲状腺滤泡、皮肤组织(图1b),伴钙化等,局灶囊壁被覆肠型上皮(图1c、d)、上皮呈复层排列,肿瘤细胞核增大、深染,具有轻-中度异型性,核分裂象少见,局灶形成腺样和乳头样结构。
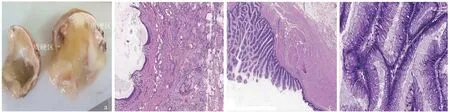
图1 肿物大体形态及病理组织特征
1.2 病理学诊断
盆腔肿物,成熟性囊性畸胎瘤,其内肠型黏液上皮发展为交界性黏液性肿瘤。
2 讨论
卵巢发生的黏液性肿瘤、特别是“交界性黏液性肿瘤”和“黏液腺癌”一直是诊断的难点,因为二者可能是来自于消化系统的转移性黏液性肿瘤。卵巢原发性黏液肿瘤和转移性黏液肿瘤的形态学特点互相重叠;免疫组化标志物非常相似:两者均可以表达CK20和CDX2,而ER和PR几乎总呈阴性表达,提示妇科来源的PAX8的表达率也不足50%;即使是基因检测,两者最常见的基因突变均为K-RAS点突变,因此也不具有鉴别意义。综上所述,从形态学、免疫组化和基因检测上,均难以鉴别原发性和转移性肿瘤。同时,与卵巢的高级别浆液性癌来自于输卵管伞端、子宫内膜样肿瘤来自于子宫内膜异位症等具有明确来源的肿瘤不同,卵巢原发性黏液性肿瘤的来源并不固定,可以来源于畸胎瘤或Brenner肿瘤,也可来源于伴有肠型上皮成分的中低分化支持间质肿瘤等;因此一旦在卵巢黏液性肿瘤周围看到上述肿瘤成分,可以提示该黏液性肿瘤是在上述肿瘤基础上发生的原发性肿瘤。本报道的这例卵巢交界性黏液性肿瘤即来源于畸胎瘤中的肠型黏液上皮,提示为卵巢原发。本例肠型黏液上皮部分被覆单层上皮,局灶可见上皮增生,局灶瘤细胞轻-中度异型,上皮复层排列,可见密集、拥挤的腺样及乳头状结构,即发展为交界性黏液性肿瘤,但还未见重度异型性及异质性的肿瘤细胞,病理性核分裂象少见,间质未见细胞巢、单个细胞浸润,故还未恶变。交界性黏液性肿瘤免疫组化表达CK7、CK20、CDX2,而黏液性癌免疫组化CK7(-)、CK20(+),间变性区域可能丢失CK表达,基因突变为K-RAS点突变,因此免疫组化和基因检测上,均难以鉴别。根据文献报道,卵巢原发性交界性黏液性肿瘤完整切除后患者预后较好。

