CD20阳性T细胞淋巴瘤的临床病理学特征及相关机制
——2例患者临床报告
袁丽倩,张浩,车潇良,杨曦,蔡媛*
(1.宝鸡市中心医院病理科,陕西 宝鸡 721000; 2.宝鸡市中心医院皮肤科,陕西 宝鸡 721000)
白细胞分化抗原20(cluster of differentiation,CD20)是一种由MS4A1基因编码并在B细胞发育早期分化为浆细胞之前表达的糖基化磷蛋白,在B细胞的增殖和分化中发挥重要作用,被认为是B细胞淋巴瘤(B cell lymphoma,BCL)最常见、最具特异性的标志物,且是靶向治疗药物——利妥昔单抗的唯一靶点[1]。近年有文献报道称5%~8%的T细胞淋巴瘤(T cell lymphoma,TCL)表达CD20[2],临床及病理学特征易与BCL相混淆。CD20在TCL中的表达,给淋巴瘤的诊断、分类和治疗方案的选择都带来新的挑战。本文通过对两例CD20阳性TCL的临床及病理学特征、潜在发病机制及诊断要点等进行探讨和总结,旨在减少此类疾病在病理学诊断过程中的误诊率,为后续的临床治疗提供参考。
1 资料与方法
1.1 临床资料
收集宝鸡市中心医院2016年至2022年间2例确诊为CD20阳性TCL的病例,结合其临床及病理学资料进行分析。病例1:患者男性,39岁,间断腹泻伴消瘦2年。胃肠镜示:小肠及结直肠黏膜广泛充血水肿,多发平坦糜烂及结节样隆起;CT示:颈部、纵隔、腹腔及腹膜后多发淋巴结肿大。取回肠、结肠、直肠及腹腔淋巴结行活组织病理学检查。病例2:患者男性,82岁。躯干、腹股沟起红斑,斑块时间不详(图2A)伴面颈部肿块形成(图2B)6月余,患处脱屑及瘙痒不明显,肿块质软、与周围组织无明显粘连,发病部位行皮肤活检。
1.2 方法
送检标本均经甲醛固定,常规脱水、透明,石蜡包埋,4 µm厚切片、常规HE染色,光学显微镜下观察,并由两位亚专科高级职称医师复阅切片再次明确病理学诊断。在自动免疫组化平台(Benchmark XT;Ventana Medical Systems,Tucson, AZ)上进行免疫组织化学染色,所选抗体包括CD3、CD4、CD5,CD7、CD8、CD19、CD20、CD21、PAX-5、CD79α及Ki-67。抗体购自福建迈新生物技术有限公司。CD20经厦门通灵生物医药科技有限公司(克隆号SD386)重复染色。两例患者均行TCR重排检测,病例1另行EBER原位杂交检测,EBER探针购自罗氏公司。利用在线生信分析软件(https:∕∕www.aclbi.com∕static∕index.html#∕)对GEO数据库中GSE 19069及GSE 132550数据集进行分析[3]。通过DNAMAN基因组学软件(https:∕∕www.lynnon.com∕)分析MS4A1和SIGELC15基因序列相似性、限制性内切酶位点及个数。
2 结果
2.1 病例1
病理组织学形态:肠黏膜活检示黏膜内固有腺体减少,代之以大量淋巴样肿瘤细胞浸润。主要为小淋巴细胞,细胞核形不规则,胞浆稀少,小淋巴细胞在隐窝之间分布或推挤周围隐窝生长,核分裂象少见,无坏死及明显核仁,未见淋巴上皮病变(图1A);腹腔淋巴结活检示淋巴结正常结构消失,代之以弥漫分布的小淋巴细胞,核形状不规则,胞浆稀少,核分裂象少见(图1D),形态及免疫表型与肠腔黏膜相同。免疫组织化学:CD3、CD7、CD8阳性,CD20弥漫弱阳性,CD4、CD5、CD56、PAX-5、CD79α阴性,Ki-67增殖指数约20%(图1B,1C;1E,1F)。进一步行EBER原位杂交检测呈阴性,TCR重排为单克隆性。
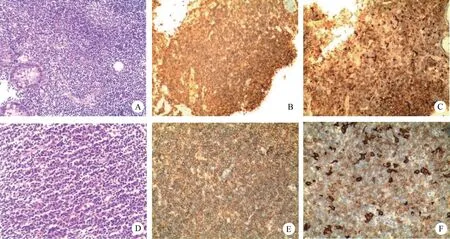
图1 病例1病理组织形态
2.2 病例2
病理组织形态:皮肤组织,表皮未见明显异常,真皮及皮下见弥漫性或结节状围绕毛囊生长的增生的淋巴组织,毛囊周围瘤组织成团浸润,破坏毛囊上皮。淋巴样瘤细胞体积稍增大、较一致,核型多不规则、脑回状,胞浆淡染,核分裂象可见(图2)。免疫组织化学:CD3、CD4、CD20阳性,CD7、CD8、PAX-5、CD79α阴性,Ki-67增殖指数约20%。进一步行TCR重排为单克隆性。
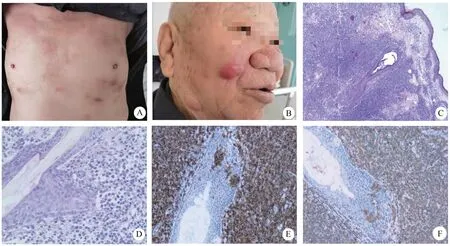
图2 病例2大体形态及病理组织形态
2.3 机制分析
通过生信分析GSE 19069及GSE 132550数据集,得知调控CD20表达的MS4A1在TCL内处于高表达状态(图3A,3D),并且免疫调控点基因(CD274、CTLA4、HAVCR2、LAG3、PDCD1、PDCD1LG2、SIGLEC15)在TCL内也具有统计学意义的表达差异(图3B,3E)。进一步分析MS4A1与免疫调控点基因间表达相关性,发现外周TCL中MS4A1与SIGLEC15基因有统计学正相关性(图3C,3F)。DNAMAN基因组学软件分析结果提示,MS4A1与SIGLEC15基因的基因序列存在45.52%的相似性,同时,67个限制性内切酶,在两者基因上均发挥识别、水解作用,分别产生318个剪切位点及455个剪切位点(图3G),提示两组DNA在复制过程中,可能出现相同序列处的水解断裂,该处位点序列具有高度的同源相似性。综上,推测潜在的发生机制是:在TCL DNA复制过程中,MS4A1和SIGLEC15可能通过相同序列处水解断裂方式,产生易位融合可能,进而介导MS4A1和SIGLEC15基因转录、翻译产物高表达。最终,导致TCL内出现CD20阳性表达的T淋巴细胞(图3H)。
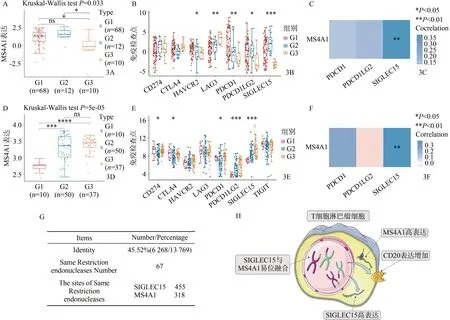
图3 CD20阳性表达TCL潜在机制分析
3 结论
病例1最终诊断为CD20阳性的胃肠道惰性T细胞淋巴组织增殖性疾病并累及淋巴结;病例2最终诊断为皮肤CD20阳性的亲毛囊性蕈样肉芽肿(肿瘤期)。生物信息学及基因组学分析结果,提示TCL中CD20阳性T淋巴细胞的潜在发生机制为MS4A1与SIGLEC15基因的易位融合。
4 讨论
检索文献并结合本组2例在内共90例CD20阳性TCL患者分析发现,患者多为中老年男性(男女比例约3∶1),发病部位以淋巴结最常见,其次为胃肠道及皮肤组织[4]。具体类型以非特指型外周T细胞淋巴瘤和皮肤蕈样肉芽肿为主,单形性嗜上皮性肠道T细胞淋巴瘤、结外鼻型NK∕T细胞淋巴瘤等也皆有报道[5]。镜下病理学形态与相应类型T细胞淋巴瘤并无明显差异,主要与B细胞淋巴瘤鉴别,鉴别点包括1、HE染色:T细胞淋巴瘤中瘤细胞多为弥漫、大小不一的淋巴样细胞,细胞核不规则,呈马蹄型或肾型等不规则形态,可见毛细血管后微静脉或高内皮小静脉增生,有时可见肉芽肿样结构;B细胞淋巴瘤则多为弥漫且一致性的淋巴样细胞,细胞核相对较规则,圆形或椭圆形,毛细血管后微静脉或高内皮小静脉增生不明显。2、免疫组化:T细胞淋巴瘤多表达CD2、CD3、CD7、CD8等T细胞标志物,而B细胞淋巴瘤除CD20外,还表达PAX5、CD79a等多种B细胞标志物。本组两例CD20阳性的TCL患者1例发生于肠道,1例发生于皮肤,临床均呈惰性病程且随访至今病情平稳。此临床经过提示这两类TCL的预后与CD20是否阳性表达无明显相关性,应与其病理学类型、临床分期等相关。
病例1为CD20阳性的胃肠道惰性T细胞淋巴组织增殖性疾病并累及淋巴结。胃肠道惰性T细胞淋巴组织增殖性疾病是近年从胃肠道T细胞淋巴瘤中独立出来的一种克隆性T细胞增殖性疾病[3],目前包含本例在内国内报道共12例,其中伴有CD20异常表达的除本例外仅1例报道[4,6-7]。镜下形态主要表现为黏膜固有层内大量淋巴样肿瘤细胞浸润,以小淋巴细胞为主,细胞核形不规则,胞浆稀少,小淋巴细胞在隐窝之间分布或推挤周围隐窝生长,核分裂象少见,无坏死及明显核仁,无淋巴上皮病变。免疫组化通常示瘤细胞弥漫表达CD3,CD4或CD8阳性,Ki-67增殖指数低,CD2、CD5或CD7可丢失。EBER原位杂交阴性,TCR克隆性重排阳性。鉴别诊断:① 炎症性肠病:临床表现与本病相似,HE镜下形态可见黏膜固有层内包含淋巴细胞、浆细胞、中性粒细胞及嗜酸性粒细胞等在内混杂炎细胞浸润,伴有隐窝脓肿或非干酪性肉芽肿,TCR重排阴性;② 肠病相关性T细胞淋巴瘤:临床常见乳糜泻,HE镜下形态示瘤细胞中等大小、弥漫分布,细胞异形性明显且伴淋巴上皮病变;免疫组化常表达CD3、CD8及细胞毒颗粒,Ki-67增殖指数常>50%;③ 胃肠道惰性NK细胞-淋巴细胞增殖性疾病:属于自限性胃肠道淋巴细胞增殖性疾病。HE镜下形态示瘤细胞在黏膜固有层中弥漫分布,细胞中等偏大且伴有异型性,免疫组化表达CD3、CD7、CD56及细胞毒颗粒,CD5、CD4、CD8阴性。本研究中患者以慢性腹泻就诊,临床及病理学形态缺乏典型特征,经上级医院协诊后回我院进行对症治疗,目前定期复查至今未见明显病情进展。
病例2为皮肤CD20阳性的FMF(肿瘤期)。本例患者临床及病理学形态相对典型,2013年Hagen等[8]曾报道过一例80岁女性肿瘤期MF患者,面部及胸背部红斑皮疹同时伴有颈部及右耳后结节,临床表现与本组病例较为相似;同时该团队研究发现在CD20阳性的6例MF病例中,3例与更具侵袭性的临床过程相关。但截至目前作者在国内外检索到的20例CD20阳性MF患者中,尚未见有关CD20阳性FMF的报道。本研究中该病例镜下见真皮及皮下弥漫性或结节状围绕毛囊生长的增生性淋巴样肿瘤细胞,毛囊周围瘤组织成团浸润,破坏毛囊上皮。淋巴样瘤细胞体积稍增大、较一致,核型多不规则、脑回状,胞浆淡染,核分裂象可见。免疫组化肿瘤细胞CD3、CD4、CD20阳性,CD7、CD8阴性,Ki-67增殖指数低。该病鉴别诊断:① 经典MF:FMF需与经典型肿瘤期MF累及毛囊相鉴别。经典型MF好发于皮肤非曝光部位,此前一般都曾经历红斑期和斑块期。而FMF临床表现无红斑期、斑块期及肿瘤期之分,患者可仅表现为毛囊性丘疹、斑片或浸润性斑块等,且MF常伴有明显的亲表皮现象;② 毛囊黏蛋白病:多见于青年人,病理学特征为外根鞘和皮脂腺粘蛋白变性,伴不同程度的毛囊及血管周围炎细胞浸润,阿申蓝染色阳性;③ 毛发扁平苔藓:女性更常见,平均发病年龄51岁。该病与FMF的临床表现有一定的重叠。镜下形态学炎细胞浸润主要局限于毛囊漏斗部和峡部,表现为苔藓样组织反应伴毛囊上皮中凋亡小体形成,不见异形淋巴细胞。本例患者临床及病理学形态均可与以上疾病鉴别,目前给予肌注干扰素治疗中,病情平稳。
CD20阳性TCL病因及发病机制尚不清楚。作者通过检索文献将已提出的可能的机制简要总结如下:一、血液中存在B、T及NK细胞分化潜能的祖细胞,CD20阳性T淋巴细胞或许是祖细胞分化阶段恶性转化的结局[9];二、T细胞在特定刺激下能短暂表达CD20,提示CD20阳性的T淋巴细胞可能是T细胞增殖活化的标志,这一过程可能存在于TCL的发病过程中;三、外周血中存在双表达CD3及CD20的T淋巴细胞[10],之所以将其归属于T淋巴细胞是因为它们表达CD3蛋白的水平与常规T细胞相似,而缺乏其他经典B细胞标志物,且CD20表达均呈弱阳性。此结论与本组病例1患者CD3强阳、CD20弥漫弱阳性结果相一致。
通过生物信息学及基因组学的分析,其结果支持上述三种机制中TCL内存在高表达CD20的可能,同时,通过研究及分析还提出新的潜在发生机制,即MS4A1与SIGLEC15易位融合。前期的大量研究[11-12]证实染色体易位可导致原癌基因的激活促进肿瘤发生,也可使相邻的基因融合并表达相关产物,影响细胞增殖与凋亡,在淋巴瘤的发生、发展过程中起重要作用,如套细胞淋巴瘤(MCL)中常见的t(11,14)∕IGH-CCND1[13]、滤泡性淋巴瘤(FL)中的t(14,18)∕IGH-BCL2[14]、黏膜相关淋巴组织淋巴瘤(MALT)淋巴瘤中的t(11,18)∕BIRC3-MALT1及t(1,14)∕LGH-BCL10[15]。其中,黏膜相关淋巴组织淋巴瘤(MALT)淋巴瘤中的t(11,18)∕BIRC3-MALT1的易位融合发生于11号和18号染色体上。而MS4A1基因与SIGLEC15基因也分属于11号和18号染色体,并且与MALT1和BIRC3位置邻近。因此,有理由相信TCL内也可能出现类似MALT淋巴瘤的特殊基因易位融合改变,进而导致TCL中出现CD20阳性表达的T淋巴细胞。
CD20阳性的TCL易被误诊为BCL,而BCL异常表达T细胞标志物的病例也时有报道[16],因此病理科医师在充分把握病变的组织病理学特征的同时,应联合多种B、T淋巴细胞免疫标志物,分子检测如Ig和TCR基因重排也可给予些许帮助,CD20阳性的TCL基本不伴有Ig基因单克隆重排伴TCR重排阳性,而近来也有Ig单克隆重排的报道[17]。因此特殊情况下TCR及Ig重排也无法鉴别,甚至成为诊断陷阱。目前,利妥昔单抗在临床上已广泛用于CD20阳性BCL的治疗,不论其单独给药或联合用药,对CD20阳性TCL的疗效报道[18]不一,具体有待进一步探索研究。

