COPD患者肌少症发病情况分析及亮氨酸对肌少症的干预研究
魏丹
(陕西中医药大学附属医院呼吸内科,陕西 咸阳 712000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的呼吸系统慢性病,以肺功能下降、气流受限和气道阻滞为主要临床特征。流行病学调查[1]显示,我国目前COPD患者人数已达到1亿左右,并有不断上升的趋势,带来了极大的经济负担和社会负担。
肌少症是指进行性的包括肌肉质量减少和肌肉强度下降或肌肉生理功能减退,其发生与年龄、吸烟、体重过低和活动减少等因素有关,是一种COPD常见的并发症,发生机制可能与运动量少、氧化应激、缺氧、药物使用等有关。COPD是一种慢性炎症性疾病,一方面,这种炎症反应会加重肌肉蛋白质的分解,另一方面,由于呼吸困难等症状限制了活动量,引起肌肉废用性萎缩,而全身肌肉功能下降累及呼吸肌时,进一步加重呼吸困难等症状[2]。目前针对COPD患者肌少症的研究较少,国外有研究[3]统计,COPD患者中肌少症的发病率约为20%~40%,国内有部分地区的研究[4]显示约为30%~80%不等,可能与不同地区饮食差异、生活习惯有关,也可能与研究使用的不同评估方法、样本量较少等有关。
肌少症会加重患者病情的恶化,已成为增加COPD病死率的独立危险因素[5],因此,及早发现和干预可能是提高COPD患者预后的有效措施。目前,肌少症的干预方法包括抗阻力训练、营养补充剂(如乳清蛋白)等,已在老年患者、肿瘤患者等人群中表现出良好的效果[6]。亮氨酸是一类人体必需的支链氨基酸,可更快地分解转化为葡萄糖,因此,可减轻肌肉蛋白质的分解。目前已证明对少肌症有积极的效果[7],但是在COPD中其效果如何,目前报道极少。本研究旨在观察COPD患者中肌少症的发生率,并探讨强化亮氨酸的营养支持在COPD合并肌少症患者中的应用效果,为此类患者的临床治疗提供参考。
1 资料与方法
1.1 研究对象
选取2018年6月至2021年6月陕西中医药大学附属医院呼吸内科收治的COPD患者共306例。纳入标准:① 年龄18~70岁;② 按照中华医学会呼吸病学分会制定的《慢性阻塞性肺疾病诊治指南(2013修订版)》[8]中COPD的诊断标准:肺功能检查吸入支气管舒张剂后FEV1∕FVC<70%,并除外其他疾病;③ 参考亚洲肌少症工作组2019年发布的肌少症诊断标准[9]:肌肉力量(男<28 kg,女<18 kg)、躯体功能(6 m步行速度<1.0 m∕s或5次起坐时间≥12 s或简易体能测量表≤9)、四肢骨骼肌含量(DXA男<7 kg∕m2,女<5.4 kg∕m2或BIA男<7 kg∕m2,女<5.7 kg∕m2),存在骨骼肌含量减少且肌肉力量下降的患者诊断为肌少症。排除标准:① 肺部恶性肿瘤患者;② 肺纤维化患者;③ 肺结核患者;④ 合并心脏、肝脏、大脑和肾脏等其他脏器严重疾病的患者;⑤ 合并血液系统疾病、自身免疫性疾病的患者;⑥ 合并其他部位感染的患者;⑦ 手部残疾无法测量或下肢残疾无法步行测量的患者;⑧ 语言沟通障碍,不能配合研究的患者。该试验经陕西中医药大学附属医院伦理委员会批准,所有患者均签署知情同意书。
1.2 试验流程
所有经门诊医生确诊的COPD患者,使用肌少症筛查问卷进行初步筛查,再进一步使用肌肉力量(握力)、躯体功能和骨骼肌含量(BIA评估)总体评价是否存在肌少症。确诊为肌少症的COPD患者,随机分为对照组和研究组,在正常进食的基础上,对照组使用整蛋白型全营养素(安素)55 g+水230 mL,口服,每日2次,研究组使用除了增加整蛋白型全营养素(安素)55 g+水230 mL,口服,每日2次外,另外补充亮氨酸5 g,口服,每日2次。在干预前,干预后2周和4周采集检测指标。
1.3 观察评估指标
1.3.1 肌肉量及功能
1.3.1.1 肌肉量 使用基于生物电阻抗技术的体成分分析法(Inbody 720)进行检测。患者须检查当天清晨空腹排空大小便后,进行检测,记录骨骼肌总量。肌肉功能使用肌力进行评定,统一使用电子握力计进行测量,患者站立位,肢体自然下垂,紧握把柄,不接触其他物体或身体其他部位,尽力握电子握力计直到握力显示不变为止,休息5~10 s后再次检测,连续测量3次,以最大值为测量结果。
1.3.1.2 躯体活动功能 使用6 m内步行速度评估。选择平坦场地,量出6 m的距离,做好标记。患者从起点走到终点,记录时间,用秒表示。
1.3.1.3 肌少症筛查问卷评分 肌少症筛查问卷包括5项内容,每项评分0~2分,总分10分。得分越高表明肌少症程度越严重。
1.3.2 肺功能指标
1.3.2.1 呼吸肌力 使用PowerCube肺功能仪(Ganshorn, Germany)检测。患者休息10 min,采取坐位,使用吹嘴,先平静呼吸4次,附上鼻夹。检测患者最大通气量、用力肺活量、第1秒用力呼气容积、最大呼气压和最大吸气压。
1.3.2.2 血氧饱和度 使用指套式血氧仪器进行检测。
1.3.3 营养相关指标 清晨空腹时,抽取静脉血,全自动生化分析仪检测人血白蛋白(ALB)、前白蛋白(PA)、肌酐(SCR),并同时检测C反应蛋白(CRP)水平。
1.3.4 其他指标
1.3.4.1 日常生活自理能力 使用日常生活自理能力评分(ADL评分)表进行评价,用来评价患者的日常生活自理能力,共由14个条目组成,每个条目按照自己独立完成、有些困难、需要帮助和完全依赖他人四个等级分别记为1、2、3和4分,总分为56分,分值越高代表自理能力越差[10]。
1.3.4.2 疾病严重程度 使用COPD生活质量量表进行COPD评估测试(CAT)评分,共分为8个条目,均为COPD患者最常见的生活功能指标,按照程度不同评0~5分,分值越高代表患者的生活质量越差[11]。
1.3.5 不良反应 肠内营养常见的不良反应包括腹胀、腹泻、恶心、呕吐等
1.4 统计学方法
所有数据分析均采用SPSS14.0统计软件进行。计量资料以()表示,样本均数比较用t检验,率的比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 COPD患者少肌症患病情况
将确诊为COPD患者共306例,进行肌肉量和功能的评估后,确诊为少肌症的患者共145名,无少肌症患者共161名。两组患者的一般情况如表1所示。少肌症组和无少肌症组的COPD患者年龄、性别、职业、文化程度、吸烟史和BMI均无明显差异(P>0.05);但运动习惯有显著差异,无少肌症组有运动习惯者明显高于少肌症组(P<0.05);无少肌症组患者其他疾病发生率明显低于少肌症组(P<0.05)。
表1 两组患者一般人口学资料比较()
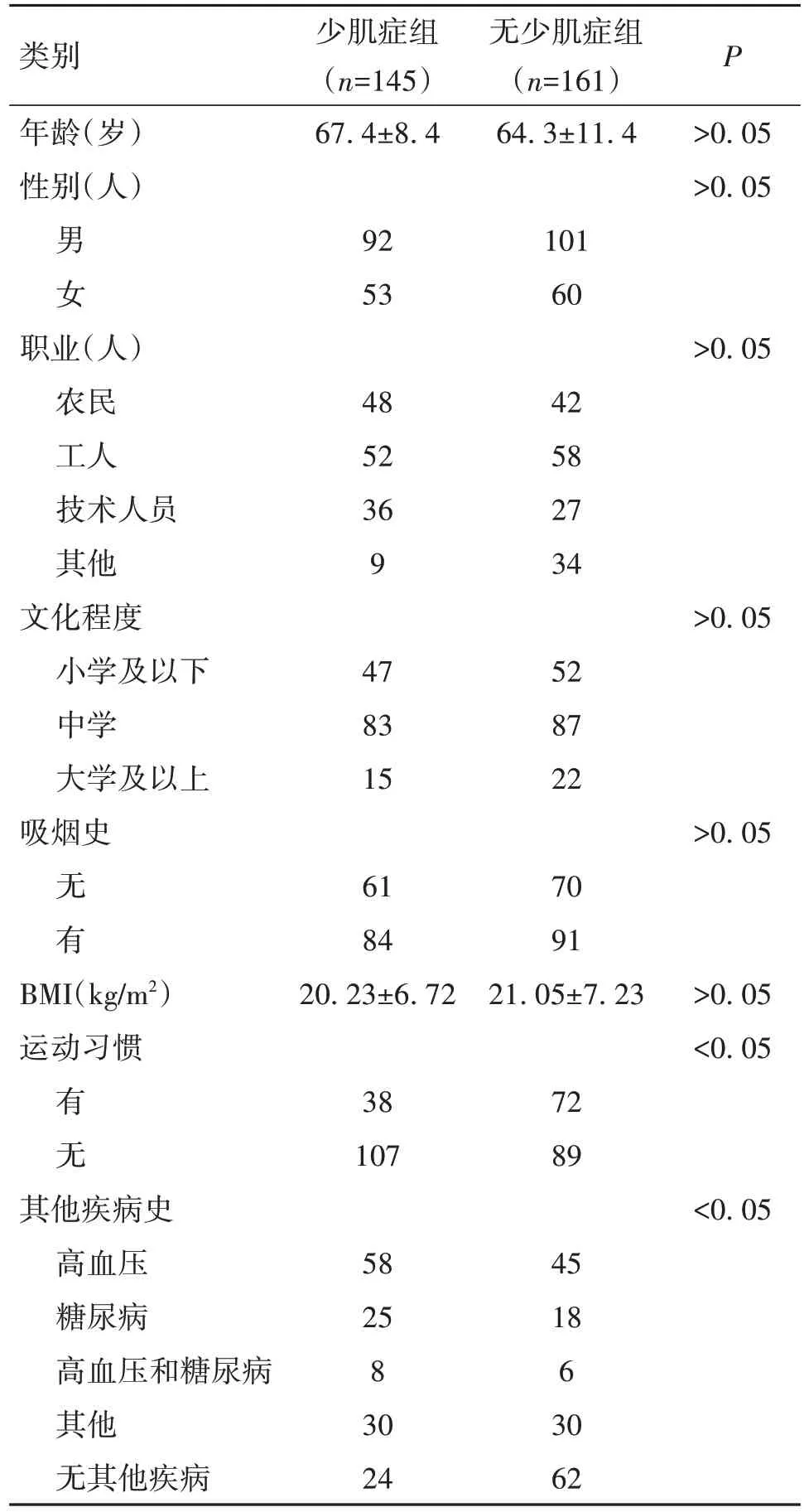
表1 两组患者一般人口学资料比较()
类别年龄(岁)性别(人)少肌症组(n=145)67.4±8.4无少肌症组(n=161)64.3±11.4 P>0.05>0.05男女92 53 101 60职业(人)农民工人技术人员其他文化程度小学及以下中学大学及以上吸烟史>0.05 48 52 36 9 42 58 27 34>0.05 47 83 15 52 87 22>0.05无有BMI(kg∕m2)运动习惯61 84 20.23±6.72 70 91 21.05±7.23>0.05<0.05有无38 107 72 89其他疾病史高血压糖尿病高血压和糖尿病其他无其他疾病<0.05 58 25 8 30 24 45 18 6 30 62
2.2 干预前两组患者的基线资料比较
确诊为少肌症的145名患者中,有124名符合入组条件,随机分为研究组(n=60)和对照组(n=64),14名患者未完成随访,其中8名患者(研究组5人,对照组3人)出现腹胀、腹泻、腹痛、恶心、呕吐等,退出研究,6名患者(研究组2人,对照组4人)失联。共110名患者完成随访,其中研究组53名,对照组57名。两组患者年龄、性别、职业、文化程度、吸烟史、BMI、运动习惯和疾病史差异均无统计学意义(P>0.05,表2)。
表2 COPD伴少肌症患者两组患者干预前一般人口学资料比较()
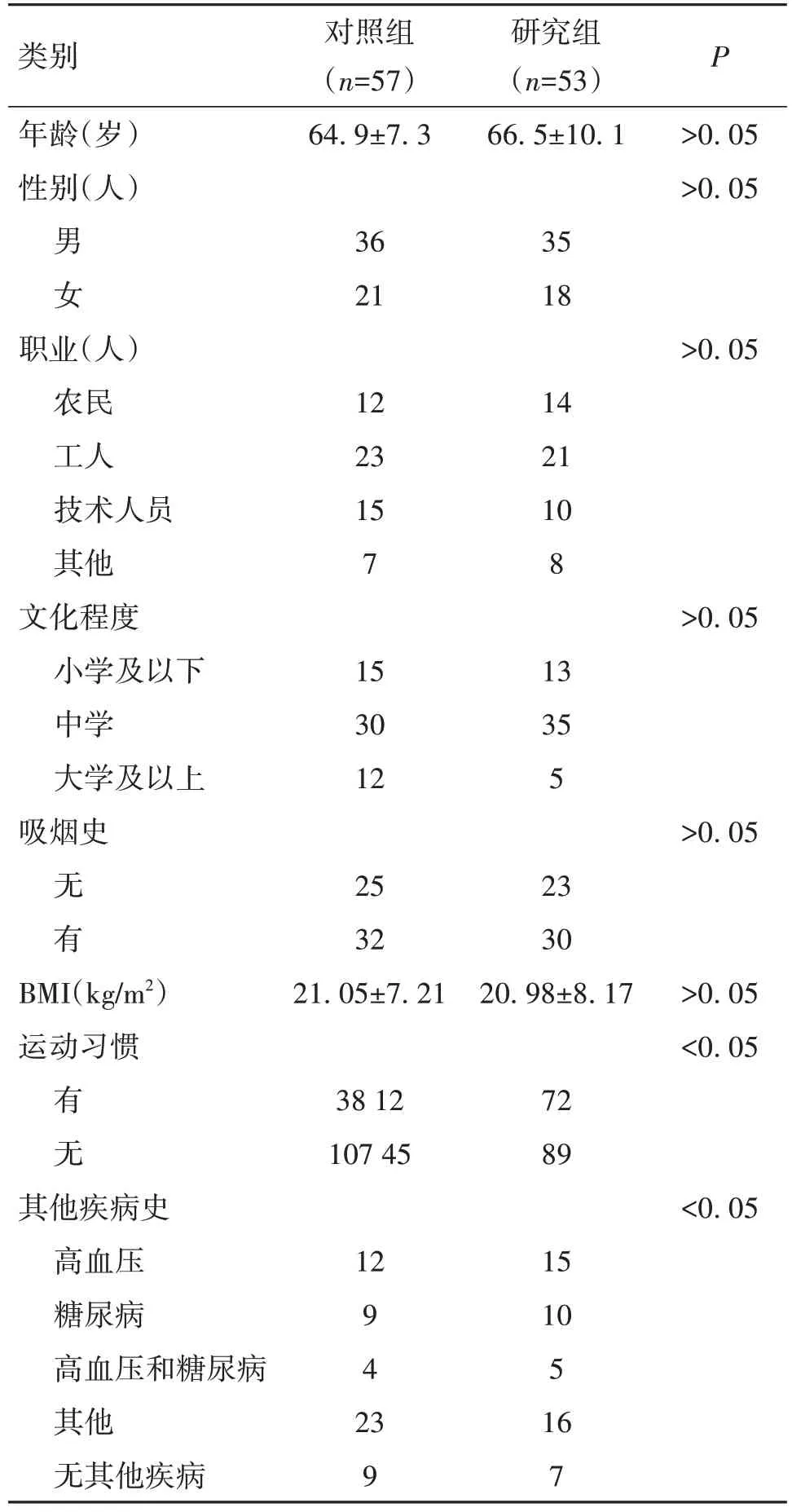
表2 COPD伴少肌症患者两组患者干预前一般人口学资料比较()
类别年龄(岁)性别(人)对照组(n=57)64.9±7.3研究组(n=53)66.5±10.1 P>0.05>0.05男女36 21 35 18职业(人)农民工人技术人员其他文化程度小学及以下中学大学及以上吸烟史>0.05 12 23 15 7 14 21 10 8>0.05 15 30 12 13 35 5>0.05无有BMI(kg∕m2)运动习惯25 32 21.05±7.21 23 30 20.98±8.17>0.05<0.05有无38 12 107 45 72 89其他疾病史高血压糖尿病高血压和糖尿病其他无其他疾病<0.05 12 9 4 2 3 9 15 10 5 16 7
2.3 两组患者肌肉量及功能比较
在干预前、干预后2周及4周后,对照组患者握力值、步速和肌肉量略有升高,肌少症筛查问卷评分略有下降,但差异无统计学意义(P>0.05);研究组患者握力值在干预前与对照组差异无统计学意义,干预2周和4周后高于对照组,但差异无统计学意义;研究组患者步速在干预2周及4周后均明显高于对照组;肌少症筛查问卷评分在干预2周时略低于对照组,差异无统计学意义(P>0.05),但在干预4周后明显低于对照组(P<0.05);肌肉量在干预2周后高于对照组,差异无统计学意义(P>0.05),但在干预4周后明显高于对照组(P<0.05,图1)。
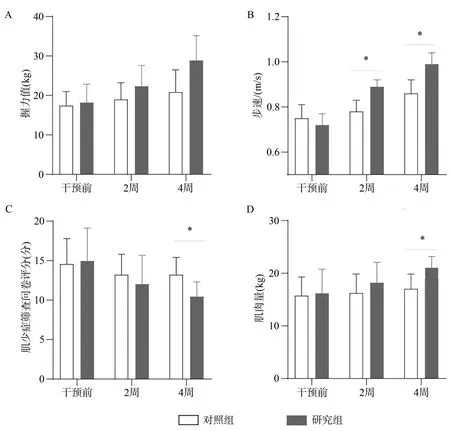
图1 两组患者干预前、干预2周和4周后肌肉量及功能比较
2.4 两组患者肺功能比较
对照组血氧饱和度、最大通气量、用力肺活量、第1秒用力呼气容积、最大呼气压和最大吸气压都有升高趋势,但差异无统计学意义(P>0.05);干预后4周,研究组血氧饱和度和最大呼气压均高于对照组,但差异无统计学意义(P>0.05);研究组最大通气量、用力肺活量、第1秒用力呼气容积和最大吸气压均明显高于对照组,差异有统计学意义(P<0.05,图2)。
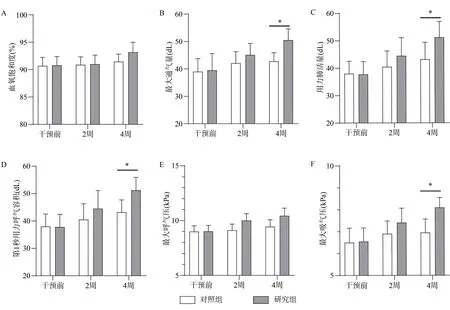
图2 两组患者干预前、干预2周和4周后肺功能比较
2.5 两组患者营养状况及生活质量比较
两组患者在干预后血红蛋白和上臂肌围水平均略有升高,但差异无统计学意义(P>0.05);两组患者在干预后4周白蛋白和前白蛋白水平与干预前相比,均明显升高,差异有统计学意义(P<0.05),但两组间差异无统计学意义(P>0.05);对照组的日常生活自理能力和生活质量评分在干预后略有降低,差异无统计学意义(P>0.05),但研究组评分在干预4周后明显下降,差异有统计学意义(P<0.05,图3)。

图3 两组患者干预前、干预2周和4周后营养状况及生活质量比较
2.6 不良反应发生率比较
两组患者肠内营养不良反应发生率分别为28.07%和24.53%,差异无统计学意义(P>0.05,表3)。
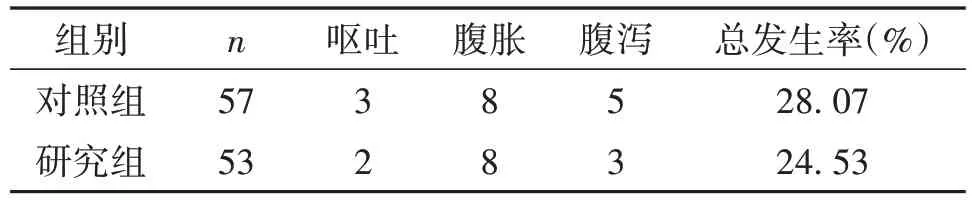
表3 两组患者不良反应发生率比较
3 讨论
COPD患者由于活动减少、氧化应激等原因引起肌少症发生率增加[12],近年来,国外研究[13]报道,COPD少肌症的核心病理生理机制是骨骼肌合成代谢的减少和分解代谢的增加,其相关的影响因素包括缺乏运动、疾病消耗、营养摄入失衡等,而肌少症的发生进一步加重患者呼吸困难等症状,造成病情恶化,并降低患者生活质量。早期筛查患者的肌少症并进行干预,可有效地避免肌少症对疾病的影响。目前关于治疗肌少症,多认为可通过增加蛋白质摄入、增加抗阻力运动等方法进行干预[14],本研究发现强化亮氨酸的肠内营养补充可改善COPD患者的肌少症情况,同时缓解患者的肺功能下降,并能提高患者的生活质量。
本中心中纳入的COPD患者中,经筛查发现肌少症发生率约为47.4%,略高于国外的发生率,这可能与中心患者多来源于我国西北地区,饮食模式、生活习惯等均会引起患者骨骼肌质量的差异。同时,本研究发现,少肌症组患者中具有运动习惯的患者比例低,这可能是引起肌肉质量减少的原因之一。同时,患者合并的其他疾病比例高。
目前针对COPD患者合并少肌症尚无十分有效的治疗药物,合理的营养和生活方式干预成为治疗此疾病的首选。既往有研究[6]关注每日补充乳清蛋白20 g能够有效增强患者呼吸肌力,改善患者肺功能和营养状况。乳清蛋白是一种富含必需氨基酸的营养补充剂,可提供用于合成肌肉的底物,用于减少肌肉损失。亮氨酸是乳清蛋白中所含的一种必需的支链氨基酸,是乳清蛋白发挥作用的有效成分之一。与乳清蛋白相比,单纯亮氨酸补充提供的氮含量相对较低,不会增加患者的肾脏负担。本研究也证实了单纯亮氨酸补充可纠正COPD患者的肌力下降,具有一定的临床价值。
亮氨酸促进肌肉蛋白合成可能通过以下机制实现。首先,作为一种必需的氨基酸,可提供用于合成肌肉蛋白质的底物;其次,亮氨酸是一类支链氨基酸,能够更快地分解转化为葡萄糖,防止肌肉的分解。此外,亮氨酸可激活雷帕霉素靶蛋白(mTOR)通路,促进肌肉蛋白质合成[15]。在本研究中,给予每日10 g亮氨酸,可明显提高患者骨骼肌功能,如提高步速、握力值、肺功能等,也证实了这点。此外,本研究结果还显示,给予亮氨酸补充后,可改善患者的营养状况,包括提高白蛋白、前白蛋白水平,并且还可以提高患者的生活自理能力和生活质量,这些结果均证明了干预措施的效果。
本研究的不足之处有以下几点。首先,本研究未设立使用肠内营养强化乳清蛋白的对照组,无法比较单纯亮氨酸补充与乳清蛋白的效果,因此,无法判断是由于亮氨酸提供了合成肌肉的底物或者是亮氨酸特殊的功效引起了上述治疗效果;其次,本研究中经验性地使用了10 g亮氨酸进行补充,在干预后的4周看到了明显的疗效,本剂量是否需要调整尚需进一步的研究证实;最后,本研究观察的时间为4周,且为单中心研究,干预措施的远期疗效仍不清楚,研究结论可能存在一定的偏倚。
综上所述,肠内营养结合亮氨酸强化的治疗措施有助于改善COPD合并肌少症患者肌肉功能和肺功能,提高生活自理能力和生活质量。但对其用量、远期疗效和作用机制仍需要更大样本的多中心临床研究和更深层次的基础研究进一步阐释。

