Nanog、Sox 2、TFF 3在肠型胃癌中的表达及其与肠型胃癌预后关系的研究△
张咏梅,范丽昕,蔡永清,朴正爱,王海,周易,董华承,李萍
大连市第三人民医院肿瘤科,辽宁 大连1160300
胃癌作为常见的恶性肿瘤,在世界范围内的发病率不尽相同,中国是胃癌高发地区之一。中国每年新发恶性肿瘤中,胃癌排名第2位,在消化道肿瘤中排名第1位。Lauren分型于1965年由Lau‐ren提出,2009年TOGA研究奠定了晚期胃癌的新型靶向治疗,在此研究中发现Lauren分型与人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的表达有明显的相关性,从而使Lauren分型再次受到临床医师的高度重视。Lau‐ren分型中肠型胃癌占大部分,但由于胃癌具有非常明显的异质性,Lauren分型无法区分不同生物学行为的肠型胃癌,减弱了其对预后的指导作用。因此,寻找肠型胃癌的预后生物标志物一直是肿瘤学研究的热点。而联合检测多个生物标志物能更准确地判断预后,有利于更好地评估肠型胃癌的生物学行为,对临床治疗方案的选择具有重要意义。
肠型胃癌的发生是循序渐进的,被认为是由一系列癌前病变发展而来的,即Correa[1]提出的慢性浅表性胃炎→慢性萎缩性胃炎→肠化生→不典型增生→黏膜内癌→侵袭性癌的转化过程。Nanog、Sox2参与了肠上皮化生向肠型胃癌发生发展的过程。三叶因子3(trefoil factor 3,TFF3)在Correa级联反应的各个阶段表现不同。本研究通过检测肠型胃癌患者术后Nanog、Sox2、TFF3的表达情况,评价其表达情况与肠型胃癌患者临床病理特征及预后的关系,现报道如下。
1 资料与方法
1.1 一般资料
收集2009年1月至2010年12月于大连市第三人民医院经手术切除的肠型胃癌标本60例。60例肠型胃癌患者的年龄为39~86岁,平均(63.13±9.43)岁;男43例,女17例。所有患者术前均未行放化疗,TNM分期采用2010年美国癌症联合委员会(American Joint Committee on Cancer,AJCC)分期标准。病灶位于贲门13例,位于胃体窦部47例;侵犯深度T1期8例,T2期9例,T3期26例,T4期17例;淋巴结转移N0期14例,N1~3期46例;TNM分期Ⅰ期11例,Ⅱ期18例,Ⅲ期26例,Ⅳ期5例。所有患者均进行电话随访或门诊随访。总生存期为患者确诊时至死亡或末次随访时间,无病生存期为患者确诊时至疾病进展或末次随访时间。末次随访时间为2015年12月30日。
1.2 标本处理
所有标本均应用10%中性福尔马林固定,并进行常规脱水,石蜡包埋及切片,片厚4~5 μm。
1.3 试剂和方法
兔抗人Nanog单克隆抗体、兔抗人Sox2单克隆抗体、鼠抗人TFF3单克隆抗体均购自Abcam公司;一抗试剂稀释浓度:Nanog 1/100,Sox2 1/100,TFF3 1/100。一抗试剂盒、二抗试剂盒、DAB显色试剂盒均购自福建迈新生物技术有限公司。用磷酸盐缓冲液(0.01 mol/L,pH值为7.4)代替一抗作为阴性对照,用已知阳性片作为阳性对照。免疫组化染色采用SP法,染色步骤按说明书进行。
1.4 免疫组化染色判定方法
细胞质和(或)细胞核内出现淡黄色至棕黄色颗粒为阳性。每张切片随机观察5个高倍视野(400倍)。细胞染色强度评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞所占百分比评分:阳性细胞所占百分比<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。采用半定量积分法判定结果,即将染色强度与阳性细胞所占百分比计分的乘积定为每1例染色的综合评分,0~2分为(-),3~5分为(+),6~9分为(++),10~12分为(+++)。评分≤2分为低表达,评分>2分为高表达。
1.5 统计学方法
采用SPSS 17.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验,计数资料以率(%)表示,组间比较采用χ2检验。采用Kaplan‐Meier法进行生存曲线分析,组间比较采用Log‐rank检验。采用Cox比例风险回归模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 Nanog、Sox 2、TFF 3在肠型胃癌中的表达
60例肠型胃癌患者的Nanog、Sox2主要表达于细胞核内,TFF3主要表达于细胞质内。Nanog高表达者 38例(63.3%),TFF3高表达者 33例(55.0%),Sox2低表达者35例(58.3%)。(图1)

图1 肠型胃癌患者的Nanog、Sox 2、TFF 3免疫组化图片(SP染色,×400)
2.2 Nanog、Sox 2、TFF 3的表达情况与肠型胃癌患者临床病理特征的关系
单因素分析结果显示,Nanog、TFF3、Sox2的表达情况与肠型胃癌患者的肿瘤浸润深度、淋巴结转移情况及TNM分期有关(P<0.05),与肠型胃癌患者的年龄、性别、肿瘤部位无关(P>0.05)。(表1)
2.3 Nanog、Sox 2、TFF 3的表达情况与肠型胃癌患者无病生存期和总生存期的关系
Nanog低表达肠型胃癌患者的无病生存期和总生存期长于Nanog高表达的患者,差异有统计学意义(P<0.05)。Sox2高表达肠型胃癌患者的无病生存期和总生存期长于Sox2低表达的患者,差异有统计学意义(P<0.05)。TFF3低表达肠型胃癌患者的无病生存期和总生存期长于TFF3高表达的患者,差异有统计学意义(P<0.05)。(图2、图3)。
2.4 Nanog、Sox 2、TFF 3联合表达与肠型胃癌患者无病生存期和总生存期的关系
多因素分析结果显示,同时具有Nanog低表达、TFF3低表达、Sox2高表达的肠型胃癌患者预后最佳,同时具有Nanog高表达、TFF3高表达、Sox2低表达的肠型胃癌患者预后最差。(表2、表3)
3 讨论
随着精准医学概念的提出,如何将遗传学信息用于指导诊断或治疗备受关注。由于胃癌具有非常明显的异质性,相同临床分期的肠型胃癌存在明显不同的预后状态,使得根据临床分期进行治疗存在很多不足。因此寻找与患者预后生存相关的分子标志物,对肠型胃癌更细致的分型、预后判断、随访以及潜在改变肠型胃癌患者的治疗方式并提出个体化的诊疗具有重要意义。

表1 Nanog、Sox 2、TFF 3的表达情况与肠型胃癌患者临床病理特征的关系
3.1 Nanog在肠型胃癌组织中的表达
Nanog为ANTP类NK家族基因,定位于人染色体12p13区,作为胚胎干细胞维持其多潜能性的关键转录因子,在乳腺癌、精原细胞瘤、肠癌、宫颈癌等多种肿瘤中高表达,且与这些肿瘤的发生、发展及预后密切相关[2‐5]。本研究结果显示,Nanog的表达情况与肠型胃癌患者的肿瘤浸润深度、淋巴结转移情况及TNM分期有关(P<0.05),肿瘤浸润深度越深、有淋巴结转移、TNM分期越晚,Nanog表达水平越高。而肿瘤浸润深度深、淋巴结发生转移、TNM分期晚皆为肿瘤的恶性表型,提示Nanog可能在肠型胃癌的增殖、侵袭、转移中发挥一定的作用。说明Nanog可以作为判断肠型胃癌预后的指标。
3.2 TFF 3在肠型胃癌组织中的表达
TFF3属于三叶因子家族,是由胃肠道黏液分泌上皮合成和分泌的一组具有特定三叶结构的小分子多肽,主要功能是维持胃肠道黏膜的完整性和促进上皮修复,此外还具有调节细胞信号传导和细胞凋亡、促进肿瘤侵袭的功能[6]。本研究结果显示,在肠型胃癌组织标本中,TFF3的表达情况与肠型胃癌患者的浸润深度、淋巴结转移、TNM分期有关(P<0.05),而与患者的年龄、性别、肿瘤部位无关(P>0.05)。TFF3高表达肠型胃癌患者的无病生存期和总生存期短于TFF3低表达的患者,差异有统计学意义(P<0.05)。表明TFF3可以作为预测肠型胃癌预后的生物标志物。
3.3 Sox 2在肠型胃癌组织中的表达

图2 Nanog、Sox 2、TFF 3高表达与低表达肠型胃癌患者的无病生存曲线

图3 Nanog、Sox 2、TFF 3高表达与低表达肠型胃癌患者的生存曲线
Sox2是Sox家族成员之一,位于3号染色体q26.3‐q27[7]。通过HMG结构域识别靶基因,特异性结合DNA序列,广泛参与调控胚胎发育,尤其是在维持胚胎干细胞的自我更新能力和多能性上具有重要作用。它可能通过ⅠL‐4/STAR6信号通路维持胃细胞分化的方向,使细胞分化成肠化生细胞。本研究结果表明,在肠型胃癌中,肿瘤恶性程度越高,Sox2表达水平越低;Sox2高表达患者的无病生存期和总生存期长于Sox2低表达患者,差异有统计学意义(P<0.05)。其机制可能是Sox2可抑制胎盘特异蛋白1的表达,使细胞的运动能力、迁移能力和侵袭能力降低,细胞周期阻滞在G1~S期,降低细胞的增殖能力,在胃癌中起到一定的抑制肿瘤生长的作用。推测Sox2蛋白表达下降或缺失时,胃癌细胞的增殖、浸润和转移能力增强,可促进胃癌细胞的扩散和转移[8]。

表2 肠型胃癌患者Nanog、Sox 2、TFF 3联合表达的无病生存期分析
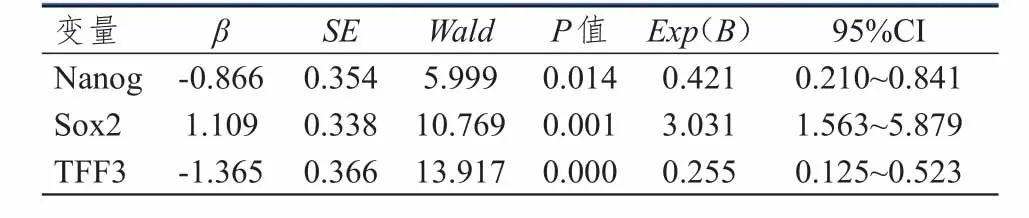
表3 肠型胃癌患者Nanog、Sox 2、TFF 3联合表达的总生存期分析
3.4 肠型胃癌组织中Nanog、Sox 2、TFF 3的表达与预后的关系
肠型胃癌与癌前病变有关,Nanog、Sox2、TFF3参与了肠上皮化生向肠型胃癌发生发展的过程。本研究进一步分析Nanog、Sox2、TFF3联合表达与肠型胃癌的关系。结果显示,同时具有Nanog低表达、TFF3低表达、Sox2高表达的肠型胃癌患者预后最佳,同时具有Nanog高表达、TFF3高表达、Sox2低表达的肠型胃癌患者预后最差。提示联合检测Nanog、Sox2、TFF3在肠型胃癌中的表达较单一指标更能够准确地判断预后,有利于更好地评估肠型胃癌的生物学行为。
综上所述,Nanog、Sox2、TFF3可以作为肠型胃癌患者独立的预后生物标志物,联合检测更利于判断肠型胃癌患者预后,可以更好地为肠型胃癌的预后评估及临床治疗提供依据。
[1]Correa P.A human model of gastric carcinogenesis[J].Can‐cer Res,1988,48(13):3554‐3560.
[2]Ezeh UⅠ,Turek PJ,Reijo RA,et al.Human embryonic stem cell genes OCT4,NANOG,STELLAR,and GDF3 are ex‐pressed in both seminoma and breast carcinoma[J].Cancer,2005,104(10):2255‐2265.
[3]Meng HM,Zheng P,Wang XY,et al.Overexpression of Nanog predicts tumor progression and poor prognosis in colorectal cancer[J].Cancer Biol Ther,2010,9(4):295‐302.
[4]Ye F,Zhou C,Cheng Q,et al.Stem‐cell‐abundant proteins Nanog,Nucleostemin and Musashi1 are highly expressed in malignant cervical epithelial cells[J].BMC Cancer,2008,8:108‐112.
[5]Chiou SH,Yu CC,Huang GY,et al.Positive correlations of Oct‐4 and Nanog in oral cancer stem‐like cells and high‐grade oral squamous cell carcinoma[J].Clin Cancer Res,2008,14(13):4085‐4095.
[6]Babyatsky M,Lin J,Yio X,et al.Trefoil factor‐3 expres‐sion in human colon cancer liver metastasis[J].Clin Exp Metastasis,2009,26(2):143‐151.
[7]Maier S,Wilbertz T,Braun M,et al.SOX2 amplification is a common event in squamous cell carcinomas of different organ sites[J].Hum Pathol,2011,42(8):1078‐1088.
[8]Otsubo T,Akiyama Y,Hashimoto Y,et al.MicroRNA‐126 inhibits SOX2 expression and contributes to gastric carcino‐genesis[J].PLoS One,2011,6(1):e16617.

