艾米替诺福韦治疗乙肝病毒相关肝硬化患者的早期疗效及安全性研究
吕雪艳,陈如悦,潘亚杰,华静,黄硕,李为哲,曾庆磊*
(1. 郑州大学第一附属医院感染病科,河南 郑州 450052; 2. 河南大学第一附属医院消化科,河南 开封 475000)
慢性乙肝病毒(hepatitis B virus, HBV)感染是全球性公共健康危害[1],可导致慢性乙型病毒性肝炎(chronic hepatitis B, CHB)、肝纤维化、肝硬化及肝细胞癌(hepatocellular carcinoma, HCC)的发生发展。抗病毒治疗是改善肝功能、延缓疾病进展、降低HBV相关病死率的关键。有数据[2]表明,未经抗病毒治疗的代偿期乙肝病毒相关肝硬化患者5年内失代偿发生率可达15%~20%,而失代偿期肝硬化5年生存率仅为14%~35%。因此,国际上多部指南和共识,包括《慢性乙型肝炎防治指南(2022年版)》(以下简称“指南”)均建议强化对肝硬化患者的抗病毒治疗[3-4]。
目前,推荐用于代偿期乙肝病毒相关肝硬化的一线抗病毒药主要有恩替卡韦(entecavir, ETV)、富马酸替诺福韦二吡呋酯 (tenofovir disoproxil fumarate, TDF)、富马酸丙酚替诺福韦(tenofovir alafenamide fumarate, TAF)[4]。艾米替诺福韦(tenofovir amibufenamide, TMF)作为我国首个抗HBV原研药,通过在TAF的酰胺化基团上增加一个甲基,提高了TMF的脂溶性[5],这也就意味着TMF拥有TAF肝细胞高靶向性的同时,还更易在肝细胞中释放出游离的替诺福韦而发挥作用。近来,TMF凭借其良好的抗病毒疗效及骨肾安全性纳入指南,被推荐为CHB患者一线抗病毒治疗药物之一[4]。但目前尚未推荐用于乙肝病毒相关肝硬化患者,且缺乏其真实世界条件下治疗代偿期乙肝病毒相关肝硬化患者的疗效及安全性的临床研究数据。因此,本研究旨在探讨TMF在真实世界中治疗代偿期乙肝病毒相关肝硬化患者的早期疗效及安全性,并与TAF进行比较,为后续代偿期乙肝病毒相关肝硬化患者抗病毒治疗药物的选择提供参考依据。
1 资料与方法
1.1 一般资料
纳入2021年4月至2022年9月就诊于郑州大学第一附属医院感染病科的初次接受TMF和TAF抗病毒治疗的代偿期乙肝病毒相关肝硬化患者,共计54例,根据其抗病毒治疗方案,分为TMF组和TAF组,TMF组30例,TAF组24例。两组患者的一般资料差异无统计学意义(P值均>0.05,表1)。
表1 TMF组和TAF组代偿期乙肝病毒相关肝硬化患者的基线资料[M(P25,P75),]
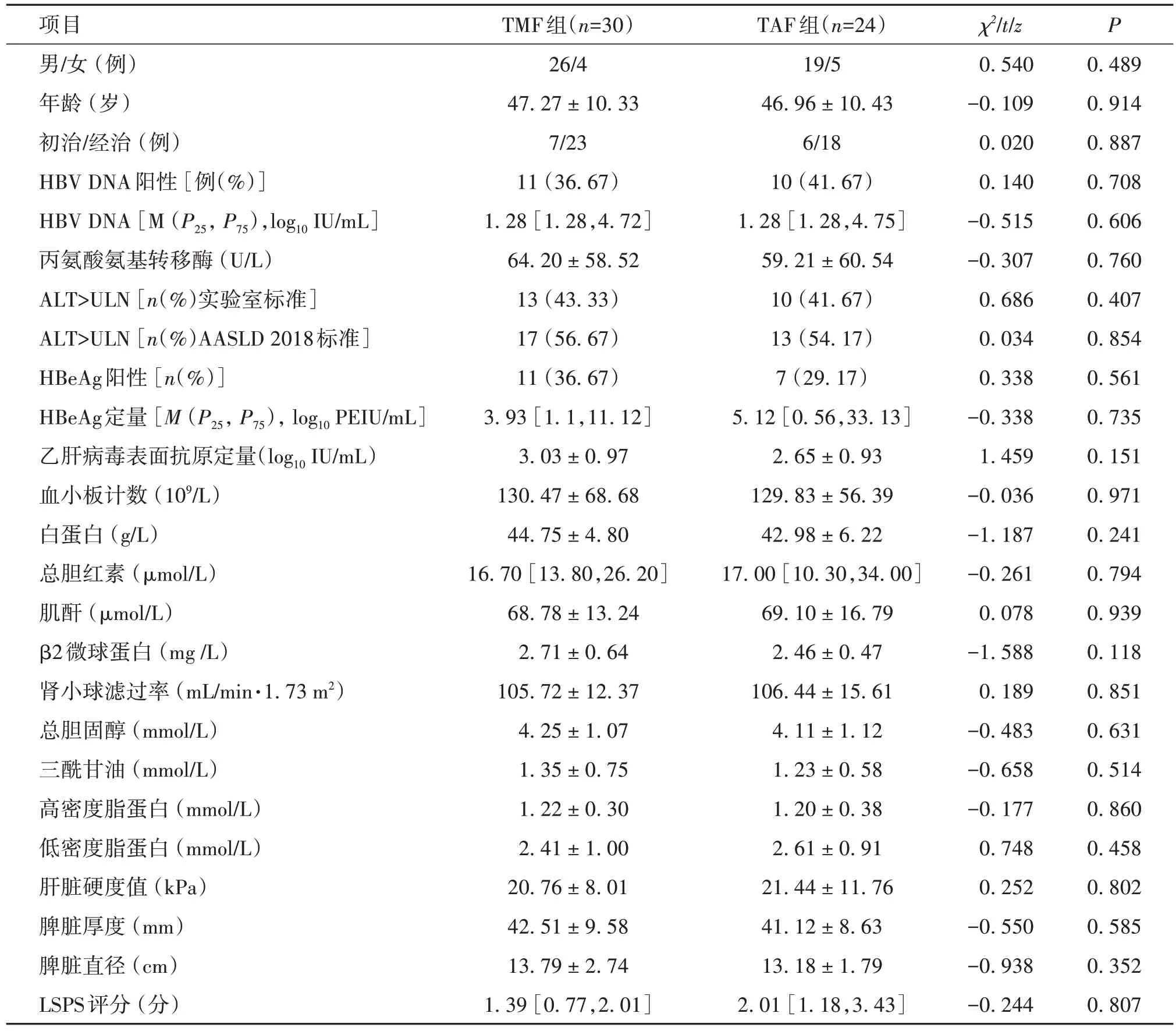
表1 TMF组和TAF组代偿期乙肝病毒相关肝硬化患者的基线资料[M(P25,P75),]
项目男∕女 (例)年龄 (岁)初治∕经治 (例)HBV DNA阳性 [例(%)]HBV DNA [M (P25, P75),log10 IU∕mL]丙氨酸氨基转移酶 (U∕L)ALT>ULN [n(%)实验室标准]ALT>ULN [n(%)AASLD 2018标准]HBeAg阳性 [n(%)]HBeAg定量 [M (P25, P75), log10 PEIU∕mL]乙肝病毒表面抗原定量(log10 IU∕mL)血小板计数 (109∕L)白蛋白 (g∕L)总胆红素 (µmol∕L)肌酐 (µmol∕L)β2微球蛋白 (mg ∕L)肾小球滤过率 (mL∕min·1.73 m2)总胆固醇 (mmol∕L)三酰甘油 (mmol∕L)高密度脂蛋白 (mmol∕L)低密度脂蛋白 (mmol∕L)肝脏硬度值 (kPa)脾脏厚度 (mm)脾脏直径 (cm)LSPS评分 (分)TMF组(n=30)26∕4 47.27 ± 10.33 7∕23 11 (36.67)1.28 [1.28,4.72]64.20 ± 58.52 13 (43.33)17 (56.67)11 (36.67)3.93 [1.1,11.12]3.03 ± 0.97 130.47 ± 68.68 44.75 ± 4.80 16.70 [13.80,26.20]68.78 ± 13.24 2.71 ± 0.64 105.72 ± 12.37 4.25 ± 1.07 1.35 ± 0.75 1.22 ± 0.30 2.41 ± 1.00 20.76 ± 8.01 42.51 ± 9.58 13.79 ± 2.74 1.39 [0.77,2.01]TAF组(n=24)19∕5 46.96 ± 10.43 6∕18 10 (41.67)1.28 [1.28,4.75]59.21 ± 60.54 10 (41.67)13 (54.17)7 (29.17)5.12 [0.56,33.13]2.65 ± 0.93 129.83 ± 56.39 42.98 ± 6.22 17.00 [10.30,34.00]69.10 ± 16.79 2.46 ± 0.47 106.44 ± 15.61 4.11 ± 1.12 1.23 ± 0.58 1.20 ± 0.38 2.61 ± 0.91 21.44 ± 11.76 41.12 ± 8.63 13.18 ± 1.79 2.01 [1.18,3.43]χ2∕t∕z 0.540-0.109 0.020 0.140-0.515-0.307 0.686 0.034 0.338-0.338 1.459-0.036-1.187-0.261 0.078-1.588 0.189-0.483-0.658-0.177 0.748 0.252-0.550-0.938-0.244 P 0.489 0.914 0.887 0.708 0.606 0.760 0.407 0.854 0.561 0.735 0.151 0.971 0.241 0.794 0.939 0.118 0.851 0.631 0.514 0.860 0.458 0.802 0.585 0.352 0.807
1.2 纳入排除标准
1.2.1 纳入标准 ① 符合《慢性乙型肝炎防治指南(2022年版)》诊断标准[4]的乙肝病毒相关肝硬化患者(既往无消化道出血史、肝性脑病史、腹水等失代偿事件); ② 年龄>18周岁,性别不限;③ 首次接受TAF或TMF抗病毒治疗,无论既往是否接受其他抗HBV药物治疗;④ 定期随访且疗程至少24周。
1.2.2 排除标准 ① 合并人类免疫缺陷病毒、甲型肝炎病毒、丙型肝炎病毒、丁型肝炎病毒、戊型肝炎病毒等病毒感染者;② 原发性肝癌(不包括随访过程中新诊断的肝细胞癌)、其他恶性肿瘤、器官移植史;③ 合并自身免疫性肝炎或其他活动性肝病;④ 同时使用免疫调节剂、细胞毒性药物或类固醇类激素治疗;⑤ 合并其他原发性或继发性骨肾疾病;⑥ 缺失关键时间点的实验室及临床数据。
本研究经郑州大学第一附属医院伦理委员会批准(序列号2023-KY-0301)。
1.3 治疗方法
1.3.1 TMF组 25 mg TMF(常州恒邦药业有限公司,国药准字H20210029)25 mg口服,1次∕d。
1.3.2 TAF组 25 mg TAF(Vemlidy; Gilead Sciences, Foster City, CA)25 mg 口服,1次∕d。
1.4 观察指标
1.4.1 主要疗效判定指标 治疗24周时病毒学应答率(HBV DNA<20 IU∕mL)及HBV DNA(log10IU∕mL)水平变化。
1.4.2 次要疗效判定指标 治疗24周时丙氨酸氨基转移酶(alanine aminotransferase, ALT)复常率、血清学(HBeAg和HBsAg清除率、HBeAg和HB-sAg血清学转换率、HBsAg水平变化)、血小板(platelets, PLT)、肝硬度检测值(liver stiffness measurement, LSM)、LSPS评分(LSPS:LSM×脾脏直径∕血小板)[6]、失代偿发生率、肾功能和血脂的变化情况等。
1.5 检测方法
使用Abbott实时定量PCR检测试剂盒(Abbott Molecular Inc, 德普兰斯公司, IL)检测HBV DNA(<20 IU∕mL时被定义为病毒学应答);使用美国雅培公司生产的Architecti2000化学发光免疫分析仪及其配套试剂检测血清HBV标志物(血清HBsAg<0.05 IU∕mL被定义为HBsAg转阴,血清抗-HBs≥10 mIU∕mL被定义为HBsAb阳性;HBeAg<0.18 PEIU∕mL被定义为HBeAg转阴,血清抗-HBe<1S∕CO被定义为抗-HBe阳性)。ALT、总胆红素、肌酐和β2微球蛋白正常范围的上限分别为40 U∕L(基于AASLD 2018标准:男性≤35 U∕L;女性≤25 U∕L)、17.1 mmol∕L、115 mmol∕L、3 mg∕L,血小板计数正常范围的下限为10×109∕L。LSM采用肝纤维化无创检测仪器Fibro Scan®来进行测量,肝纤维化进行分级:LSM≥12.5 kPa(12.5±1.0 kPa)诊断肝硬化(F4); 9.5 kPa 应用SPSS26.0软件进行统计学分析。对正态分布的计量资料以()表示, 两组内比较采用配对样本t检验,两组间比较采用独立样本t检验;对非正态分布的计量资料以M(P25,P75)表示, 两组间比较采用Wilcoxon秩和检验或配对Wilcoxon秩和检验。计数资料以百分比(%)表示,两组间比较采用χ2检验或Fisher精确概率计算。P<0.05表示差异有统计学意义。 共54例患者完成24周治疗纳入分析(30例TMF,24例TAF)。基线时TMF组和TAF组的年龄、HBV DNA、ALT、LSM水平两组各指标差异均无统计学意义(P>0.05,表1)。 2.2.1 病毒标志物相关指标 2.2.1.1 病毒学应答:治疗24周时TMF组与TAF组病毒学应答率分别为:100%(11∕11)vs80%(8∕10),差异无统计学意义(P>0.05,图1A);TAF组2例患者治疗24周时HBV DNA仍未转阴,HBV DNA水平分别下降7.57 log10IU∕mL、2.55 log10IU∕mL;两组无患者出现病毒学突破。 图1 TMF组和TAF组代偿期乙肝病毒相关肝硬化患者基线及治疗24周时病毒学应答率、 ALT复常率、 HBeAg水平、HBsAg水平及其变化 2.2.1.2 HBV DNA水平的变化:TMF组和TAF组治疗24周时HBV DNA水平分别为1.28 [1.28,1.28]vs1.28 [1.28,1.28],较各自基线均显著下降(P值均<0.05),组间差异无统计学意义(P>0.05)。 2.2.1.3 HBeAg的变化:治疗24周时TMF组和TAF组HBeAg水平分别为3.89 [1.62,6.79]vs2.63 [0.52,4.65]log10PEIU∕mL,较各自基线均下降,组内比较差异有统计学意义(P<0.01vs P<0.05),组间比较差异无统计学意义(P>0.05);TMF组和TAF组的HBeAg血清学转换率分别为20%(2∕10)vs14.29%(1∕7),差异均无统计学意义(P>0.05,图1C)。 2.2.1.4 HBsAg的变化: 治疗24周时TMF组HBsAg水平低于TAF组[(2.49±1.01)vs(3.04±0.88) log10IU∕mL,P<0.05)]。所有患者均未出现HBsAg血清学转换及HBsAg阴转(图1D)。 2.2.2 肝功能相关指标 2.2.2.1 ALT复常率:治疗24周时TMF组与TAF组ALT复常率(基于实验室标准)分别为84.62%(11∕13)vs90.00%(9∕10)(P>0.05),差异无统计学意义(图1B);ALT复常率(基于AASLD 2018标准)分别为:64.71(11∕17)vs53.85(7∕13)(P>0.05),差异无统计学意义(图1B)。 2.2.2.2 其他肝功能指标:治疗24周时TMF组和TAF组ALT、总胆红素(total bilirubin, TBIL)较各自基线显著下降,人血清白蛋白(serum albumin, ALB)较各自基线显著升高,组内比较差异均有统计学意义,P值分别为(0.004、0.005、<0.001)vs(0.005、0.149、0.003),组间比较差异无统计学意义(P值均>0.05,表2)。 表2 24周时TMF组和TAF组代偿期乙肝病毒相关肝硬化患者的主要和次要疗效终点[M(P25,P75),] 表2 24周时TMF组和TAF组代偿期乙肝病毒相关肝硬化患者的主要和次要疗效终点[M(P25,P75),] 项目HBV DNA (log10 IU∕mL)乙肝病毒e抗原定量 (log10 PEIU∕mL)乙肝病毒表面抗原定量 (log10 IU∕mL)血小板计数 (109∕L)丙氨酸氨基转移酶(U∕L)白蛋白 (g∕L)总胆红素 ( µmol∕L )肌酐 ( µmol∕L)β2微球蛋白 (mg ∕L)肾小球滤过率(mL∕min·1.73 m2)总胆固醇 (mmol∕L)三酰甘油 (mmol∕L)高密度脂蛋白 (mmol∕L)低密度脂蛋白 (mmol∕L)肝脏硬度 (kPa)脾脏厚度 (mm)脾脏直径 (cm)LSPS (分)TMF组(n=30)1.28 [1.28,1.28]3.89 [1.62,6.79]2.49 ± 1.01 132.27 ± 69.79 29.83 ± 12.26 47.79 ± 4.61 15.35 [11.20,21.40]71.01 ± 13.94 2.54 ± 0.75 103.89 ± 13.02 4.46 ± 1.12 1.12 ± 0.64 1.32 ± 0.29 2.69 ± 1.10 16.79 ± 5.66 41.77 ± 10.21 13.74 ± 2.52 1.86 [1.02,3.41]TAF组(n=24)1.28 [1.28,1.28]2.63 [0.52,4.65]3.04 ± 0.88 137.75 ± 61.61 27.17 ± 14.73 47.89 ± 8.54 14.10 [10.25,19.15]67.93 ± 18.35 2.45 ± 0.46 106.39 ± 15.55 4.46 ± 0.91 1.38 ± 0.70 1.22 ± 0.33 2.62 ± 0.65 15.72 ± 7.32 39.29 ± 9.16 13.13 ± 3.46 2.02 [1.32,3.71]χ2∕t∕z-0.789-0.542 2.121 0.302-0.726 0.052-0.635-0.700-0.489-0.887-0.002 1.396-1.183-0.268-0.605-0.926-0.760-1.027 P 0.430 0.588 0.039 0.764 0.471 0.959 0.525 0.487 0.627 0.379 0.999 0.169 0.242 0.789 0.548 0.359 0.451 0.304 2.2.3 肝硬化相关指标 2.2.3.1 PLT的变化:两组PLT均较基线呈升高趋势,组内比较差异均无统计学意义(P均>0.05),组间比较差异无统计学意义(P>0.05,表2)。 2.2.3.2 LSM的变化:两组LSM较基线均显著下降,分别为(16.79±5.66)vs(15.72±7.32) kPa,组内比较差异有统计学意义(P<0.001vsP<0.05),组间比较差异无统计学意义(P>0.05,图2A)。 图2 TMF组和TAF组代偿期乙肝病毒相关肝硬化患者基线及治疗24周时LSM及LSPS评分变化 2.2.3.3 LSPS评分的变化:TMF组和TAF组均呈下降趋势,TMF组内比较差异有统计学意义(P<0.05),治疗24周时为1.86 [1.02,3.41],TAF组内比较差异无统计学意义(P>0.05),治疗24周时为2.02 [1.32,3.71],组间比较差异无统计学意义(P>0.05,图2B)。 2.2.3.4 肝硬化相关并发症:治疗24周时TMF组和TAF组失代偿发生率分别为33.33%(1∕30)vs0.00%(0∕24),差异无统计学意义(P>0.05);TMF组中仅有1例患者出现失代偿事件(少量腹水),无患者出现食管胃底静脉曲张破裂出血、肝性脑病等其他失代偿事件。 2.3.1 肾功能的变化 TMF组和TAF组血清肌酐、估算的肾小球滤过率、血β2微球蛋白较基线均无显著改变,治疗24周时较各自基线差异均无统计学意义(P均>0.05),组间比较差异无统计学意义(P>0.05)。 2.3.2 血脂的变化 TMF组治疗24周时高密度脂蛋白(high density lipoprotein, HDL)升高0.10 mmol∕L,低密度脂蛋白(low density lipoprotein, LDL)升高0.28 mmol∕L(P<0.05,P=0.001),TAF治疗24周时总胆固醇(total cholesterol, TC)升高0.35 mmol∕L(P<0.05);三酰甘油(triglycerides, TG)在TMF组降低0.27 mmol∕L,TAF组升高0.15 mmol∕L,组间差值比较差异有统计学意义(P<0.05,图3)。 图3 TMF组和TAF组代偿期乙肝病毒相关肝硬化患者基线及治疗24周时血脂的变化趋势 CHB不经治疗,每年可有2%~10%的患者发展为肝硬化[2],而持续抑制HBV复制被认为是治疗乙肝病毒相关肝硬化的关键[7]。大量临床研究[8]显示,长期有效抑制HBV DNA复制可以延缓、改善甚至逆转肝纤维化及早期肝硬化,降低失代偿事件、HCC发生率,改善临床结局,如ETV或TDF治疗肝纤维化及乙肝病毒相关肝硬化患者5~6年时,肝纤维化及肝硬化逆转率可达51%~88%。在抗病毒药物的选择方面,目前指南推荐用药主要有ETV、TDF、TAF[4],其中TAF疗效显著且安全性良好,但可能会引起血脂异常。TMF因在TAF的酰胺化基团上增加了一个甲基而具有比TAF细胞膜透过速率更快、血浆中稳定性更好等特点[5],能更好地发挥抗病毒作用,但目前缺乏其真实世界条件下治疗代偿期乙肝病毒相关肝硬化患者的疗效及安全性的临床研究数据,故尚未推荐用于乙肝病毒相关肝硬化患者。本研究表明TMF用于代偿期乙肝病毒相关肝硬化患者的疗效及安全性与TAF无显著差异。 近来,已有TAF用于乙肝病毒相关肝硬化患者(代偿期或者失代偿期)的相关研究,一项前瞻性真实世界研究[9]表明,即使对于难以管理的患有乙肝病毒相关肝硬化(共76例)和严重合并症的老年患者,将TDF转为TAF仍安全有效,且血脂和体重无显著增加。此外,王莉琳等[10]的一项关于TAF治疗53例(TAF组30例)失代偿期乙肝病毒相关肝硬化患者的研究显示,治疗24周时,TAF组病毒学应答率显著高于ETV组(38.1% [8∕21]vs4.8% [1∕21])(P<0.05)。TAF组基线ALT异常者24周的ALT复常率为63.6%,高于ETV组(55.6%),肝硬化并发症发生率均显著降低(P均<0.001)。然而,TMF用于肝硬化患者的数据仅在TMF的Ⅲ期临床试验中有所体现(48周及96周随访结果)[11-12]。TMF的Ⅲ期临床试验中,共纳入1 002例CHB患者(TMF组666例),其中包括125例基线时有肝硬化的患者,经过24、48、96周的随访,显示出其与TDF相当的抗病毒疗效[11],第96周末达到完全病毒学应答的患者,52%以上HBV DNA滴度低于69 IU∕mL[12],用于治疗CHB患者的48周ALT复常率为72.1%,高于TDF组(64.6%,P>0.05),LSM较基线显著下降[11-12]。最近Li等[13]的一项单中心、回顾性真实世界研究显示出TMF优于TAF的抗病毒疗效,结果显示CHB患者抗病毒治疗24周时TMF完全病毒学应答率高于TAF(92%vs74%,P<0.05)。 然而,尚未见探讨TMF在代偿期肝硬化患者中抗病毒疗效及其与TAF之间差异的报道。本研究进行比较后发现,TMF和TAF治疗初治或经治代偿期乙肝病毒相关肝硬化患者时仍显示出强大的抗病毒疗效,病毒学应答率为100%(11∕11)vs80%(8∕10),两组差异无统计学意义,考虑与样本量少、研究对象均为代偿期肝硬化患者、基线HBV DNA水平较低、经治患者比例高有关。因此,TMF完全病毒学应答率是否高于TAF,还需大样本量、长时间随访来验证。此外,在经治患者中,有7例患者(5例既往使用ETV,2例既往使用TDF)抗病毒治疗48周以上病毒学应答不佳,仍可检测到HBV DNA且>2 000 IU∕mL,换用TMF后所有患者均呈现病毒学应答,提示ETV、TDF等抗病毒治疗应答不佳的代偿期乙肝病毒相关肝硬化患者换用TMF继续抗病毒治疗是可行的,也可能在改善耐药方面存在优势。其他基线时未检测到HBV DNA的患者在治疗24周后仍保持稳定,这也从侧面反映了TMF抗病毒疗效的稳定性,但其长期稳定性还需长期随访进一步验证。同时,在本研究中,TMF治疗代偿期乙肝病毒相关肝硬化患者的ALT复常率(实验室标准)为84.62%,TAF组为90.00%,两者疗效相仿(P>0.05)。同时,TMF基线较治疗24周时ALB升高、TBIL中位数降低,ALT中位数显著降低。上述研究结果提示TMF与TAF治疗代偿期乙肝病毒相关肝硬化患者均可使其肝功能改善,两者疗效相仿(P>0.05)。 同时,本研究发现,TMF在降低HBsAg方面或优于TAF。多项研究[14-15]表明,应用核苷类药物抗病毒治疗病毒学应答率高于Peg IFN-α治疗,但在HBeAg血清学转换,尤其是HBsAg阴转方面,干扰素具有相较于核苷类药物的绝对优势,核苷类药物仅起到降低其定量水平的作用。TMF的Ⅲ期临床试验中也仅有0.6%的患者实现了HBsAg阴转[11-12]。虽然本研究中TMF组10例HBeAg阳性患者中有2例患者发生HBeAg血清学转换,但考虑与其基线时HBeAg极低水平(0.2 log10PEIU∕mL,0.4 log10PEIU∕mL)密切相关;TAF组仅一例患者(1∕7)发生HBeAg血清学转换(基线0.07 log10PEIU∕mL)。对于HBsAg,本研究中也观察到了上述类似的结果,两组均无患者发生HBsAg阴转。但在HBsAg水平上,本研究中TMF与TAF组均显著下降(两组中位数分别下降284.58 log10IU∕mL、107.35 log10IU∕mL),且TMF组优于TAF组(P<0.05),其潜在临床益处有待进一步研究。不可否认的是,此研究样本量少、随访时间短,该结果仍需进一步验证。 在肝硬化方面,自从2003年Gastroenterology杂志发表LAM抗病毒治疗可逆转肝纤维化和肝硬化的临床研究结果[16]以来,越来越多的证据表明抗HBV治疗可明显改善肝硬化患者的组织学状态[13],本研究中TMF和TAF组LSM值较各自基线显著下降。值得注意的是,两组中分别有20%(6∕30)和29.17%(7∕24)的患者治疗24周后LSM<12 kPa,以上结果均表明,TMF治疗代偿期乙肝病毒相关肝硬化患者可显著改善肝硬化患者的组织学状态,疗效与TAF相仿。在血清学预测肝硬化患者食管胃底静脉曲张破裂出血方面,2010年美国学者首次利用LSPS预测乙型肝炎肝硬化患者的食管静脉曲张,发现其可以相对可靠地预测静脉曲张[17]。后续多项研究也证明其在预测出血风险方面相对可靠[6]。本研究中两组LSPS评分在治疗24周后较各自基线均显著下降,这或许提示在TMF和TAF治疗24周时,乙肝病毒相关肝硬化患者的食管胃底静脉曲张程度和破裂出血的风险有所降低。 安全性方面,现有药物的安全性问题主要集中在肾损伤及血脂异常方面,尤其是乙肝病毒相关肝硬化患者易并发肝肾综合征,因此,肝硬化患者在抗病毒药物的选择上要求具有更高的肾脏安全性。TAF因其抗病毒疗效显著,骨肾安全性良好而跃居慢性乙型病毒性肝炎患者抗病毒治疗一线药物。在TMF的Ⅲ期临床试验中,TMF也同样显示出优于TDF的骨肾安全性(抗病毒治疗48周时TMF组较TDF组出现估算的肾小球滤过率下降、血肌酐升高的比例低,TDF组出现肾衰的患者比TMF组多8.67%)。对于经治人群,估算的肾小球滤过率在TMF组升高,在TAF组降低。这与本研究结果相似,肝硬化患者抗病毒治疗24周时,TMF与TAF对肾功能各项指标均无显著影响。血脂方面,最近,我国学者对TMF与TAF在真实世界治疗CHB患者的疗效及安全性进行了比较,结果显示TMF不仅未加重血脂紊乱,反而HDL有所升高。在本研究中,TMF对血脂的影响优于TAF,表现在TMF治疗24周时TG下降(P<0.05),TC升高但无统计学意义(P>0.05),HDL升高(P<0.05);TAF对血脂的影响表现在治疗24周后TC、TG升高(P<0.05),HDL、LDL均升高但无统计学意义,这与TMF的Ⅲ期临床试验结果接近[11-12]。目前核苷(酸)类似物引起脂质代谢异常的原因尚不明确,但在24周的随访过程中并未有患者出现心绞痛、冠心病加重等严重并发症,长期影响尚不明确,有待更长时间随访及监测,以上结果提示对于乙肝合并心脑血管疾病患者使用TAF或TMF抗病毒治疗过程中应注意监测血脂甚至联合使用降脂药物。 本研究仍存在一定的局限性,例如随访时间短、样本量小、为单中心的回顾性研究,在诊断及评估患者肝硬化及肝硬化治疗前后是否改善时,并未获取肝组织学证据。理解抗病毒治疗后肝脏的长期获益情况仍需要更多大规模、多中心的前瞻性研究,以获得更多的研究数据,为乙肝病毒相关肝硬化患者抗病毒药物的选择提供更可靠的依据。 综上,TMF和TAF在治疗代偿期乙肝病毒相关肝硬化患者时,具有快速强效的抗病毒作用,表现为24周较高的病毒学应答率和ALT复常率,总体安全性良好。此外,TMF在降低HBsAg、升高HDL和降低TC时优于TAF。1.6 统计学方法
2 结果
2.1 基线资料
2.2 TMF与TAF的疗效
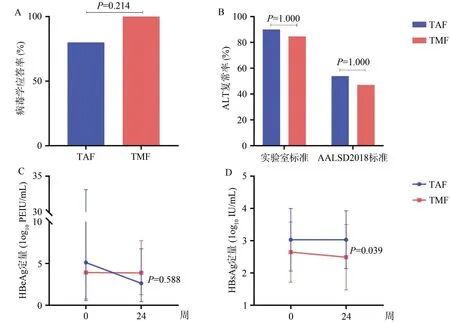

2.3 安全性指标

3 讨论

