LOXL1-AS1对OGD诱导的人脑微血管内皮细胞损伤的影响
徐 枫, 黎村丰, 朱观祥
卒中仍然是全球第二大死亡原因,也是导致患者长期残疾的第一大原因[1]。卒中主要分为两种类型:缺血性卒中和出血性卒中。几乎86%的卒中是由脑缺血引起的,这是由于血液从血块流向大脑的过程中断,导致大脑缺氧和营养不足,最终导致原发性脑损伤[2]。缺血性卒中是一个复杂的病理过程,其机制尚不清楚。非编码RNA,包括长链非编码RNA(long noncoding RNA,lncRNA)和微小RNA(microRNA,miRNA/miR),通过不同的机制调节基因表达和功能[3,4]。lncRNA 被报道作为miRNA 充当竞争性内源RNA(competing endogenous RNAs,ceRNA),影响卒中过程[5]。例如lncRNA SNHG14 通过调节miR-199b/水通道蛋白4 轴促进缺血性脑损伤[6],lncRNA XIST 的消耗通过miR-362/Rho 相关卷曲螺旋形成蛋白激酶2轴减弱脑缺血/再灌注中的神经损伤和炎症反应[7]。lncRNA LOXL1 反义RNA 1(antisense RNA 1,LOXL1-AS1)位于人类染色体15q24.1,由10 781 个核苷酸和5 个外显子组成[8]。LOXL1-AS1 通过调节miR-590-5p 调节的Kruppel 样锌指转录因子6/血管内皮生长因子信号通路,促进动脉粥样硬化进展中的血管生成[8],并通过靶向miR-423-5p/赖氨酸特异性去甲基化酶5C 轴促进骨关节炎进展[9]。然而,LOXL1-AS1 是否在缺血性卒中中起作用仍不清楚。本研究通过HBMEC 的氧糖剥夺(oxygen-glucose deprivation,OGD)来模拟缺血性卒中模型,旨在探索LOXL1-AS1 在缺血性卒中中的生物学功能并揭示其相关的分子机制。
1 材料与方法
1.1 材料 人脑微血管内皮细胞(human brain microvascular endothelial cells,HBMEC)及其培养基购于上海中乔新舟生物科技有限公司;细胞计数试剂盒8(cell counting kit-8,CCK-8)、RIPA 裂解液、白细胞介素(interleukin,IL-6)酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)试剂盒、IL-1β ELISA 试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α) ELISA 试剂盒、膜联蛋白V(annexinV)-FITC/碘化丙啶(propidium iodide,PI)试剂盒购于上海Beyotime 公司;si-NC、si-LOXL1-AS1、miRNC、miR-761 mimic、anti-miR-NC、miR-761 Inhibitor购于广州RiboBio 公司;兔抗B 细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)抗体、兔抗Bcl-2相关X 蛋白(Bcl-2 associated X protein,Bax)抗体购于美国Abcam公司;RevertAid First Strand cDNA Synthesis Kit 购于美国Thermo 公司;SYBR Green PCR Master 购于上海Toyobo 公司;pmirGLO 质粒、Dual-Glo荧光素酶检测试剂盒购于美国Promega公司。
1.2 细胞培养与OGD 损伤 HBMEC 在包含5%胎牛血清、1%内皮细胞生长因子、1%青霉素/链霉素的内皮细胞培养基中,在37 ℃、5% CO2气氛中生长。OGD损伤时,将细胞培养基替换为无糖培养基,并在94% N2、5% CO2和1% O2培养箱中保持。4 h 后将培养液替换为含糖培养基,并在正常培养箱中保持2 h[10]。
1.3 实验分组 HBMEC 分为对照组(正常培养)、OGD 组(OGD 损伤)、OGD+si-NC 组(转染si-NC)、OGD+si-LOXL1-AS1 组(转染si-LOXL1-AS1)、OGD+miR-NC 组(转染miR-NC)、OGD+miR-761 组(转染miR-761 mimic)、OGD+si-LOXL1-AS1+阴性对照组(转染si-LOXL1-AS1 与anti-miR-NC)、OGD+si-LOXL1-AS1+miR-761 抑制剂组(转染si-LOXL1-AS1与miR-761 Inhibitor)。转染时,按照制造商Invitrogen 的操作指示,使用Lipofectamine 2000 试剂在HBMEC 中转染si-NC、si-LOXL1-AS1、miR-NC、miR-761 mimic、anti-miR-NC、miR-761 inhibitor,转染48 h后,进行OGD损伤。实验重复3次。
1.4 RT-qPCR 检测LOXL1-AS1 和miR-761 表达HBMEC 处理结束后,用TRIzol 裂解液在冰上裂解。按照RevertAid First Strand cDNA Synthesis Kit的操作流程进行逆转录反应,将总RNA 转化为cDNA。按照SYBR Green PCR Master 的操作流程进行PCR 反应。U6 作为miR-761 的内源对照,GAPDH作为LOXL1-AS1的内源对照。2-ΔΔCt值表示基因的相对表达。LOXL1-AS1正向引物5'-AATTGCCCTCTTGGGC TTAT-3',反向引物5'-GTCTCACCTTCCCATTCCAA-3';GAPDH 正向引物5' -CATGAGAAGTATGACAACAG CCT-3',反向引物5'-AGTCCTTCCACGATACCAAAG T-3';miR-761正向引物5'-ACAGGCAGGCACAGAC-3',反向引物5'-GAGCAGGCTGGAGAA-3';U6 正向引物5'-CTCGCTTCGGGCAGCACA-3',反向引物5'-AA CGCTTCACGAATTTGCGT-3'。
1.5 CCK-8法检测细胞存活率 将每组HBMEC接种于96 孔板(5×103个细胞/孔),培养48 h。除去之前的培养基,加入CCK-8 和培养基混合物(CCK-8与培养基的比例为1∶10)。在正常培养箱中培养1 h后,通过酶标仪测定培养板在450 nm 处的吸光度OD 值,以实验组与对照组OD 百分比为细胞存活率(%)。
1.6 流式细胞术检测细胞凋亡 将每组HBMEC(1×105)悬浮在结合缓冲液中,按照annexinV-FITC/PI 试剂盒的操作流程,加入5 µl annexinV-FITC 和5 µl PI 试剂,避光反应15 min。应用BD FACS Calibur流式细胞仪检测细胞凋亡。
1.7 Western blotting 检测Bax、Bcl-2 蛋白表达每组HBMEC处理完成后,使用RIPA裂解液在冰上裂解。细胞完全裂解30 min,然后在4 ℃离心机中以14 000 r/min离心15 min。共取50 µg总蛋白,用SDSPAGE 在100 V 下电泳2 h。分离的蛋白质电转移到聚偏二氟乙烯膜上。在室温下用5%脱脂奶粉密封膜1 h。然后与Bax 抗体(1∶1 500)、Bcl-2 抗体(1∶1 500)、GAPDH 抗体(1∶2 000)在4 ℃下孵育过夜,与辣根过氧化物酶标记的抗兔二抗(1∶10 000)一起孵育(室温,1 h)。使用Pierce ECL 蛋白质印迹底物试剂进行X 射线显影,并通过Image J分析Bax、Bcl-2蛋白的灰度值。
1.8 ELISA 检测炎性因子IL-6、IL-1β 和TNF-α 水平 收集HBMEC 上清液,按照IL-6、IL-1β和TNF-α ELISA 试剂盒的操作流程,进行测定,用酶标仪记录450 nm 处的OD 值,根据标准曲线计算IL-6、IL-1β和TNF-α水平。
1.9 双荧光素酶报告实验检测LOXL1-AS1和miR-761 的互补结合 将LOXL1-AS1 的序列扩增并转移至pmirGLO 质粒下游的荧光素酶基因,获得WT-LOXL1-AS1。同时根据starbase 软件预测的LOXL1-AS1 和miR-761 结合位点,获得含有突变靶点的LOXL1-AS1 片段MUT-LOXL1-AS1。使用Lipofectamine 2000 试剂将WT-LOXL1-AS1、MUTLOXL1-AS1 和miR-761 mimic、miR-NC 共转染到HBMEC 中。转染48 h,通过Dual-Glo 荧光素酶检测试剂盒评估相对荧光素酶活性。
2 结 果
2.1 抑制LOXL1-AS1 对OGD 诱导的HBMEC 损伤的影响 与对照组相比,OGD 组HBMEC 的LOXL1-AS1 表达量增加(见图1A),存活率减少(见图1B),凋亡率增加(见图2A 和图1C),Bax表达量增加,Bcl-2表达量减少(见图2B和图1D,均P<0.05)。抑制LOXL1-AS1 后,与OGD 组或OGD+si-NC 组相比,OGD+si-LOXL1-AS1 组HBMEC的LOXL1-AS1 表达量减少(见图1A),存活率增加(见图1B),凋亡率降低(见图2A 和图1C),Bax 表达量减少,Bcl-2 表达量增加(见图2B 和图1D,均P<0.05)。

图1 抑制LOXL1-AS1对OGD诱导的HBMEC损伤的检测(n=3,±s)

图2 抑制LOXL1-AS1对OGD诱导的人脑微血管内皮细胞凋亡及相关蛋白表达的影响
2.2 抑制LOXL1-AS1 能降低OGD 诱导的HBMEC中炎性因子的水平 如图3所示,与对照组相比,OGD组HBMEC的炎性因子IL-6、IL-1β和TNF-α水平均升高(均P<0.05)。抑制LOXL1-AS1后,与OGD组或OGD+si-NC 组相比,OGD+si-LOXL1-AS1 组HBMEC的IL-6、IL-1β和TNF-α水平均降低(均P<0.05)。
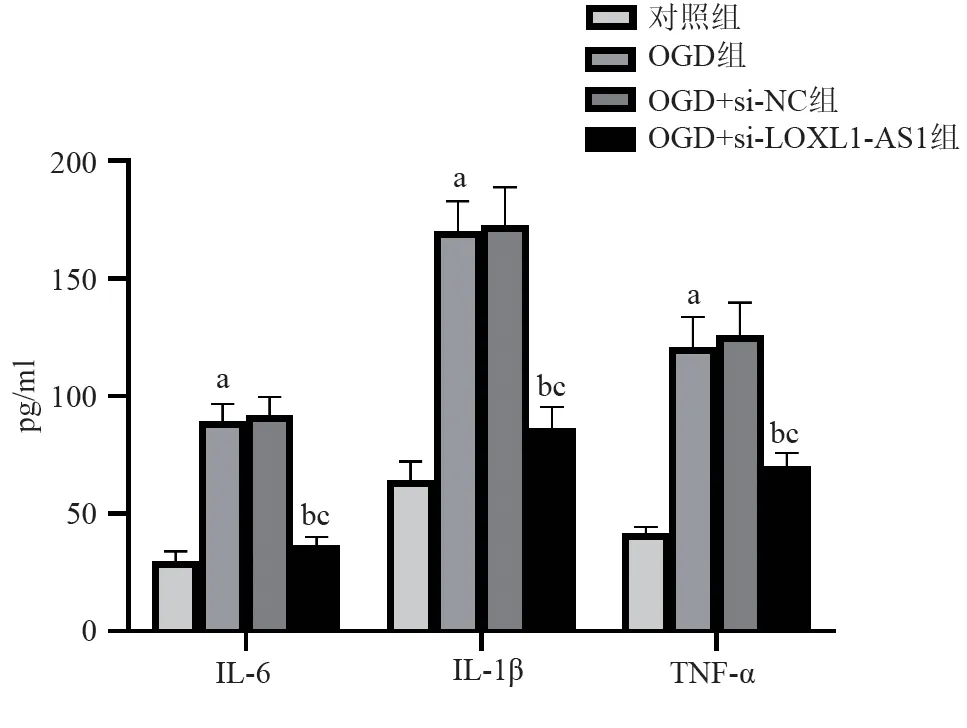
图3 抑制LOXL1-AS1对OGD诱导的HBMEC中炎性因子的检测(n=3,±s)
2.3 LOXL1-AS1 靶向调控miR-761 Starbase 软件预测的LOXL1-AS1 和miR-761 的互补序列见图4。miR-761组WT-LOXL1-AS1荧光素酶活性比miR-NC组减少约52.08%(P<0.05),而MUT-LOXL1-AS1 荧光素酶活性与miR-NC 组无显著差异(P=0.511)(见图5)。转染si-LOXL1-AS1 的HBMEC 中miR-761 表达量比转染si-NC增加约1.89倍(P<0.05)(见图6)。
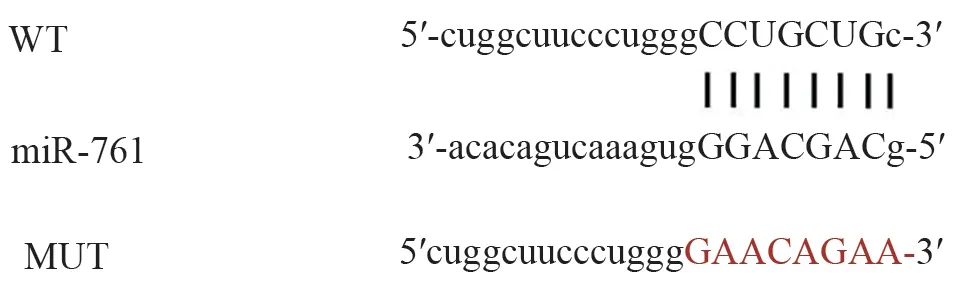
图4 LOXL1-AS1和miR-761的互补序列

图5 LOXL1-AS1双荧光素酶报告实验(n=3,±s)

图6 LOXL1-AS1调控miR-761(±s,n=3)
2.4 miR-761 对OGD 诱导的HBMEC 损伤炎性因子的影响 过表达miR-761 后,OGD+miR-761 组HBMEC 的miR-761 表达量比OGD+miR-NC 组增加(见图7A),存活率比OGD+miR-NC组增加(见图7B),凋亡率比OGD+miR-NC 组减少(见图8A 和图7C),Bax 表达量比OGD+miR-NC 组减少,Bcl-2 表达量比OGD+miR-NC 组增加(见图8B 和图7D),并且IL-6、IL-1β 和TNF-α 水平均比OGD+miR-NC 组降低(见图7E,均P<0.05)。

图7 miR-761对OGD诱导的HBMEC损伤炎性因子的检测(±s,n=3)
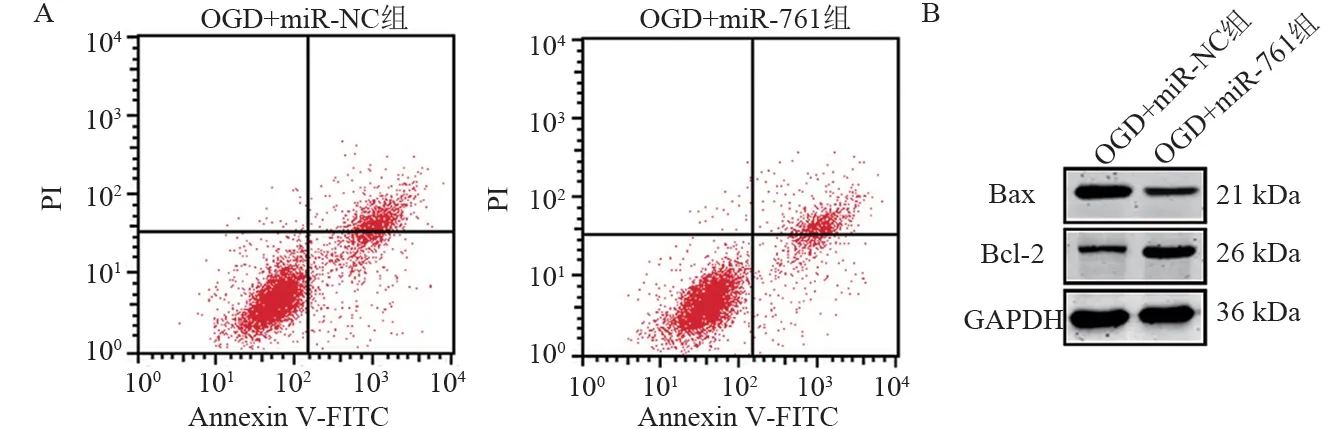
图8 miR-761对OGD诱导的人脑微血管内皮细胞凋亡及凋亡蛋白表达的影响
2.5 抑制miR-761 对抑制LOXL1-AS1 处理的OGD 诱导的HBMEC 损伤炎性因子的影响 抑制miR-761 和抑制LOXL1-AS1 后,OGD+si-LOXL1-AS1+miR-761 抑制剂组HBMEC 的miR-761 表达量低于OGD+si-LOXL1-AS1+阴性对照组(见图9A),存活率低OGD+于si-LOXL1-AS1+阴性对照组(见图9B),凋亡率高于si-LOXL1-AS1+阴性对照组(见图10A 和图9C),Bax 表达量高于OGD+si-LOXL1-AS1+阴性对照组,Bcl-2 表达量少于OGD+si-LOXL1-AS1+阴性对照组(见图10B 和图9D),并且IL-6、IL-1β 和TNF-α 水平均高于OGD+si-LOXL1-AS1+阴性对照组(见图9E,均P<0.05)。
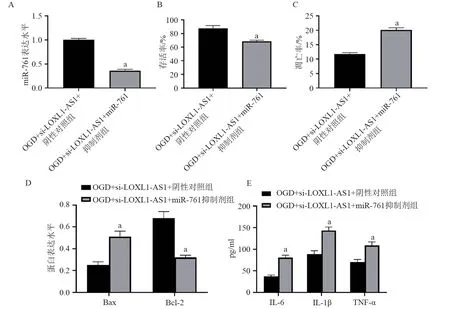
图9 抑制miR-761对抑制LOXL1-AS1处理的OGD诱导的HBMEC损伤炎性因子的检测(±s,n=3)

图10 抑制miR-761对抑制LOXL1-AS1处理的OGD诱导的人脑微血管内皮细胞凋亡及凋亡蛋白表达的影响。
3 讨 论
缺血性脑卒中是最常见的脑血管疾病类型,是多种因素引起的脑血管循环障碍,发病机制复杂[11]。目前,缺血性脑卒中的分子机制尚不清楚,缺乏早期诊断标志物。HBMEC 位于血液和脑实质之间,对正常的神经功能至关重要,并负责传输必需的营养物质和去除潜在的有害毒素[12]。缺血性脑卒中导致脑微血管内皮细胞死亡,并加重神经损伤,保护脑微血管内皮细胞免受缺血性损伤可能对改善脑卒中预后具有重要意义[13]。大量研究表明,脑组织中的炎症反应发生在多种脑部急性病变中,包括缺血性卒中。缺血性卒中后的脑损伤导致坏死和细胞凋亡,这些会驱动由细胞因子释放控制的炎症反应[14,15]。因此本研究利用OGD 处理HBMEC,发现OGD 使HBMEC存活降低、凋亡增加,还提升细胞炎性因子IL-6、IL-1β和TNF-α水平,与前人研究[10,16]吻合。
研究发现,LOXL1-AS1 在胰腺癌[17]、肺腺癌[18]、食管癌[19]、胶质瘤[20]等多种肿瘤中表达上调,促进肿瘤细胞增殖、迁移和侵袭。最近的研究还证明LOXL1-AS1 在非肿瘤疾病中具有重要作用。例如,LOXL1-AS1在绝经后骨质疏松症患者外周血中异常高表达,它抑制人骨髓间充质干细胞的成骨分化但促进脂肪细胞分化[21]。LOXL1-AS1在冠心病患者中高表达,LOXL1-AS1 与miR-16-5p 结合来下调miR-16-5p的表达,从而增强氧化低密度脂蛋白诱导的人冠状动脉内皮细胞焦亡[22]。敲低LOXL1-AS1 对增殖和迁移产生抑制作用,而加速血管平滑肌细胞和人脐静脉内皮细胞的凋亡[23]。此外,在骨关节炎软骨组织中,LOXL1-AS1 上调,沉默LOXL1-AS1 会阻碍软骨细胞的增殖和炎症(IL-6、IL-8 表达)[9]。本研究发现,与对照组相比,OGD 处理的HBMEC 显示出增加的LOXL1-AS1 水平,提示LOXL1-AS1 可能在OGD 介导的HBMEC 炎症和凋亡中发挥潜在作用。抑制LOXL1-AS1 可增加OGD 诱导的HBMEC 存活,并减轻凋亡和炎性因子IL-6、IL-1β 和TNF-α 水平,表明抑制LOXL1-AS1 可以促进细胞存活、减轻凋亡并减弱炎性因子水平,从而改善OGD 诱导的HBMEC损伤。
本研究进一步考察了LOXL1-AS1发挥作用的机制。前人已发现LOXL1-AS1 可充当海绵miRNA 的ceRNA,例如miR-28-5p[24]、miR-708-5p[25]、miR-21[26]。本研究发现,LOXL1-AS1 直接与HBMEC 中的miR-761 结合。miR-761 在急性心肌梗死和缺氧/复氧诱导的HL-1 细胞中下调,miR-761 过表达减轻了缺氧/复氧诱导的HL-1细胞损伤[27]。miR-761保护心肌细胞免受过氧化氢和缺血/再灌注诱导的细胞凋亡和心肌梗死的影响[28]。miR-761 在动脉粥样硬化中以自噬依赖性方式抑制泡沫细胞形成并减少致动脉粥样硬化炎症细胞因子IL-1β和IL-18的产生[29]。然而尚未报道miR-761 与缺血性卒中之间的关联。本研究证明,过表达miR-761促进OGD处理的HBMEC的存活,抑制细胞凋亡和炎性因子水平。表明miR-761对缺血性卒中的潜在保护效果。此外,抑制miR-761可以逆转抑制LOXL1-AS1对OGD 诱导的HBMEC 存活、凋亡和炎性因子的影响,表明抑制miR-761 逆转了抑制LOXL1-AS1 的保护作用。总之,这些数据证明LOXL1-AS1 通过在OGD 处理的HBMEC 中靶向miR-761,调节细胞存活、凋亡和炎性因子水平。
综上所述,本研究发现抑制LOXL1-AS1 可增强OGD 诱导的HBMEC 存活,并抑制凋亡和炎性因子水平,保护细胞损伤,其机制可能与靶向上调miR-761 表达有关。这有助于更好的理解LOXL1-AS1 和miR-761在缺血性卒中中的作用,二者可能是治疗卒中的候选靶点。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:徐枫负责设计论文框架、起草论文;黎村丰负责实验操作、研究过程的实施;朱观祥负责数据收集、统计学分析、绘制图表;徐枫负责论文修改、拟定写作思路、指导撰写文章并最后定稿。

