多维度聚焦2023年高考中的铜
丁修苓
(山东省日照实验高级中学)
铜是人类最早发现并广泛使用的金属,铜及其化合物是金属化合物的重要组成部分,也是高频命题载体.本文结合2023年高考有关铜的命题予以剖析,以期大家对铜的命题动向和考查趋势有所了解,在以后的学习过程中能更加有的放矢,事半功倍.
1 从整体框架上认知铜
铜及其化合物的整体框架如图1所示.
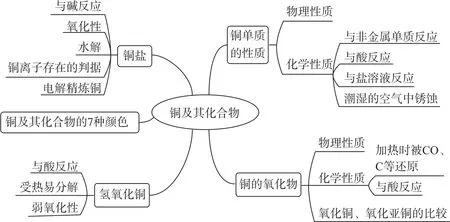
图1
2 从“价一类”二维图角度认识铜
铜的“价—类”二维图如图2所示.

图2
3 从知识细节上突破铜
3.1 铜被锈蚀的原理
1)与O2的反应.在空气中或在O2中加热,表面变黑.利用此反应可除去混在H2、CO 中的少量O2.
2)与O2、CO2、H2O 的作用.铜在干燥的空气中比较稳定,在水中也几乎不反应,在潮湿的空气中铜可生成铜绿:2Cu+O2+CO2+H2O=Cu2(OH)2CO3,铜绿可防止金属进一步被腐蚀.铜绿可以溶解于稀硫酸,离子反应方程式为Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O.
3.2 铜和强氧化性体系反应
1)铜和硝酸反应:
2)铜和浓硫酸反应:Cu +2H2SO4(浓)CuSO4+SO2↑+2H2O.反应后试管内的现象为:铜片逐渐溶解,产生无色有刺激性气味的气体,溶液变为灰白色.如何检测反应后的产物:灰白色物质加入水中变成蓝色溶液证明有CuSO4,气体通入品红溶液中溶液褪色,加热后恢复红色证明是SO2.
3.3 铜的络合物:Cu2+易与NH3 形成[Cu(NH3)4]2+
1)向CuSO4溶液中滴加氨水,生成蓝色沉淀,离子方程式为
2)向沉淀后的悬浊液中继续添加氨水,沉淀溶解,得到深蓝色的透明溶液,离子方程式为
3)实验过程中加入C2H5OH 后可观察到析出深蓝色[Cu(NH3)4]SO4·H2O 晶体.实验中所加C2H5OH 的作用是降低物质的溶解度,加快其析出.
4 从高考命题中探究铜
4.1 对于铜盐的多角度考查
例1(2023年1月浙江卷2)硫酸铜应用广泛,下列说法不正确的是( ).
A.Cu元素位于周期表p区
B.硫酸铜属于强电解质
C.硫酸铜溶液呈酸性
D.硫酸铜能使蛋白质变性
【真题品鉴】该题看似简单,但涉及必修2和选择性必修1、2和3的知识,知识跨度大,对学生知识的综合性和迁移性有较高的要求.
4.2 融合“价—类”二维图考查
例2(2023年广东卷10)部分含Na或含Cu物质的分类与相应化合价关系如图3所示.下列推断不合理的是( ).

图3
A.可存在c→d→e的转化
B.能与H2O 反应生成c的物质只有b
C.新制的d可用于检验葡萄糖中的醛基
D.若b能与H2O 反应生成O2,则b中含共价键
【真题品鉴】该题将+1价的铜和钠融合在一个“价—类”二维图上考查,要求结合不同的选项情境进行代入性判断,理解过氧化钠的结构与性质是解答该题的关键.
4.3 考查硫酸铜热氨电池
例3(双选)(2023年山东卷11)利用热再生氨电池可实现CuSO4电镀废液的浓缩再生.电池装置如图4所示,甲、乙两室均预加相同的CuSO4电镀废液,向甲室加入足量氨水后电池开始工作.下列说法正确的是( ).

图4
A.甲室Cu电极为正极
B.隔膜为阳离子膜
C.电池总反应为
D.NH3扩散到乙室将对电池电动势产生影响
【真题品鉴】本题考查了浓差电池,该电池是利用物质的浓度差产生电势的一种装置.两侧半电池中的特定物质有浓度差,导致半电池上发生的氧化还原反应程度不同,从而产生不同的电势.当NH3扩散到乙室,则会与生成的Cu2+结合生成[Cu(NH3)4]2+,降低Cu2+的浓度,对电池电动势产生影响.
4.4 融合工艺微流程考查铜冶金污水处理
例4(2023年湖南卷9)处理某铜冶金污水(含Cu2+、Fe3+、Zn2+、Al3+)的部分流程如图5 所示.已知:①溶液中金属离子开始沉淀和完全沉淀时的pH如表1所示.
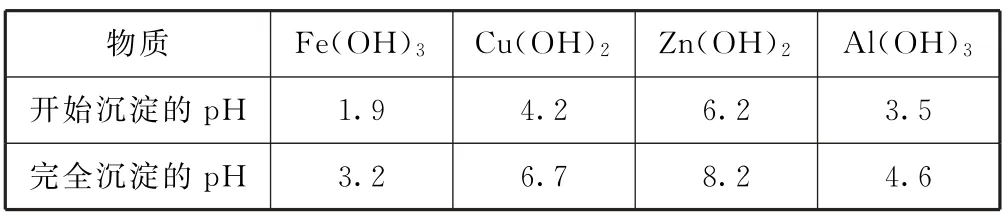
表1
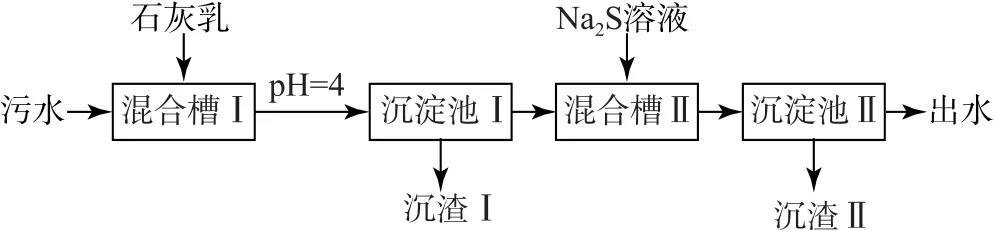
图5
②Ksp(CuS)=6.4×10—36,Ksp(ZnS)=1.6×10—24.
下列说法错误的是( ).
A.“沉渣Ⅰ”中含有Fe(OH)3和Al(OH)3
B.Na2S 溶液呈碱性,其主要原因是S2—+H2O⇌HS—+OH—
C.“沉淀池Ⅱ”中,当Cu2+和Zn2+完全沉淀时,溶液中=4.0×10—12
D.“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水
选项C正确.污水经过处理后其中含有较多的Ca2+和部分Al3+,故“出水”应该经过阳离子交换树脂软化处理,达到工业冷却循环用水的标准后,才能使用,选项D 错误.答案为D.
【真题品鉴】本题考查废水中金属离子的分离和废水的循环利用,涉及盐类的水解、金属离子沉淀的pH 范围的判断、Ksp的计算等知识点,注意计算时要将选项C中的离子浓度之比转化为溶度积常数之比.
4.5 融合探究性实验和定量计算考查铜的氧化
例5(2023年湖北卷18)学习小组探究了铜的氧化过程及铜的氧化物的组成.回答下列问题.
(1)铜与浓硝酸反应的装置如图6所示,仪器A的名称为_________,装置B的作用为_________.
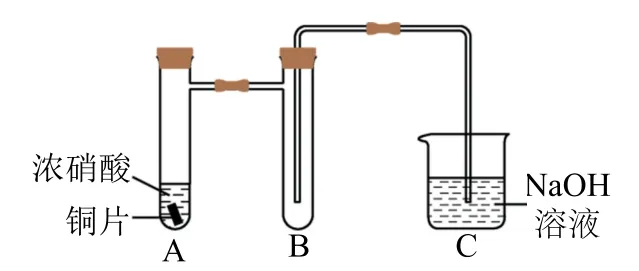
图6
(2)铜与过量H2O2反应的探究如图7所示.

图7
实验②中Cu溶解的离子方程式为_________;产生的气体为________.比较实验①和②,从氧化还原角度说明H+的作用是_________.
(3)用足量NaOH 处理实验②新制的溶液得到沉淀X,元素分析表明X 为铜的氧化物,提纯干燥后的X 在惰性氛围下加热,mgX 完全分解为ng黑色氧化物的化学式为_________.
(4)取含X 粗品0.0500g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性.以淀粉为指示剂,用0.1000 mol·L—1Na2S2O3标准溶液滴定,滴定终点时消耗Na2S2O3标准溶液15.00mL.(已知:2Cu2++4I—=2CuI↓+I2,I2+=)标志滴定终点的现象是________,粗品中X 的相对含量为_________.
故关系式为CuO2~3Na2S2O3,则
【真题品鉴】本题以化学实验的形式考查常见仪器、铜元素及其化合物的性质、离子方程式的书写、化学计算、氧化还原滴定等知识,注意第(4)问中关系式法的构建与使用.
4.6 考查氧化铜在有机物分析实验中的应用
例6(2023年全国乙卷26)元素分析是有机化合物的表征手段之一.按图8所示实验装置(部分装置略)对有机化合物进行C、H 元素分析.
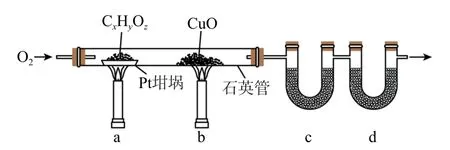
图8
回答下列问题:
(1)将装有样品的Pt坩埚和CuO 放入石英管中,先______,而后将已称重的U 形管c、d与石英管连接,检查______.依次点燃煤气灯______,进行实验.
(2)O2的作用有_________.CuO 的作用是_________(举1例,用化学方程式表示).
(3)c和d 中的试剂分别是_________、_________(填标号).c和d中的试剂不可调换,理由是________.
A.CaCl2B.NaCl
C.碱石灰(CaO+NaOH) D.Na2SO3
(4)Pt坩埚中样品CxHyOz反应完全后,应进行操作:_______.取下c和d管称重.
(5)若样品CxHyOz为0.0236g,实验结束后,c管质量增加0.0108g,d管质量增加0.0352g.质谱法测得该有机物的相对分子质量为118,其分子式为_______.
d管装有碱石灰,增加的质量为CO2的质量,由此可以得到有机物中C元素的物质的量
有机物中
该有机物中C、H、O 3 种元素的原子个数比为0.0008∶0.0012∶0.0008=2∶3∶2,且相对分子质量为118,则其化学式为C4H6O4.
【真题品鉴】本实验的重点在于两个U 形管的摆放顺序,由于CO2需要用碱石灰吸收,而碱石灰的主要成分为CaO 和NaOH,其成分中的CaO 也可以吸收水蒸气,因此在摆放U 形管位置时应将装有碱石灰的U 形管置于无水CaCl2之后,保证实验结果.
(完)

