全麻诱导后寂静肺致心脏骤停的诊断与治疗(附1例报告)
李淑蓉,潘豪,陈洪新,蔡君,吴清华,李仁威,喻耀华
1 莆田市第一医院麻醉科,福建莆田 351100;2 莆田市第一医院重症医学科
寂静肺是支气管严重痉挛或黏液广泛堵塞气道的一种气道危重征象,是一种罕见的但病死率极高的麻醉并发症,以起病急、进展快为特点,临床表现为听诊双肺呼吸音极弱或消失,人工气道呈“铁肺”手感,气道压极高,气管插管后无呼气末二氧化碳分压(PETCO2)波形或数值极低[1]。若缺乏早期识别诊断,无法及时有效处理,易在短时间内易引起严重后果,危及患者生命。本研究回顾性总结我院成功救治的1例全麻诱导后寂静肺致心脏骤停患者的的成功救治经验,同时复习相关文献,旨在为发生寂静肺致心脏骤停患者的临床救治提供参考及借鉴。
1 临床资料
患者男,72 岁,身高172 cm,体质量51 kg,因“贲门胃体癌:多周期化疗后”为主诉入院,拟于2022 年8 月5 日行全麻下气管插管胸腹联合贲门癌根治术。患者发病以来精神、睡眠、饮食可,大小便正常,近期体质量下降约1.5 kg;平素体健,活动自如,有吸烟史,既往无慢性基础疾病,否认药物及食物过敏史。
患者术前麻醉评估:心功能Ⅱ级;Mallampati 气道分级Ⅱ级,未见明显困难气道指征;双肺听诊呼吸音清,未闻及干湿性啰音;心脏各瓣膜区听诊无异常。心电图:窦性心律,肢体导联QRS 低电压。超声心动图:二尖瓣反流+、三尖瓣反流+。胸及全腹部CT:右肺多发粟粒灶,较前大致相仿;贲门胃体癌,伴周围多发淋巴结转移,无远处脏器转移征象。肺通气功能因患者配合度欠佳,未完成。血常规:血红蛋白109 g/L,余未见明显异常。肝肾功能、凝血功能等各项检查结果未见异常。
12:30 入室后监测患者心率为76 次/分,血压(BP)141/74 mmHg,脉搏血氧饱和度(SPO2)97%,常规开放静脉通路。12:37 麻醉诱导开始,面罩预吸氧5 min,SPO2100%,依次静脉推注帕洛诺0.25 mg、长托宁0.5 mg、地塞米松10 mg、瑞马唑仑0.3 mg/kg(用推注泵设置2 min 内注射完);待患者意识消失后,再次依次静脉推注舒芬太尼30 µg、丙泊酚50 mg、罗库溴铵40 mg;并托下颌面罩加压给氧,胸廓未见明显起伏;即行双人双手面罩纯氧通气,胸廓仍未见明显起伏;立即(12:45)视频喉镜辅助下插入7.5 号气管导管,插管过程顺利;导管置入深度距门齿23 cm处固定后,即行手控通气,感觉阻力极大,呈“铁肺”手感;听诊双肺未闻及呼吸音,PETCO2为1~3 mmHg。立即予肾上腺素0.3 mg 静脉推注,并吸痰后再次以视频喉镜暴露,显示导管在声门;迅速行纤维支气管镜检查,未见气管内异物堵塞,同时排除回路堵塞、滑脱、插管过深和气胸等因素。12:46 SPO2下降至88%,SPO2波形基本成一直线;心电图显示QRS 低平,随即基本成一直线。立即行胸外心脏按压(CPR),紧急呼叫抢救,呼叫相关科室紧急会诊。行CPR 期间,行手控通气,仍呈“铁肺”手感;同时两次静脉注射肾上腺素1 mg,PETCO2显示8~16 mmHg。高度怀疑严重支气管痉挛,立即静脉输注甲泼尼龙40 mg、氨茶碱0.25 g。12:58 患者心跳恢复,BP 85/40 mmHg,SPO2升至96%。建立有创动脉血压监测,进行血气分析,指标包括酸碱度(pH)、血氧分压(PaO2)、二氧化碳分压(PaCO2)、乳酸(LAC)、碳酸氢根(HCO3-)、血液碱剩余[BE(B)]、动脉血氧饱和度(SaO2)、吸入氧浓度(FiO2)。见表1。听诊双肺未闻及明显的呼吸音。13:05 患者再次出现室颤,立即胸外按压,电除颤1 次,静脉输注碳酸氢钠125 mL,追加甲泼尼龙80 mg。13:08 患者心跳恢复,但血压持续性降低,立即以大剂量去甲肾上腺素、肾上腺素持续泵注;此时气道压仍然达40 cmH2O,听诊双上肺闻仍未闻及呼吸音,双下肺可闻及微弱哮鸣音。13:10 患者再次心跳骤停,行持续CPR 及电除颤2 次。13:17患者心跳恢复,心电图提示频发室性早搏,静脉注射利多卡因100 mg,胺碘酮150 mg 缓慢静推后持续泵注1 mg/min。静脉输注乌司他汀40 万U、葡萄糖酸钙1 g改善循环治疗。按压期间平均动脉压60~80 mmHg,PETCO213~23 mmHg,SPO288%~100%;听诊双上肺可闻及极微弱的呼吸音,双下肺闻及较前稍明显的哮鸣样呼吸音;PETCO240~46 mmHg。13:58 听诊双上肺均可闻及稍明显的哮鸣音。16:30 患者生命体征相对平稳后,急查冠状动脉及肺部CT 血管造影(CTA)未见明显异常,并转入重症监护病房(ICU)继续治疗。在ICU 予镇静、呼吸机辅助呼吸及血管活性药治疗,由于Lac 持续性增高至10.6 mmol/L(表1),22:30 启动床边血液滤过治疗(CRRT)。8 月6 日患者意识模糊,呼之能睁眼;查血常规:白细胞计数12.82×109/L,中性粒细胞百分比88.84%,C 反应蛋白18.40 mg/L,考虑可能存在感染,予抗感染及其它对症处理。8月7日16:00 停止床边CRRT 治疗,3 d 后患者转出ICU,6 d后康复出院。
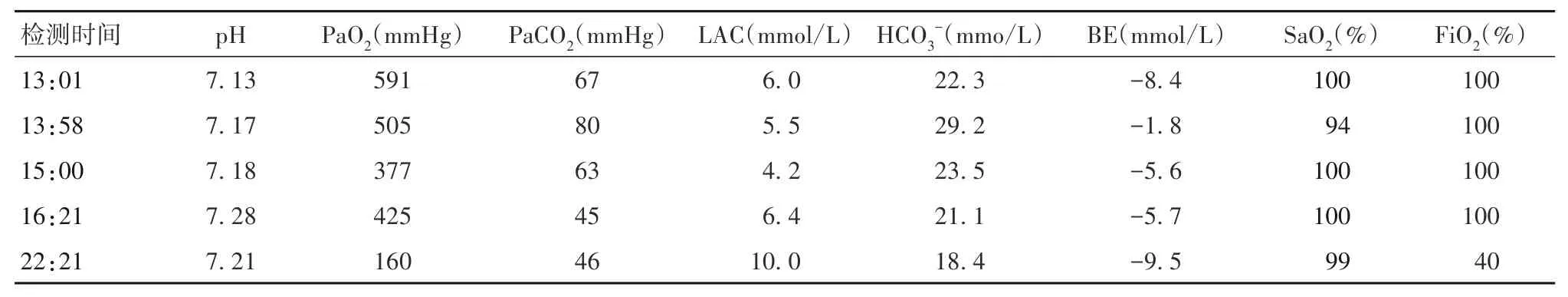
表1 患者血气分析结果
2 讨论
围手术期发生寂静肺的原因及机制尚未完全清楚,多数学者认为其可能是气道炎症、神经受体及免疫等机制等共同作用的结果[2]。分析本病例发生寂静肺的可能原因为:①气道处于高反应状态。患者虽平时无明显的哮喘或咳嗽等呼吸道症状,但先后接受了多个周期的化疗,同时有长期吸烟史,这些均可能造成气道高反应。有研究显示,有长期吸烟史并合并近期呼吸道感染者,围手术期寂静肺的发生率显著增高[3]。患者术前血常规显示血红蛋白稍低,其他指标正常,术后第2天复查显示炎症指标偏高,因此不排除此时气道处于高反应状态。②药物影响。某些麻醉药物可诱发围手术期寂静肺的发生,如吗啡、低分子右旋糖酐、肌松药等具有组胺释放作用,易诱发支气管痉挛,导致寂静肺的发生[4]。本病例麻醉诱导时使用了肌松药罗库溴铵,其虽只具有轻微组胺释放作用,但联合患者化疗后骨髓抑制、免疫力下降,可能为寂静肺发生的诱因之一。NAKAFERO 等[5]研究显示,苯二氮䓬类药物可能增加哮喘急性发作的概率及相关病死率。本病例在麻醉诱导中使用的瑞马唑仑属于苯二氮䓬类药物,因此寂静肺的发生亦可能与其有关。③全麻及气管内操作。全麻中因呛咳反射被抑制、咽颚肌张力降低、气道黏膜功能受损、分泌物增多等改变,使干燥、低温的麻醉气体容易诱发支气管痉挛;且在浅麻醉状态下,气管插管、拔管、吸痰等气道内操作以及手术牵拉等刺激均可能与围手术期寂静肺的发生相关[6]。
通常情况下,严重支气管痉挛导致呼吸循环衰竭的主要原因是通气受限引起的低氧血症。但本病例发现寂静肺的症状时随即发现心脏骤停,SPO2波形基本成一直线,其数值显示88%左右,心电图显示QRS 低平,随即基本成一直线,这可能与寂静肺导致心脏无脉性电活动有关[7-8]。寂静肺时,严重支气管痉挛导致气流严重呼出受阻,导致瞬间肺膨胀,内源性呼气终末正压升高,胸腔内压增加,不仅引起呼吸做功增加,导致回心血量迅速下降,同时导致肺动脉压力迅速升高,心脏后负荷急剧增加,从而形成心脏的无脉性电活动。本病例在抢救过程中反复发生心脏骤停,而在双上下肺闻及呼吸音时,心脏骤停没有再发生,且急查冠脉CTA 未见明显异常,故考虑心脏骤停由寂静肺引发。本病例因发现及时复苏成功,虽然在第一时间内无法判断病因,但及时给予患者高质量的CPR 是此次抢救成功的关键。支气管痉挛是呼气性呼吸困难,CPR形成人工呼气,胸廓反弹形成胸腔负压使人工吸气从而完成肺通气循环[9]。这也解释了为何术中PETCO2在CPR 期间一直维持在18 mmHg 左右,血气分析时SaO2一直为100%。
有研究表明,呼吸系统事件是麻醉相关不良事件的主导因素,其发生率占7.90%~80.00%[10]。本例术前否认哮喘、咳嗽及慢性鼻窦炎等诱发支气管痉挛的高危因素[4],但仍然发生了重度支气管痉挛,并在发现时即并发循环衰竭心脏骤停,提醒临床医师除考虑常见的因素外,需时刻警惕意外发生,并做好抢救的充分准备。①加强术中监测手段,除了常规的心电图、BP、SPO2外,需提高监测手段如PETCO2监测及气道压力报警设置等,也要注重结合传统的监测手段如视、触、叩、听诊的应用[11]。②加强气管插管可视化工具的应用,以免错误判断气管导管位置,避免盲目拔管再插管,不仅造成二次创伤,更延误抢救时机。③一旦发生寂静肺致心脏骤停,立即纯氧吸入,加大氧气流量,进行手动通气维持氧合,如PETCO2仍不理想,必要时可启动CPR,以促进人工肺通气循环。④治疗药物的选择:肾上腺素因具有β2受体激动作用,扩张支气管作用较强,且其α 受体作用可以改善黏膜水肿降低气道压,使其通气改善,是缓解寂静肺的首选药物;β2受体激动剂如沙丁胺醇喷雾剂是缓解支气管痉挛有效药物之一,可以气管内喷雾以扩张支气管,对于术前高危的患者用于防患尤其重要;糖皮质激素具有抗炎、减轻气道水肿的作用;对于难治性支气管痉挛,硫酸镁可能有效,可静脉输注硫酸镁2 g,输注时间不少于20 min[12]。
综上所述,本病例在麻醉诱导时即因重度支气管痉挛寂静肺致心脏骤停,呼吸音完全消失,心脏骤停迅速,需临床医生快速诊断,积极给予正确处理,以保障患者围手术期的安全。虽抢救及时,但对患者的检查中也存在不足之处:术前患者多次化疗,可能已存在放射性肺损伤,导致肺泡塌陷、肺顺应性降低、组织纤维化,肺储备功能下降[13],术前却因患者肺通气功能检查时配合欠佳而忽视肺功能的监测,如果术前重视肺功能的监测并多加呼吸功能的锻炼,可能会减少呼吸系统不良事件的发生。

