子宫内膜癌组织LncRNA OGFRP1、TDRG1表达变化及其与PI3K/AKT信号通路和预后的关系
邢堃,宋丹,康程
1 北京航天总医院妇产科,北京 100076;2 首都医科大学附属北京妇产医院妇瘤科
子宫内膜癌(EC)是女性生殖系统常见恶性肿瘤,早期EC预后较好,但中晚期EC因缺乏有效治疗方式预后较差[1]。因此,寻找相关分子标志物有利于指导EC 的临床治疗。长链非编码核糖核酸(LncRNA)是一类真核生物中长度大于200 nt的非编码RNA 分子,能够通过调控多种靶基因和信号通路参与EC的发生发展[2]。阿片类生长因子受体假基因1(OGFRP1)是新近发现的一种LncRNA,可用于预测结直肠癌患者的预后[3],近期研究发现其在EC 中异常表达[4]。另有研究发现,LncRNA TDRG1 对宫颈癌预后有一定的预测作用[5],且其异常表达参与了EC 的发生发展[6]。既往研究显示,磷脂酰肌醇3 激酶/蛋白激酶B(PI3K/AKT)信号通路参与EC 的发生发展[7]。但是,LncRNA OGFRP1、TDRG1 在EC 中是否与PI3K/AKT 存在调控关系及其与预后的关系尚不明确。2016 年1 月—2019 年12 月,本研究观察了EC 组织LncRNA OGFRP1、TDRG1 表达变化并分析其与PI3K/AKT 信号通路和预后的关系,旨在为临床防治EC提供更多依据。
1 资料与方法
1.1 临床资料 经北京航天总医院医学伦理委员会批准[(2015)临床(139)],选取2016年1月—2019年12 月我院及首都医科大学附属北京妇产医院收治的EC患者作为研究对象。纳入标准:①经实验室检查、病理检查确诊为EC;②心肝肾等脏器功能正常;③临床资料完整;④受试者及家属签署知情同意书。排除标准:①国际妇产科联盟(FIGO)分期为Ⅳ期;②伴有急慢性感染、免疫系统疾病;③合并其他部位恶性肿瘤;④无法配合检查及随访。共收集符合标准的EC 患者90 例,患者年龄(50.17 ± 5.82)岁,分化程度低分化39例、中高分化51例,组织学分型Ⅰ型75 例、Ⅱ型15 例,FIGO 分期Ⅰ~Ⅱ期55 例、Ⅲ期35例,淋巴结转移18例、未转移72例。
1.2 EC 和癌旁组织LncRNA OGFRP1、TDRG1 及PI3K、AKT mRNA 检测方法 采用RT-qPCR 法。取EC患者病理活检时肿瘤组织及相应癌旁组织(距肿瘤组织≥5 cm 且经病理证实为正常组织),使用TRIzol 试剂盒(上海源叶生物科技有限公司)提取EC患者癌组织和癌旁组织的总RNA,使用反转录试剂盒(北京伊塔生物科技有限公司)合成cDNA,使用实时荧光定量试剂盒(北京百奥莱博科技有限公司)进行实时荧光定量聚合酶链式反应,严格按照试剂盒说明书操作。引物序列:LncRNA OGFRP1上游引物5'-TGGCTGCCCACAAGATAATG-3',下游引物5'-GCCTCCCATCAAAAGCTCCT-3';LncRNA TDRG1上游引物5'-CACCCTGTTGCTGTAGCCAAA-3',下游引物5'-TGGGCCAGGGAGCAGCTGGTG-3';PI3K上游引物5'-CCACGACCATCATCAGGTGAA-3',下游引物5'-CCACGACCATCATCAGGTGAA-3';AKT上游引物5'-TCCTCCTCAAGAATGATGGCA-3',下游引物5'-GTGCGTTCGATGACAGTGGT-3';GAPDH上游引物5'-TCAATGTCGGCGCCTATTTC-3',下游引物5'-CACCCTGTTGCTGTAGCCAAA-3'。反应条件:90 ℃ 95 s,90 ℃ 35 s,60 ℃ 35 s,70 ℃ 18 s,共40个循环。以GAPDH 为内参,按2-ΔΔCt计算LncRNA OGFRP1、TDRG1 及PI3K、AKT mRNA 的相对表达量。根据EC 组织中LncRNA OGFRP1、TDRG1 的表达均值将患者分为LncRNA OGFRP1、TDRG1 高表达者及低表达者。
1.3 预后随访方法 EC 患者出院后随访3 年,随访形式为电话或门诊,随访终止事件为患者死亡或随访截止时间(2022 年12 月),统计并计算患者3 年总生存率。
1.4 统计学方法 采用SPSS28.0 统计软件。计量资料采用Kolmogorov-Smirnov进行正态性分析,符合正态分布的以-x±s表示,组间比较行t检验;计数资料以例(%)表示,数据比较行χ2检验。采用Pearson相关性分析EC 组织中LncRNA OGFRP1、LncRNA TDRG1 与PI3K mRNA、AKT mRNA 的相关性;K-M法绘制EC 组织中不同LncRNA OGFRP1、LncRNA TDRG1 表达患者的生存曲线,Log-Rank 检验分析EC 组织LncRNA OGFRP1、LncRNA TDRG1 表达与患者预后的关系;COX 回归分析EC 患者预后的影响因素,取单因素COX 回归分析结果P<0.05 的临床指标进一步纳入多因素COX 回归分析,总结影响EC 患者预后的独立危险因素。P<0.05 为差异有统计学意义。
2 结果
2.1 EC 和癌旁组织LncRNA OGFRP1、TDRG1 及PI3K、AKT mRNA 表达比较 EC 及癌旁组织中LncRNA OGFRP1 表达分别为1.19 ± 0.23、0.56 ±0.13,LncRNA TDRG1 表达分别为1.35 ± 0.31、0.74 ± 0.19,PI3K mRNA 表达分别为1.24 ± 0.25、0.80 ± 0.20,AKT mRNA 表达分别为1.22 ± 0.27、0.89 ± 0.17;EC 组织中LncRNA OGFRP1、LncRNA TDRG1 及PI3K、AKT mRNA 表达均高于癌旁组织(P均<0.05)。
2.2 EC 组织LncRNA OGFRP1、TDRG1 与PI3K、AKT mRNA 表达的相关性 Pearson 相关性分析结果显示,EC 组织中LncRNA OGFRP1 表达与PI3K、AKT mRNA 表达呈正相关(r分别为0.584、0.571,P均<0.01),LncRNA TDRG1 表达与PI3K、AKT mRNA 表达呈正相关(r分别为0.593、0.584,P均<0.01)。
2.3 LncRNA OGFRP1、TDRG1 高低表达EC 患者预后比较 90 例EC 患者中LncRNA OGFRP1 高表达47 例、低表达43 例,LncRNA TDRG1 高表达45 例、低表达45 例。至随访结束,90 例EC 患者死亡29 例,3 年总生存率为67.78%。Log-Rank 检验显示,LncRNA OGFRP1 高、低表达EC 患者3 年总生存率分别为55.32%、81.40%,LncRNA OGFRP1 高表达EC 患者3 年总生存率低于LncRNA OGFRP1 低表达患者;LncRNA TDRG1高、低表达EC 患者3 年总生存率分别为53.33%、82.22%,LncRNA TDRG1 高表达EC 患者3 年总生存率低于LncRNA TDRG1 低表达患者(P均<0.01)。见OSID 码图1、2。
2.4 LncRNA OGFRP1、TDRG1 表达与EC 患者预后的关系 以EC 患者生存状态为因变量(死亡=1,存活=0),年龄(≥50 岁=1,<50 岁=0)、组织学分型(Ⅱ型=1,Ⅰ型=0)、分化程度(低分化=1,中高分化=0)、FIGO 分期(Ⅲ期=1,Ⅰ~Ⅱ期=0)、淋巴结转移(是=1,否=0)、LncRNA OGFRP1(≥1.19=1,<1.19=0)、LncRNA TDRG1(≥1.35=1,<1.35=0)为自变量纳入单因素Cox 回归分析。结果显示,分化程度中高分化、FIGO 分期Ⅲ期、淋巴结转移、LncRNA OGFRP1≥1.19 及LncRNA TDRG1≥1.35 是影响EC 患者预后的危险因素(P均<0.05)。多因素Cox 回归分析显示,FIGO 分期Ⅲ期、淋巴结转移、LncRNA OGFRP1≥1.19、LncRNA TDRG1≥1.35为影响EC 患者预后的独立危险因素(P均<0.05)。见表1。
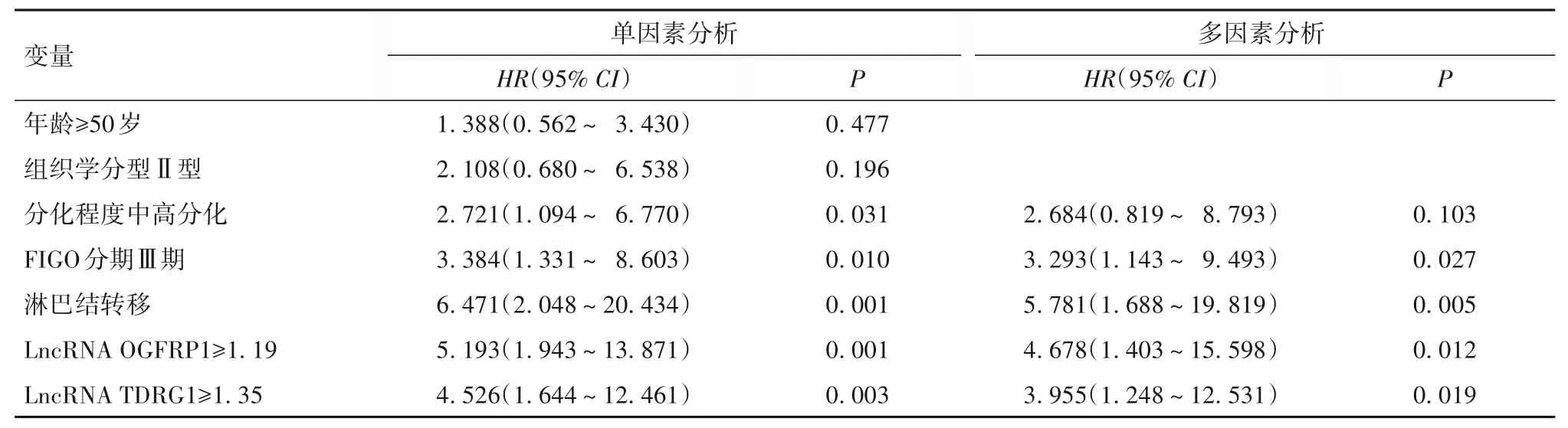
表1 EC患者预后影响因素的COX回归分析结果
3 讨论
EC 以阴道不规则流血、排液为主要临床表现,其发病可能与遗传、性激素紊乱、代谢异常、高血压、雌激素暴露等因素有关[1]。尽管近年来腹腔镜手术、精准放化疗、免疫治疗等取得较大进展,但仍有很多患者治疗效果一般,且获得性耐药患者随着治疗时间的延长逐渐增加[8]。因此,深入探索EC 相关标志物,分析EC患者预后不良的危险因素和分子机制对于指导临床治疗及改善患者预后具有积极的意义。
相关报道表明,表观遗传能够通过影响多种基因表达参与EC 的发生发展[9]。LncRNA 可通过直接与蛋白质相互作用、与微小RNA(miRNA)相互作用形成内源竞争RNA、编码蛋白质或多肽等多种方式调控EC 进程[2]。CHEN 等[10]研究发现,下调LncRNA OGFRP1 能通过抑制AKT/mTOR 及Wnt/β-catenin 信号通路抑制肝癌细胞增殖、迁移和侵袭,提示LncRNA OGFRP1 参与肿瘤发生发展过程。DONG 等[11]研究显示,抑制LncRNA OGFRP1 表达能靶向miR-423-5p/CCCTC轴结合因子抑制结直肠癌细胞的血管生成和上皮—间质转化。上述研究均提示,LncRNA OGFRP1 可能是一种促癌基因。同时有研究报道,LncRNA OGFRP1 高表达还与结直肠癌[3]、肺腺癌[12]患者的预后不良有关。但是关于LncRNA OGFRP1 与EC 患者预后的关系尚未明确。本研究结果显示,EC 组织中LncRNA OGFRP1 表达上调,且与分化程度、FIGO 分期、淋巴结转移有关,提示LncRNA OGFRP1 高表达参与了EC 进程。分析其原因可能为LncRNA OGFRP1 高表达可靶向miR-124-3p 上调沉默信息调节因子1,促进EC 细胞上皮—间质转化,进而促进EC 的恶性进展[4]。PI3K/AKT 信号通路主要受体酪氨酸激酶激活,上调PI3K 复合物活性可导致AKT 激活,AKT 可通过激活mTOR、糖原合成酶激酶3β(GSK-3β)等分子,促进EC 细胞增殖、分化、迁移和侵袭等生理病理过程[13]。CHEN 等[10]研究报道,LncRNA OGFRP1 参与AKT/mTOR 信号通路调控。本研究结果显示,EC 组织中LncRNA OGFRP1 与PI3K mRNA、AKT mRNA 表达呈正相关,提示LncRNA OGFRP1 高表达可能通过调节PI3K/AKT 信号通路参与EC 进展。LV 等[4]研究也表明,LncRNA OGFRP1 高表达可导致EC 中PI3K/AKT/GSK-3β信号通路激活,进而促进EC 细胞增殖、迁移和侵袭。
多项研究表明,LncRNA TDRG1 参与肿瘤发生发展过程[14]。王帅奇等[15]研究报道,敲低LncRNA TDRG1 能够靶向miR-101-3p 抑制结直肠癌细胞增殖、侵袭和迁移。LU 等[16]研究发现,抑制LncRNA TDRG1 表达可靶向miR-423-5p/KLF5 信号通路,抑制非小细胞肺癌细胞的生长、迁移和侵袭并加速其凋亡。上述研究提示,LncRNA TDRG1 可能也是一种促癌基因。同时,DONG 等[17]通过分析EC 细胞中的LncRNA 发现,LncRNA TDRG1 在EC 细胞中高表达。有学者指出,LncRNA TDRG1 高表达与非小细胞肺癌[18]、卵巢癌[19]患者的预后不良有关,而关于LncRNA TDRG1 与EC 患者预后的关系尚未明确。
本研究结果显示,EC组织中LncRNA TDRG1表达上调,与分化程度、FIGO 分期、淋巴结转移有关,提示LncRNA TDRG1 高表达参与EC 进程。分析其原因可能为LncRNA TDRG1 高表达能够靶向上调血管内皮生长因子A,刺激新生血管生成,从而促进EC细胞增殖和侵袭[6]。本研究结果显示,EC组织中LncRNA TDRG1 与PI3K、AKT mRNA 表达呈正相关,提示LncRNA TDRG1 高表达可能通过调节PI3K/AKT 信号通路参与EC 进展。SUN 等[20]研究也发现,敲低LncRNA TDRG1 能通过PI3K/AKT/mTOR 信号通路抑制EC 细胞增殖、迁移、侵袭并促进其凋亡。
本研究通过随访发现,LncRNA OGFRP1、TDRG1 高表达的EC 患者的3 年总生存率低于低表达患者,提示LncRNA OGFRP1、TDRG1 表达与EC患者预后有关。进一步分析发现,LncRNA OGFRP1≥1.19、LncRNA TDRG1≥1.35 为影响EC 患者预后的独立危险因素,提示LncRNA OGFRP1、TDRG1 升高会增加EC患者死亡风险,两者有望成为辅助评估EC患者预后的潜在指标。
综上所述,EC 组织中LncRNA OGFRP1、TDRG1表达升高,LncRNA OGFRP1、TDRG1 表达与PI3K/AKT信号通路相关分子表达存在相关性,且为EC患者预后不良的独立危险因素。然而LncRNA OGFRP1、TDRG1表达通过调控PI3K/AKT信号通路影响预后的具体分子机制尚不明确,期待后续研究进一步深入分析。

