微小RNA-3679与小鼠异种移植物肿瘤生长的关系研究*
何静宇,周雪琴,李艺明,王文涛
1.绵阳市第三人民医院•四川省精神卫生中心 肝胆胰外科(绵阳 621000);2.四川大学华西医院 肝脏外科(成都 610041)
微小RNA(micro-ribonucleicacid,miRNA)是由约为22 个核苷酸组成的一类内源性非编码RNA,为高度保守的非编码小分子单链RNA,家族成员众多,随着分子生物学的进展,不断有新的家族被发现,其主要以单拷贝、多拷贝、基因簇等形式广泛存在于真核生物中,在动植物中参与转录后调控基因表达[1-2]。 miRNA可通过与靶基因的3′非翻译区(3′-untranslated region,3′-UTR)结合,抑制靶基因的表达或促进其降解,并参与细胞内的转录后调节[3],其虽然不能直接编码蛋白质,但目前估计约30%的人类编码基因受miRNA 的调控[4],通过转录后调节超过60%的人体蛋白质编码基因[5]。因此,miRNA参与机体多种生理病理过程及生物学功能,并在肿瘤的发生、发展中起重要作用。研究[6-11]表明,部分miRNA家族成员可作为众多肿瘤预后指标及治疗靶点。miRNA-3679 是miRNA家族成员之一,在肺鳞癌[12]、冠状动脉钙化[13]、骨质疏松[14]、结肠癌[15]、胰腺癌[16]等方面有所研究,但均未涉及到与下游靶基因关系的验证及机制研究。目前国内外未见相关文献报道miRNA-3679 与肝细胞癌(hepatocellular carcinoma,HCC)的关系、是否影响其进展等。前期课题组通过临床及细胞学实验证实,miRNA-3679 可通过ZADH2靶基因发挥促进肝癌细胞增殖。本研究将通过裸鼠成瘤实验,进一步验证miRNA-3679、ZADH2与HCC的关系。
1 材料与方法
1.1 主要材料
空军军医大学动物中心提供的雄性BALB/c裸鼠(18~22 g);miRNA第一链cDNA合成试剂盒(货号:B532451-0020)、miRNA实时荧光定量PCR(quantitative real-time PCR,qPCR)试剂盒(货号:B532461-0002)购自上海生物工程有限公司;miRNA-3679-Forward序列(由西安擎科泽西生物科技有限公司设计):5′-TGAGGATATGGCAGGGAAGGGGA-3 ′;miRNA-3679-Reverse:Universal oligo dT primer;ZADH2-Forward:5′-TAGAATCCTGCGCTCACTGC-3′;ZADH2-Reverse:5′-GGATTCGCGCATTTGGAGAC-3′;GAPDH-Reverse:5′-GGGGTCATTGATGGCAACA ATA-3′;GAPDH-Forward:5′-ATGGGGAAGGTG AAGGTCG-3′;Lipofectamine 3000(购自美国加利福尼亚州Invitrogen公司,货号:L3000015);Ki-67(货号:27309-1-AP)、BAX(型 号:60267-1-Ig)、BCL2(型号:60178-1-Ig)、Caspase 3/P17/P19(型 号:66470-2-Ig)、Caspase 9/P35/P10(型号:66470-2-Ig)及GAPDH单克隆抗体(型号:BL006B)均购自美国芝加哥Proteintech公司; Anti-Rabbit IgG antibody(二抗,购自广州赛国生物科技有限公司,型号:BL003A);Anti-Cleaved Caspase-9 抗体(一抗,购自英国剑桥Abcam公司,型号:AB2324)。
1.2 主要方法
1.2.1 实验分组 将裸鼠随机分为3 组,空白对照组(NC组),抑制miRNA-3679 组(miRNA-3679 inhibitor,CT1组)及同时转染miRNA-3679 inhibitor与si-ZADH2组(miRNA-3679 inhibitor+si-ZADH2,CT2 组),每组各40 只。
1.2.2 裸鼠成瘤、瘤体质量及体积测定 采用转染miRNA-3679 inhibitor、同时转染miRNA-3679 inhibitor与si-ZADH2的Hep3B细胞,以0.25 mL的含2.0×106个细胞重悬于0.25 mL的PBS中,将0.25 mL细胞悬浮液皮下注射到每只裸鼠中,测量异种移植物肿瘤的大小。使用卡尺获得长度、宽度和厚度的测量值,计算肿瘤体积。分别于7、14、21、28 d,取裸鼠10 只,静脉麻醉后取出肿瘤并称质量,肿瘤组织用于进一步研究。
1.2.3 qPCR 采用Trizol法提取RNA,Nanodrop 2000 检测肝癌细胞系RNA浓度及纯度,反转录,qPCR检测。结果处理:ΔΔCT法:A=CT(目的基因,待测样本)-CT(内标基因,待测样本),B=CT(目的基因,对照样本)- CT(内标基因,对照样本),K=A-B,表达倍数=2-K。
1.2.4 蛋白质免疫印迹 所有蛋白样品调至相等浓度后上样,分别上样10μL,样品两侧泳道用相同体积的缓冲液上样,Marker也用等体积缓冲液调整至与样品相等的体积,以70 V电压进行稳压电泳,当蛋白marker分离开来时,电压调节至120 V 进行稳压电泳,待溴酚蓝泳动至距胶下缘1 cm处结束电泳。电泳结束前准备、取胶、转膜,封闭、洗涤,结合一抗、洗涤,结合二抗、洗涤,采用增强化学发光法鉴定。
1.2.5 石蜡切片免疫组织化学 石蜡切片脱蜡至水,血清封闭,加一抗、二抗,AEC显色,复染细胞核,封片,显微镜镜检,图像采集分析。结果判读:苏木素染细胞核为蓝色,DAB显出的阳性表达为棕黄色。
1.3 统计学方法
采用IBM SPSS Statistics 22.0 统计学软件进行分析,定量资料采用()描述,组间比较采用单因素方差分析,进一步两两比较采用Dunnett'st检验,检验水准α除特别说明外均设定为0.05。
2 结果
2.1 3 组瘤体体积大小和质量比较
分别于7、14、21、28 d对裸鼠体内瘤体体积及质量测定,结果显示,在28 d时,CT1组肿瘤体积、质量均小于NC组和CT2组,差异有统计学意义(P<0.01)(图1)。

图1 3 组瘤体体积大小和质量
2.2 qPCR 检测各组miRNA-3679 及ZADH2 表达水平
CT1组及CT2组中miRNA-3679的表达低于NC组,但CT2组中miRNA-3679的表达高于CT1组(P<0.01);CT1组中的ZADH2表达高于NC组和CT2组(P<0.001)(图2)。
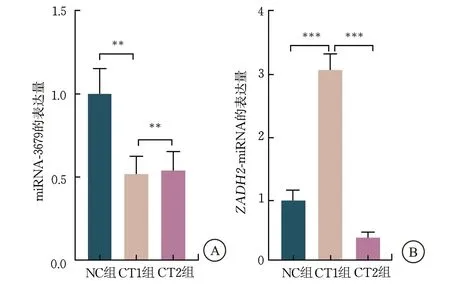
图2 各组miRNA-3679 及ZADH2 的表达水平
2.3 蛋白质免疫印迹检测ZADH2 蛋白表达
与NC组比较,CT1 组中的ZADH2 蛋白表达明显升高(P<0.001);CT2组ZADH2蛋白表达低于CT1组(P<0.001)(图3)。

图3 各组ZADH2 相关蛋白表达
2.4 蛋白质免疫印迹检测相关凋亡蛋白的表达
Bax、Caspase-3、Caspase-9 蛋白表达在CT1 组高于NC组和CT2 组(P<0.05);但Bcl-2 蛋白表达在CT1组低于NC组和CT2 组(P<0.05)(图4)。

图4 蛋白质免疫印迹检测相关凋亡蛋白表达
2.5 免疫组织化学染色测定Caspase-3 的表达
免疫组织化学染色测定显示,CT1组的Caspase-3蛋白表达高于NC组和CT2组,差异有统计学意义(P<0.001)(图5)。
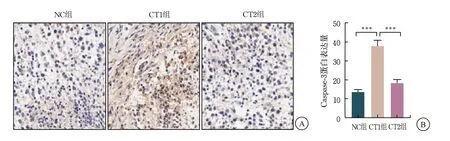
图5 免疫组织化学染色测定Caspase-3 的表达(×200)
2.6 Ki-67 免疫组织化学染色分析各组细胞增殖情况
抑制miRNA-3679 后,CT1 组肿瘤细胞数量少于NC组(P<0.01),CT2 组肿瘤细胞多于CT1 组(P<0.01)(图6)。
3 讨论
miRNA通过转录后调节因子,对机体很多生物学过程产生重要的影响,可影响肿瘤细胞凋亡、分化及肿瘤转移等[17];ZADH2基因因可塑性相关基因蛋白3(plasticity-related-gene 3,PRG-3)被熟知。PRG-3 是PRGs家族中的一员,目前已发现5 种PRG,均属于脂质磷酸酯酶超家族,主要表达于中枢神经系,扮演Ⅱ型跨膜蛋白的作用,并且在神经元的环境中,可抑制由神经突生长抑制剂(如LPA和Nogo-A)诱导的RhoA依赖性轴突塌陷信号[18]。与其他PRG相比,PRG3 没有表现出明显的胞外磷酸酶活性,并且在细胞外区域,PRG3 不携带任何关键氨基酸[19]。尽管PRGs是一神经元家族基因,但PRG3 在选择细胞群方面似乎起着独特的作用,它不仅限于中枢神经系统组织,在其他脏器如肝脏、心脏、肺部等都有表达[20]。Choi等[21]报道,ZADH2基因异常与血清中血管内皮生长因子(vascular endothelial growth factor,VEGF)的升高有关,VEGF在肿瘤的增殖、转移及侵袭等方面发挥重要作用[22]。课题组通过前期实验证实,miRNA-3679 可通过抑制ZADH2靶基因促进HCC细胞增殖、存活,并抑制其凋亡。本研究将验证miRNA-3679 与ZADH2 在小鼠异种移植物(Hep3B)肿瘤中的作用,以进一步阐述miRNA-3679、ZADH2 与HCC的关系。
为研究miRNA-3679、ZADH2 对裸鼠成瘤的影响,分别于7、14、21、28 d对小鼠体内瘤体体积及质量测定,结果显示,随着时间的推移,肿瘤体积及质量均逐渐增加,在28 d时,CT1 组肿瘤体积、质量均小于NC组和CT2 组,说明抑制miRNA-3679 的表达可抑制小鼠体内的肿瘤生长,但同时抑制其下游靶基因ZADH2后,抑制肿瘤生长的作用明显降低,说明抑制ZADH2后可阻断该途径抑制肿瘤的生长。因此,miRNA-3679 可通过下游靶基因ZADH2发挥促进肿瘤生长的作用。
本研究通过qPCR检测各组癌组织中的miRNA-3679及ZADH2含量,结果提示,抑制miRNA-3679后可促进小鼠体内肿瘤中ZADH2的表达,同时抑制miRNA-3679及ZADH2 后,瘤体内ZADH2 的表达明显降低,提示miRNA-3679与ZADH2存在单向作用的关系。进一步蛋白质免疫印迹检测各组相关蛋白表达,亦得出相同趋势,说明miRNA-3679可通过ZADH2途径发挥生物学效应。
细胞凋亡是一个受多种基因精确调控的、主动的、程序化的死亡过程[23]。传统的凋亡包含3个主要途径:Bcl-XL和Bcl-2相关蛋白(Bcl-2 associated X protein,Bax)介导的信号通路,线粒体和死亡受体诱导的途径以及经内质网途径介导的途径。这些途径涉及到活性氧的产生和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族参与胞内信号转导通路[24]。肿瘤发生与发展常伴随肿瘤细胞的凋亡受到抑制。研究[25]表明,HCC细胞的凋亡与组织学分级、淋巴结转移和临床分期密切相关。细胞凋亡主要由Caspase家族蛋白介导,其中活化的Caspase-3(Cleaved-Caspase-3)是细胞凋亡的主要执行蛋白[26]。Bcl-2属于抗凋亡蛋白,而Bax是一种促凋亡蛋白。当细胞接收到凋亡信号时,Bax促使线粒体中的凋亡因子释放,激活Caspase-3 形成 Cleaved-Caspase-3,从而促进细胞凋亡[27]。为研究miRNA-3679和ZADH2对小鼠体内肿瘤凋亡的影响,本研究使用蛋白质印迹技术检测各组肿瘤组织相关凋亡蛋白(如pro-Caspase-9、Cleaved-Caspase-9、pro-Caspase-3、Cleaved-Caspase-3、Bax、Bcl-2)表达水平。结果提示,抑制miRNA-3679 后,小鼠体内肿瘤凋亡蛋白(Bax、Caspase-3、Caspase-9)的表达增加,但同时抑制抗凋亡蛋白Bcl-2 的表达。然而,在抑制ZADH2后,这种促进作用被阻断。免疫组织化学染色结果显示,CT1 组的Caspase-3 蛋白表达高于NC组和CT2 组,说明抑制miRNA-3679并靶向ZADH2基因,可促进凋亡蛋白的产生,抑制抗凋亡蛋白Bcl-2的表达,从而促进肿瘤细胞凋亡。因此,这可能成为1个潜在的治疗靶点。
肿瘤细胞的增殖能力及细胞存活能力与肿瘤的侵袭性密切相关。李利容等[27]认为,细胞周期的调控与肿瘤的发生及发展关系密切,细胞周期机制调控受损可导致机体细胞的恶性增殖、侵袭性增加及异常凋亡等现象,肿瘤发生与发展常伴随肿瘤细胞的凋亡受抑制。因此,为了解miRNA-3679 和ZADH2 对小鼠体内肿瘤细胞增殖的影响,本研究进行了免疫组织化学染色评估,结果提示,抑制miRNA-3679 后,CT1 组肿瘤细胞数量明显少于NC组,而CT2 组肿瘤细胞明显多于CT1组(P<0.01)。结果提示,抑制miR-3679 可抑制小鼠体内肿瘤细胞的增殖,但ZADH2可以阻断该途径。
综上所述,miRNA-3679 可以促进小鼠异种移植物(Hep3B)肿瘤的发生与发展,它通过下游靶基因ZADH2发挥作用。

